引言
2020年11月19日,礼来制药与因赛特医疗(INCYTE)共同宣布,美国食品药品监督管理局(FDA)批准礼来制药巴瑞替尼的EUA(紧急使用授权),与瑞德西韦联用后用于成年住院患者、2岁及以上的儿童住院患者,这些患者为疑似或实验室确诊的2019新型冠状病毒肺炎(COVID-19)病例并需要辅助供氧、侵入性机械通气或体外膜氧合(ECMO)。
巴瑞替尼
巴瑞替尼(Baricitinib, Olumiant®)是由礼来制药和因赛特医疗(INCYTE)共同开发的可口服的 JAK1 和 JAK2 抑制剂。此前,巴瑞替尼2mg剂型已于2017年2月在欧洲批准上市,2018年6月在美国批准上市,但适应证为对一种或多种TNF 抑制剂疗效不佳的类风湿关节炎患者。2019 年7月1日,国家药品监督管理局 (NMPA) 正式批准了艾乐明®(巴瑞替尼片)2 mg片剂用于治疗成人中重度活动性类风湿关节炎。
ACTT-2临床实验
支持本次紧急授权使用的为临床试验(ACTT-2)数据。ACTT-2试验由美国国立卫生研究院(NIH)下属国家过敏和传染病研究所(NIAID)发起的。所有患者都接受了试验医院的标准支持治疗。本次EUA的推荐剂量为每日一次服用巴瑞替尼4mg14天或达到出院标准。研究数据表明,接受巴瑞替尼联合瑞德西韦治疗的患者比瑞德西韦单药的患者中位恢复时间由8天缩短至7天。巴瑞替尼联合瑞德西韦患者的第15天的临床改善比较瑞德西韦单药更佳。在第29天,23%的巴瑞替尼联合瑞德西韦患者病情发展为需要辅助供氧(无创或有创)或死亡,低于瑞德西韦单药(28%)组患者。在第29天,巴瑞替尼联合瑞德西韦的患者死亡率为4.7%,瑞德西韦单药组为7.1%,相对降低35%(KM预测29天死亡率差异比:-2.6% ;95% CI-5.8%, 0.5%)。已报告的巴瑞替尼联合瑞德西韦的不良事件和严重不良事件比例分别为41%和15%,低于瑞德西韦单药48%和20%。巴瑞替尼联合瑞德西韦的感染与静脉血栓栓塞(VTE)的发生率为6%和4%,瑞德西韦单药组数据为10%和3%。没有在接受巴瑞替尼治疗的患者中发现新的安全性信号。
巴瑞替尼合成路线一览
US20070135461
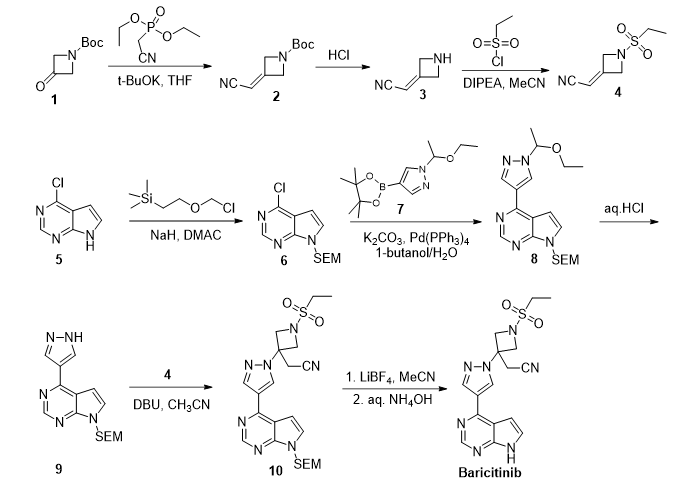
该路线为Incyte公司首次报道的巴瑞克替尼的合成方法(W02009114512),并对巴瑞克替尼的结构进行专利保护。该路线制备关键中间体2-[1-(乙基磺酰基)-3-氮杂环丁亚基]乙腈的步骤较长,使用的氰甲基磷酸二乙酯价格较高,导致该片段成本过高。后续反应使用2-(三甲基硅)乙氧基甲基保护时需要使用氢化钠,工艺放大操作危险性大。而且脱去2-(三甲基娃)乙氧基甲基保护基需要两步反应,效率较低,工艺成本较高。
CN 105541891 B
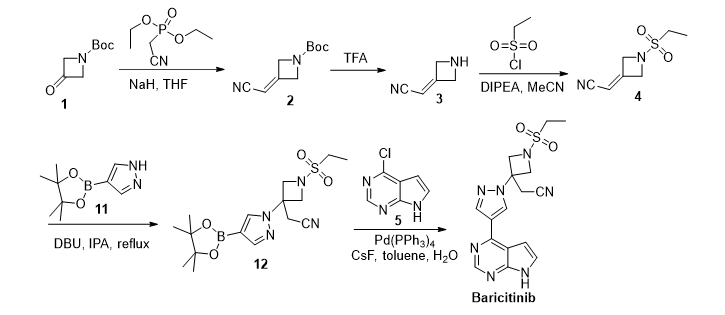
该路线同样以3-羰基-氮杂环丁烷1为起始原料,在碱性条件下经Wittig-Horner反应得到烯烃中间体2,而后经脱Boc,磺酰胺化得到中间体4。而后,经亲核加成得到硼酸酯中间体12,最终通过Suzuki偶联反应得到目标产物。该路线在最后一步使用金属催化剂Pd,可能引起API中金属含量超标,这将导致 API的后处理增加很大的难度。
CN 106496195 B
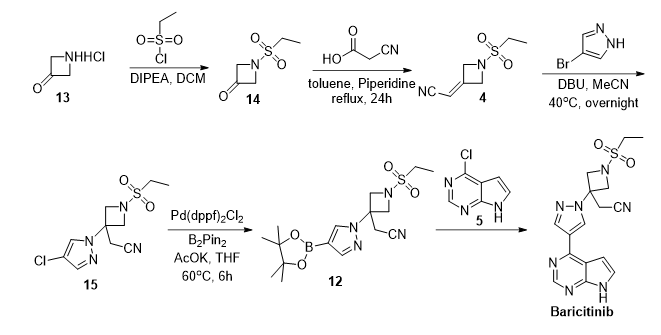
该路线以廉价易得的氰基乙酸反应得到中间体4,降低了路线成本,规避了NaH的使用,但是需要在甲苯中回流24小时,耗时过长。而后通过亲核加成得到中间体15,钯催化剂催化得到硼酸酯中间体12。最后经suzuki偶联反应得到目标产物。
CN 106946917 B
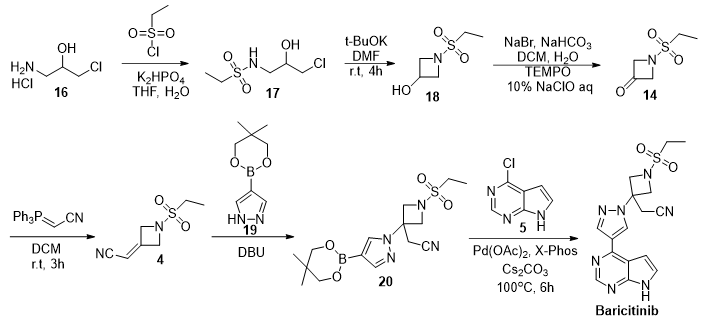
该路线对中间体4的合成方法进行了重新设计。以1-胺基-3-氯丙基-2-醇盐酸盐16作为起始化合物,经酰胺化、分子内亲核取代得到醇中间体18。而后,经TEMPO,NaBr, 次氯酸钠体系氧化得到酮中间体14。然后通过与三苯基膦乙腈的Wittig反应得到关键中间体4。该路线规避了强碱的使用。此外,新戊二醇硼酸酯衍生物化合物19具备良好的稳定性和结晶性,较容易分离纯化。
WO 2019/114258 Al
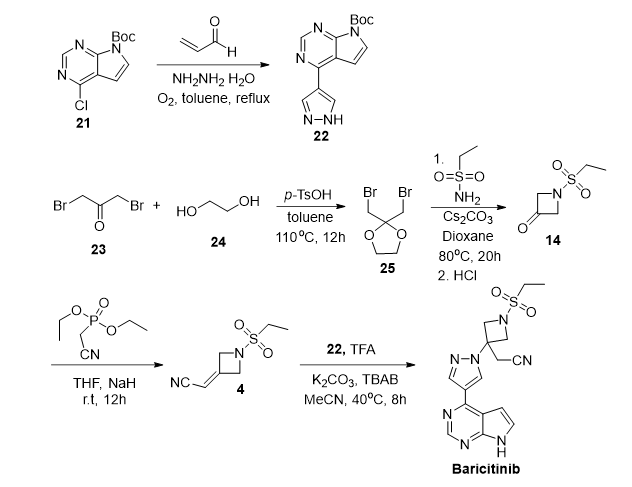
该路线首先通过水合肼与丙稀醛在氧气氛围下回流反应扣环,得到中间体22。而后二溴丙酮与乙二醇进行缩醛反应得到缩醛中间体25,而后在碱性条件下亲核取代,紧接着酸性条件下脱缩醛得到中间体14。最后通过Wittig-Horner反应,亲核加成反应得到目标产物。该路线的优点在于完全规避了贵重金属钯催化剂的使用。
参考文献
1. US20070135461
2. CN 105541891 B
3. CN 106496195 B
4. CN 106946917 B
5. WO 2019/114258 Al



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57