12月21日,杨森公司和传奇生物同时宣布,开始向美国FDA滚动提交西达基奥仑赛(cilta-cel)的生物制剂许可证申请(BLA)。这是一种在研的用于治疗成年人复发和或难治性多发性骨髓瘤的靶向B细胞成熟抗原(BCMA)定向嵌合抗原受体T细胞(CAR-T)疗法。
该申请提交是基于关键性的1b/2期CARTITUDE-1研究的结果,该研究评估了cilta-cel在治疗复发和或难治性多发性骨髓瘤患者中的疗效和安全性。该研究的最新资料最近在第62届美国血液学学会(ASH)年会上发表。
据悉,2017年12月,杨森生物技术有限公司与传奇生物达成全球独家许可和合作协议,共同开发和商业化cilta-cel。该产品于2018年获得国家药品监督管理局首个CAR-T药物临床试验(IND)批件,并于同年获得美国FDA的IND许可。2020年8月,成为国内首个“突破性治疗药物”,而在此之前,该产品已于2019年获得欧洲药品管理局优先药物(PRIME)资格及美国FDA授予的突破性疗法认定。
中国CAR-T上市第一股——传奇生物
传奇生物进入CAR-T领域时期较早,Cilta-cel里用到的抗体的开发技术均来自传奇生物,中国科学家拥有全部的知识产权。在2017年召开的ASCO大会上,传奇生物报告了该产品临床试验的结果,接受治疗的患者几乎100%有效,即有的患者彻底恢复,有些患者部分恢复,有些患者缓解。传奇生物因此成为生物界的一匹黑马。今年6月,传奇生物在美国纳斯达克市场上市,并被誉为中国CAR-T上市第一股。
近日,传奇生物第二款CAR-T疗法LB1901临床试验(IND)申请获美国FDA批准,用于治疗成人复发或难治性T细胞淋巴瘤(TCL)。LB1901是一种靶向CD4的试验性CAR-T产品,CD4是一种在大部分TCL亚型中均匀表达的膜表面糖蛋白。
我国CAR-T治疗技术与世界“并跑”
目前为止,全球范围内已获批上市的CAR-T 产品有三款,分别是诺华(Novartis )的 Kymriah(主要用于B细胞急性淋巴性白血病的治疗),以及吉利德(Kite)的 Yescarta (主要用于B细胞非霍奇金淋巴瘤治疗),和 Tecartus,这三者均以 CD19 为靶点。
目前,虽然中国尚未有CAR-T细胞治疗产品获批上市,但随着政策的完善,国内细胞治疗发展势头强劲,今年更是迎来了重大突破,2月复星凯特提交的CD19 CAR-T细胞治疗产品益基利仑赛注射液申请中国上市,6月药明巨诺CD19 CAR-T细胞治疗产品瑞基仑赛注射液申报上市。
目前为止,中国CAR-T已正式开展临床试验百余项,涉及上百个CAR-T治疗产品,研究靶点除了明星靶点CD19,还包括CD22、BCMA,CD20等多个靶点,肿瘤类型以血液肿瘤为主,有急性淋巴细胞白血病(ALL)、非霍奇金淋巴瘤(NHL)、多发性骨髓瘤(MM)等。
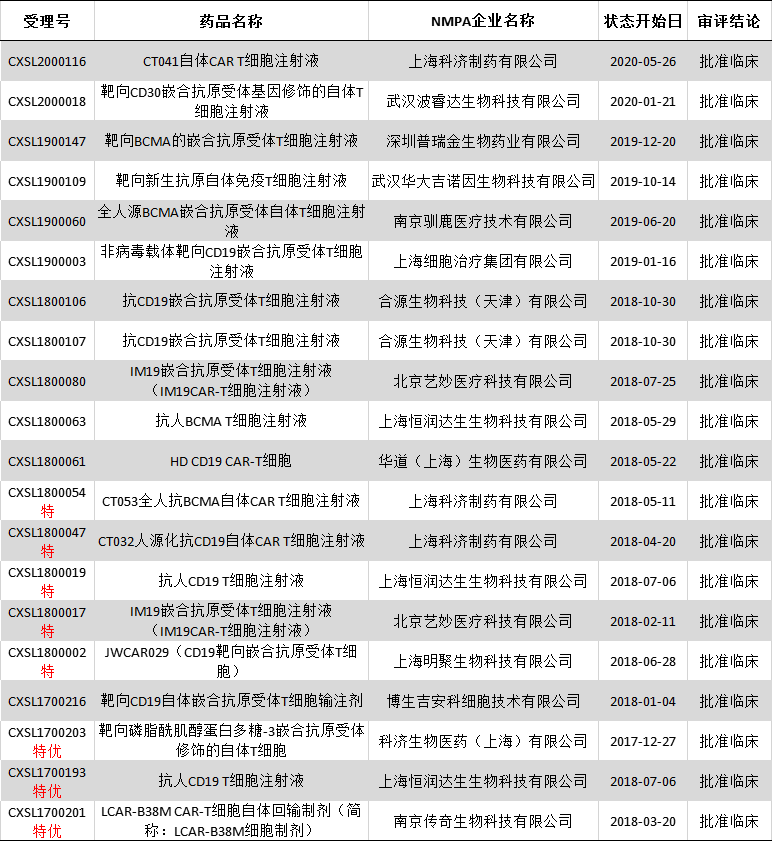
中国部分CAR-T疗法临床试验(数据来源:药智注册与受理数据库)
其中传奇生物、明聚生物和科技生物CAR-T疗法先后获得突破性疗法认定。
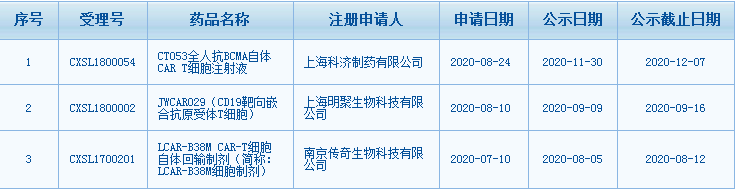
数据来源:CDE官网
结语
CAR-T疗法在血液肿瘤领域已取得很好的疗效,在实体瘤方面还有待突破。经过多年发展,全球至少有200家公司在做CAR-T,临床上的项目有数百个,这一领域已是一片红海。不同于其他创新领域,国内CAR-T治疗技术完全可以媲美欧美发达国家水平,而没有产品上市不完全是技术原因,也与国家政策有关。
如果传奇生物CAR-T疗法能获得美国FDA批准上市,国内也很可能迎来该疗法。此外,药物的开发过程是漫长的,传奇生物的CAR-T技术开发较早,进入临床试验日期也较早,而生物技术发展却是迅速的,可能还有更多更优秀的产品也将迅速加入竞争,造福更多患者。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57