今天是2020年的最后一天,但注定是不平凡的一天。等了许久,终于,国药集团中国生物新冠灭活**获得国家药监局批准附条件上市!
♦2020年12月24日,国药中生北京生物制品研究所的新冠病毒灭活**(Vero)上市申请获得NMPA受理。
♦12月30日,国药集团新冠灭活**III期临床试验期中分析数据出炉,**针对由新冠病毒感染引起的疾病的保护效力为79.34%。
♦12月31日上午,国务院联防联控机制举行的新闻发布会上发布,国药集团中国生物新冠灭活**已获得国家药监局批准附条件上市。
随着国药集团的灭活**上市,我国首 款自主研发的新冠**正式登陆国内市场。
(一) 国药集团概述
国药集团是由国务院国资委直接管理的唯一一家以医药健康产业为主业的中央医药企业,是国家创新型企业。旗下有1500余家子公司和国药控股(01099.HK)、国药股份(600511.SH)、国药一致(000028.SZ200028.SZ)、天坛生物(600161.SH)、现代制药(600420.SH)、中国中药(00570.HK)6家上市公司,员工总人数15万人。本次负责新冠**研发的武汉生物制品研究所和北京生物制品研究所属于中国生物技术股份有限公司的下设研究所,中国生物技术股份有限公司为国药集团下属的成员企业。
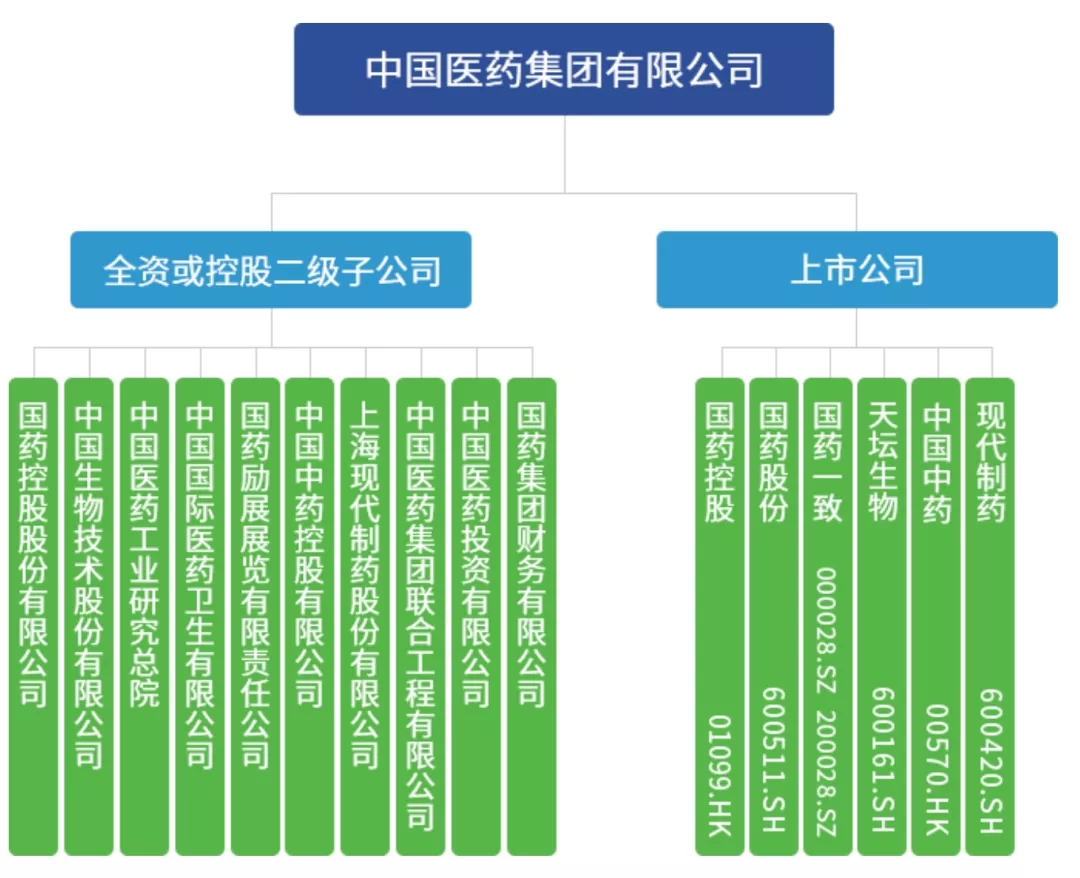
图一、国药集团组织架构
来源:国药集团官网
(二) 国药集团灭活**
国药集团两款在研的新冠**均为灭活**。灭活**是最传统的**经典技术路线,通过在体外培养新冠病毒,然后将其灭活,消除其**,再将灭活病毒回输入体内,灭活病毒进入体内后,由于具有抗原性,可刺激免疫系统产生抗体。灭活**必须在P3实验室中生产,如果需要大规模生产,实验室的生物安全保障和检测技术必须要达到世界一流的水平。我国在P3实验室的布局较早,技术较为成熟,灭活**整体走在全球前列。
灭活**的优点在于制备方法成熟,安全性较高,经过灭活的病毒不再具有感染和复制的能力。但是由于灭活**的免疫原性和免疫保护性较减活**有所降低,因此,灭活**存在接种剂量大、免疫周期短等不足。
4月份两款**相继获得临床批件。4月12日,武汉生物制品研究所研发的新冠灭活**获得临床试验批件,并同步开展国内I/Ⅱ期临床试验。4月27日,北京生物制品研究所研发的新冠灭活**再次获得临床试验批件,为新冠**的研发加上双保险。
I、Ⅱ期临床试验数据优异。8月13日,国际医学期刊《美国医学会杂志》刊登了国药集团武汉所新冠灭活**I/Ⅱ期临床试验结果,在I期临床试验中,低、中、高剂量组和铝佐剂对照组共96名志愿者于0/28/56天接受三次接种。Ⅱ期临床试验中,224名志愿者于0/14和0/21天接受两次中剂量接种。结果显示,I期临床中接种三次**后14天,低、中、高剂量的**在志愿者中诱导产生的血清中和抗体几何平均滴数分别为316、206和297,大多数试验参与者在I期试验中第二次注射后开始产生抗体反应,在第三次注射后的14天抗体保持高水平;Ⅱ期临床中0/14和0/21接种两次中剂量**后14天,**在志愿者中诱导产生的血清中和抗体平均滴度分别为121和247。I/Ⅱ期临床试验结果表明国药集团新冠**可有效诱导产生中和抗体。
9月份在国外已启动紧急使用。9月14日、11月3日,阿联酋和巴林分别宣布国药集团新冠**用于本国紧急使用,阿联酋紧急接种人员包括副总统兼总理阿勒·马克图姆。
12月9日在阿联酋获批上市,有效率达86%,没有发现严重安全隐患。12月9日,阿联酋卫生和预防部宣布对国药集团中国生物北京制品研究所研发的新冠病毒灭活**在该国进行注册。阿联酋卫生和预防部通过对国药中国生物提交的3期临床试验数据进行复核,对持有125个不同国籍的约3.1万名志愿者进行的临床试验显示,国药中生**对新冠病毒感染的有效性达86%,中和抗体转阳率达99%,能100%预防中度和中度的新冠肺炎病例。并且相关研究没有发现**存在严重的安全隐患。
到目前为止,我国5条技术路线14个**已经进入临床试验,其中3条技术路线5个**进入III期临床试验。
(三) 其他处于临床三期的新冠**
除了国药集团的两款灭活**外,科兴生物的灭活**、康泰生物(民海生物)的灭活**、中国医学科学院的灭活**、智飞生物的重组蛋白**、康希诺的腺病毒载体**均处于临床三期。(五款)
科兴生物的灭活**通用名为新型冠状病毒灭活**(Vero细胞),商品名克尔来福。在Ⅰ、Ⅱ期临床中,公司共纳入5000人参与试验,在6月的盲态审查暨揭盲会中,Ⅰ/Ⅱ期安全性数据显示,**不良反应以1级为主,主要表现为接种部位轻度疼痛,个别受试者出现乏力及低热等,无严重不良反应报告。Ⅱ期临床研究结果显示,全程免疫14天后中和抗体阳转率超过90%,**免疫原性较高。三期临床试验目前正在巴西、印度尼西亚等国开展,11月28日,在2020首届中国卫生健康科技创新发展大会上,科兴控股生物技术有限公司董事长尹卫东表示,预计12月中完成中期分析。
康希诺和军科院的腺病毒载体**是采用基因工程方法构建,以复制缺陷型腺病毒为载体,可表达新型冠状病毒S蛋白,用于预防新型冠状病毒感染引起的疾病。7月21日,新冠**Ⅱ期实验结果于《柳叶刀》发表,在实验中,508名合格受试者被随机分配入5*1010病毒颗粒低剂量组(250人)、1*1011病毒颗粒中剂量组(125人)和安慰剂组(125人),结果表明低剂量组的ELISA抗体峰值为571,中剂量组的ELISA抗体峰值为656.6,两个剂量组的血清抗体阳转率分别为96%和97%。同时腺病毒载体**载体可以有效激发细胞免疫,低剂量组和中剂量组的IFNγ-ELISpot的反应率分别为90%和88%,细胞免疫可有效清除感染细胞。
智飞生物的重组蛋白亚单位**是将重组工程细胞表达的新冠病毒S蛋白受体结合区抗原制备成**,把它接种到人体,刺激人体产生抗体。智飞生物重组蛋白**在Ⅰ、Ⅱ期临床试验均表现出良好的安全性,没有发现明显不良反应案例。在免疫原性方面,一期临床试验阳转率100%、二期临床试验阳转率96.6%,一期临床试验中和抗体GMT值94.5,二期临床试验中和抗体GMT值超过100。
康泰生物的灭活**12月初在马来西亚进入临床Ⅲ期。12月,马来西亚上市公司YONGTAIBERHAD发布公告称,该公司与深圳康泰生物制品股份有限公司、KLINSELSDNBHD达成合作,推进康泰生物新冠灭活**在马来西亚开展III期临床试验。在III期临床试验成功结束或在马来西亚获得紧急使用权后,该公司将拥有独家商业化权利,双方计划合作约1亿剂,为期5年的**采购计划。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57