4月12日,C4X Discovery Holdings plc宣布与赛诺菲就其临床前口服IL-17A抑制剂签署全球独家授权许可协议。据协议,C4XD将获得700万欧元的预付款,以及高达4.07亿欧元的潜在开发、监管和商业化里程碑付款。这一交易意味着赛诺菲将入局IL-17A抑制剂市场。
IL-17A属于白介素-17(IL-17)家族的一种,在促进银屑病、银屑病关节炎和强直性脊柱炎(AS)等疾病的自身免疫反应中的炎症状态起重要作用。IL-17 最早于1993年首次被科研人员发现,随后研究发现其在宿主防御、自身免疫性疾病发病以及肿瘤中发挥重要的作用,并逐渐成为成为医学及免疫学研究热点。
IL-17家族配体有六个亚型:IL-17A、IL-17B、IL-17C、 IL-17 D、IL-17E (也叫做IL-25)和IL-17F。其中IL-17A和IL-17F具有很高的同源性(55 %),且经常共表达。IL-17受体包括IL-17RA、IL-17RB、IL-17RC、IL-17RD、IL-17RE。IL-17配体通过其对应的受体产生器官特异性的促炎或抗炎反应。
目前,全球已经批准4款靶向IL-17/IL-17R的大分子生物药,即诺华的Cosentyx(Secukinumab,司库奇尤单抗)、礼来的Taltz(Ixekizumab,依奇珠单抗)、协和发酵麒麟的Siliq/Lumicef(Brodalumab,布罗利尤单抗)和Biocad公司的Efleira(Netakimab)。此外优时比也已经递交了靶点IL-17A/IL-17F单抗bimekizumab的生物制品许可申请。
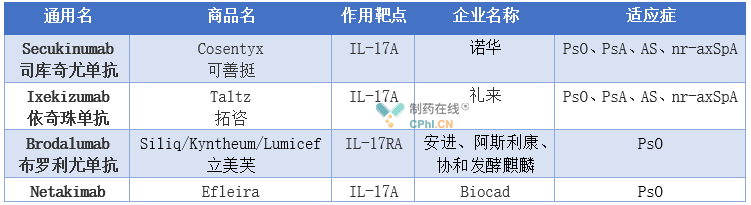
Cosentyx是全球批准的首 个IL-17A单抗,最早于2014年12月在日本获批,随后于2015年1月先后在欧美获批,截止目前已被批准用于治疗成人和6至18岁中重度斑块型银屑病(PsO)、银屑病关节炎(PsA)、强直性脊柱炎(AS)和放射学阴性中轴型脊柱关节炎(nr-axSpA)。
Taltz是继Cosentyx之后FDA批准的第2款IL-17A单抗药物,最早于2016年3月在美国获批,目前已被批准用于治疗成人和6至18岁中重度PsO、PsA、AS和nr-axSpA。
Siliq(布罗利尤单抗,也叫柏达鲁单抗)是FDA批准的第三款针对IL-17通路的单抗药物,作用靶点是IL-17RA,2016年7月在日本获批,商品名为Lumicef,2017年2月在美国获批,商品名为Siliq,2017年7月在欧洲获批,商品名为Kyntheum,适应症为PsO。该药最早由安进开发,随后阿斯利康和协和发酵麒麟株式会社获得其研发授权,其中协和发酵拥有该药在日本及其他一些亚洲国家的独家权利。2016年7月阿斯利康将该药在欧洲市场的开发和商业化权利独家授权给LE0 Pharma,2015年9月阿斯利康将该药在上述国家和地区以外其他市场的开发及商业化权利授权给Valeant。值得注意的是,该药具有自杀倾向。
Netakimab(BCD-085)于2019年5月在俄罗斯被批准用于治疗中至重度斑块银屑病,商品名为Efleira 。2019年9月,上海医药全资子公司SPH PROJECT BIOCAD Limited(以下简称SPH PB)与Biocad公司签署协议,成立合资公司,将包括该药的6个产品引入国内。
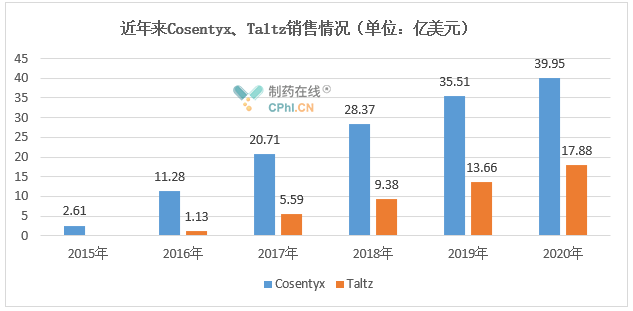
这4款药物均通过皮下注射给药,Cosentyx和Taltz上市较早,获批适应症最多,市场表现也比较亮眼,自上市后销售额均逐年攀升,其中Cosentyx已于2019年起连续两年成为诺华销售额最高的一款药物。
鉴于IL-17通路靶向药物的市场潜力,目前国内已有多家企业开始布局,其中恒瑞医药的Vunakizumab和 智翔(上海)医药的进展较快,处于三期临床。
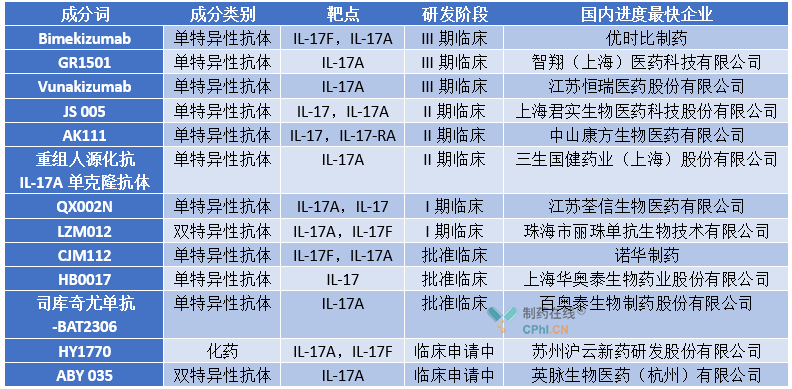
此外,2020年5月15日,创响生物于去年5月以2.25亿美元的价格从Affibody公司引进靶向IL-17的类抗体ABY-035。不过值得一提的是,已上市和在研靶向IL-17通路的药物主要是单特异性抗体抗体,主要通过皮下注射给药。而赛诺菲与C4X Discovery Holdings的合作是针对IL-17的口服小分子药物,在给药方式上较单抗类有优势。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57