胰 腺癌是一种恶性程度高、难诊断和难治疗的消化道恶性肿瘤,其发病率和死亡率近年来在全球持续上升。目前,胰 腺癌的5年生存率<1%,是预后最差的恶性肿瘤之一。由于胰 腺癌早期症状是非特异性,其早期确诊率不高,确诊时往往已经进入晚期。目前胰 腺癌的标准疗法是:FOLFIRINOX(叶酸、5-氟尿嘧啶(5-FU)、伊诺替康和奥沙利铂)和吉西他滨与Nab-紫杉醇联用,但这些疗法对患者来说收效甚微,且会出现耐药性和系统**。因此,亟待开发新型胰 腺癌治疗药物。
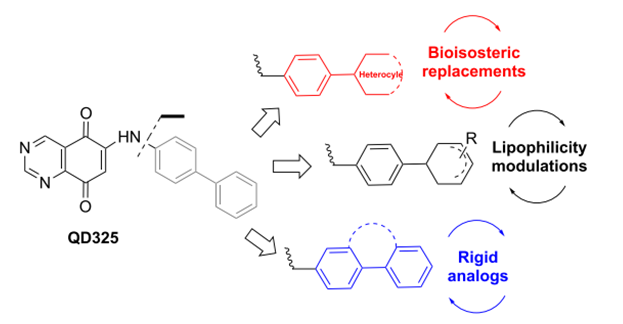
图一 QD325衍生化
在新的研究中,研究人员通过对先前开发的先导化合物QD325进行衍生化找到了靶向GPX4介导肿瘤细胞死亡的新型药物分子QD394和QD394-Me。
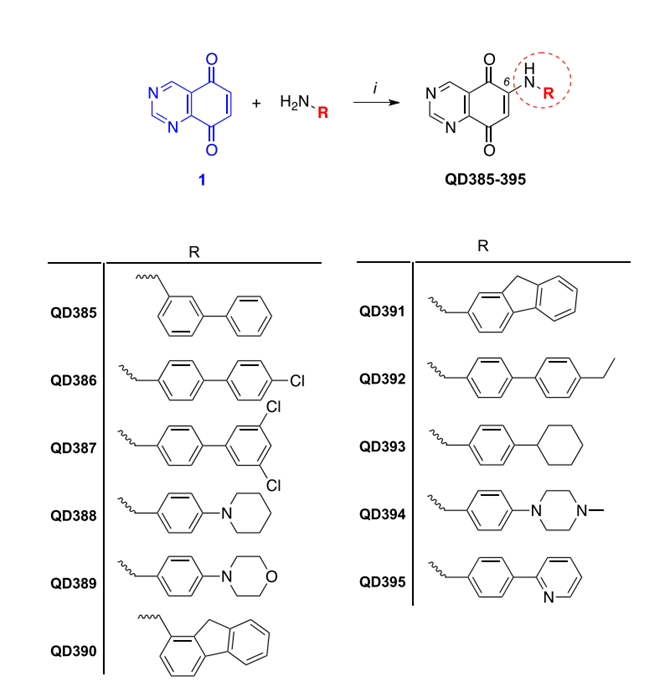
图二 衍生物QD385到QD395的合成
如图二所示,研究人员首先通过 CeCl3催化的偶联反应合成了QD325衍生物QD385到QD395。并通过细胞活性筛选发现QD394活性较好,其对MIA PaCa-2(IC50 = 0.64 ± 0.04 uM)、PANC-1(IC50 = 0.34 ± 0.03 uM)、 BxPC-3(IC50 = 0.9 ± 0.2 uM)三种胰 腺癌细胞均表现出了较好的抑制活性。
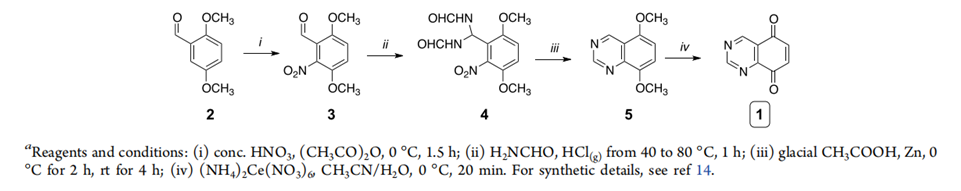
图三 原料1的制备
图二中用于衍生的原料1的制备路线如图三所示,该路线以二甲氧基苯甲醛(2)为原料,经过硝基化得到3,6-二甲氧基-2-硝基苯甲醛(3),然后与氨基甲醛缩合得到中间体4,然后中间体4与锌粉和醋酸作用得到中间体5,中间体5发生氧化脱甲基反应即可得到中间体1。
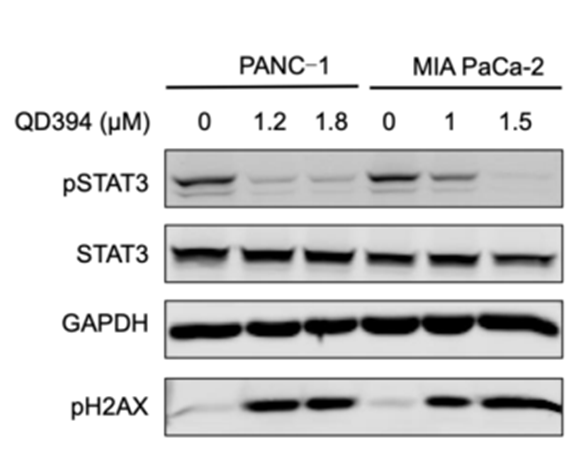
图四 WB试验
接下来,研究人员对QD394的作用机制进行了系统探索。图四显示,QD394可有效抑制STAT3磷酸化。
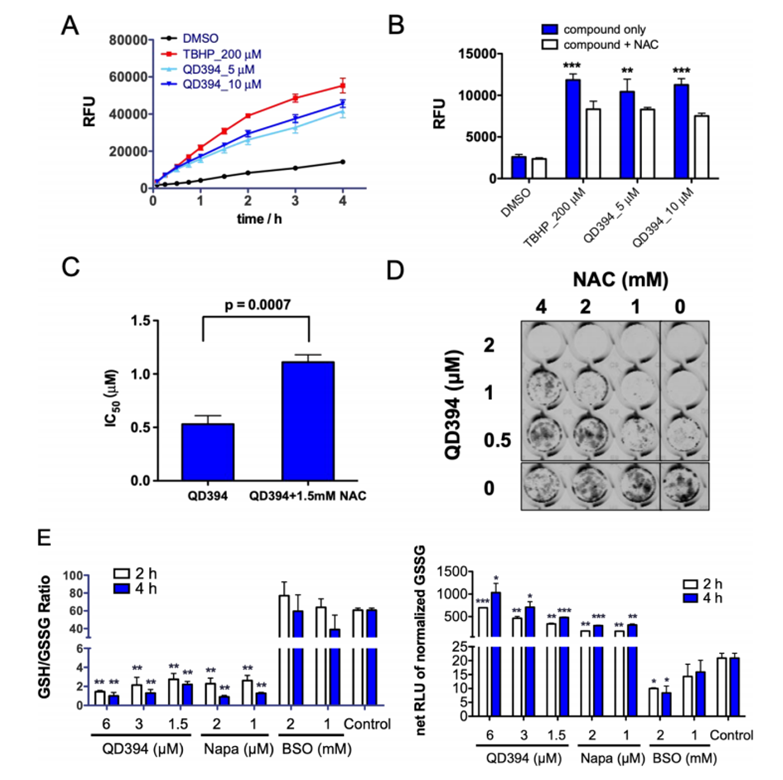
图五 QD394功能实验
进一步的研究发现,QD394可有效提高细胞的ROS水平,并降低细胞中的GSH/GSSG比率(图五)。显示QD394可通过作用与GSH氧化途径,提高细胞的ROS水平,并提示QD394可能通过诱导细胞铁死亡来产生抗肿瘤作用。

图六 QD394联用药物及其作用机制
接着,研究人员通过药物联用来证明QD394可能的作用机制是铁死亡。研究显示,去铁敏(deferoxamine,DFO)和deferasirox两种铁螯合剂可有效阻止QD394诱导的细胞死亡,这说明QD394的细胞毒与铁有关。两种铁死亡抑制剂表现出了不同的作用,其中Liproxstatin-1可抑制QD394诱导的细胞死亡,而ferrostatin-1未表现出该作用。 Z-VAD(一种半胱氨酸蛋白酶依赖性细胞凋亡抑制剂)和necrostatin-1(坏死性凋亡抑制剂)不能抑制QD394诱导的细胞死亡,氯喹(自噬抑制剂)可轻微抑制QD394诱导的细胞死亡。这些研究结果表明,QD394极有可能通过铁死亡途径诱导肿瘤细胞凋亡。
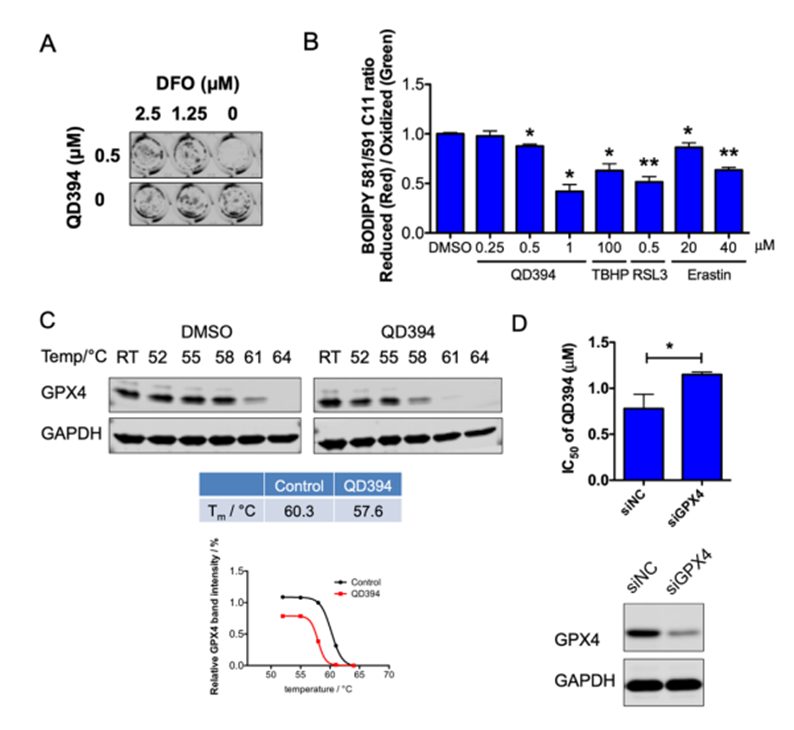
图七 脂质过氧化即GPX4相关实验
脂质过氧化和GPX4与铁死亡密切相关,研究显示QD394可显著促进脂质过氧化,而GPX4敲除后QD394的细胞**明显降低,说明QD394产生细胞毒与GPX4密切相关。
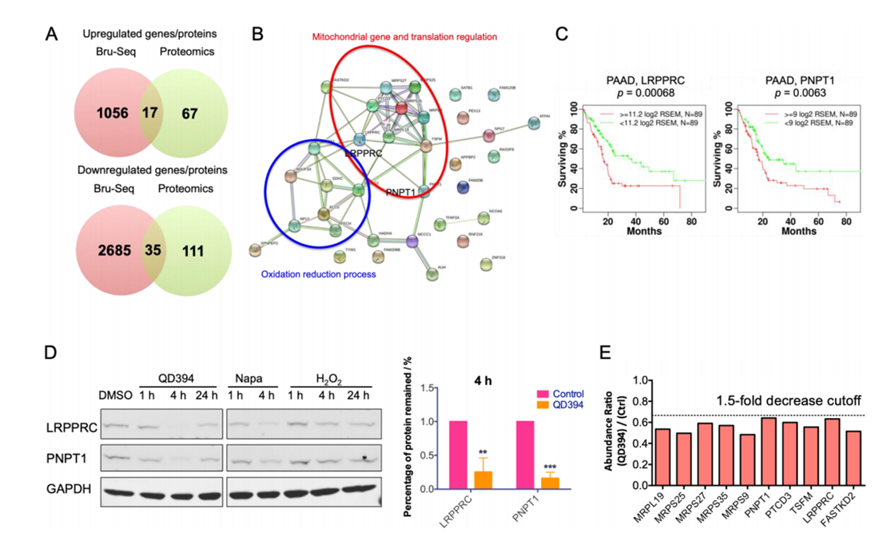
图八 蛋白质组学研究
进一步的蛋白质组学研究显示,QD394可有效降低线粒体中蛋白的表达(主要下调线粒体蛋白LRPPRC和PNPT1)。
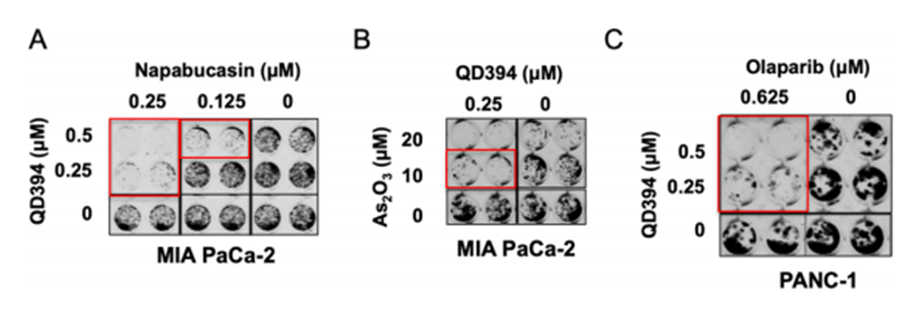
图九 与FDA批准药物联用
QD394与现有FDA批准的药物(包括Napabucasin、 As2O3和olaparib)联用发现,QD394与这些药物表现了一定的协同抗癌能力。

图十 药动学数据
上述研究显示了QD394显著的胰 腺癌药物开发潜力,但后续药动学研究显示QD394在血浆稳定性方面欠佳,半衰期仅为6分钟。因此,研究人员进一步开发了药动学数据更好的QD394-Me(结构式见图十一),其血浆半衰期可以达到120分钟以上(图十)。
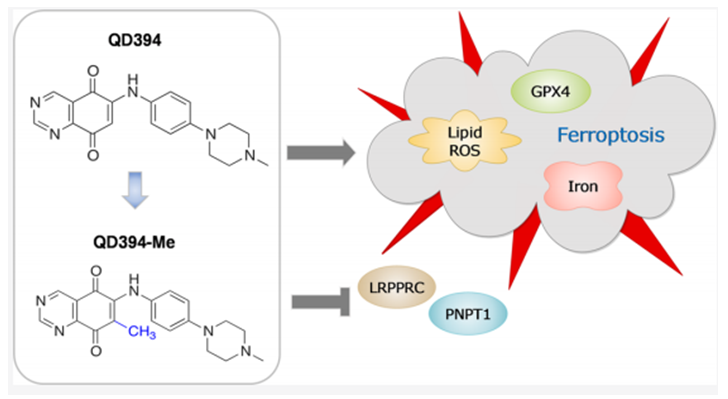
图十一 QD394-Me的开发和作用机制
QD394-Me药效及功能评价显示,QD394-Me作用机制与QD394相似,同时具有较好的药效。
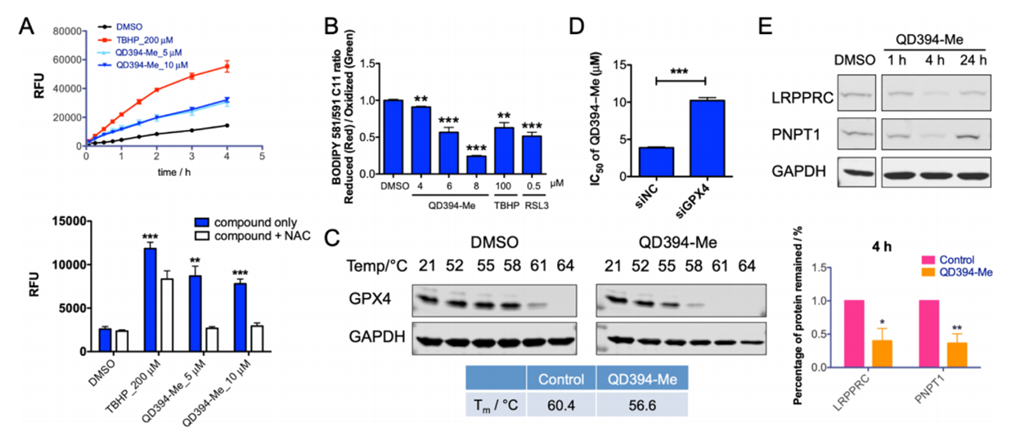
图十二 QD394-Me药效及功能评价
从QD394到QD394-Me的胰 腺癌开发,不但提供了QD394和QD394-Me两个药物分子,进一步的胰 腺癌药物开发提供了可能;同时,该类药物分子与现有上市药物分子联用可显示出协同作用,具有组合药物开发潜力。期待该类药物分子早日上市,造福广大胰 腺癌患者。
参考文献:
1.A Novel Redox Modulator Induces a GPX4-Mediated Cell Death That Is Dependent on Iron and Reactive Oxygen Species,2020.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57