关键词:西达基奥仑赛;BCMA;CAR-T疗法
5月27日,金斯瑞发布公告,其非全资附属公司传奇生物BCMA靶向CAR-T疗法西达基奥仑赛(cilta-cel)的生物制品许可申请(BLA)获FDA优先审评资格,用于治疗复发和/或难治性多发性骨髓瘤患者。根据处方药使用者付费法案(PDUFA),FDA将在2021年11月29日前完成对该BLA的审查。
西达基奥仑赛(cilta-cel,LCAR-B38M/JNJ-4528)是传奇生物开发的一款靶向B细胞成熟抗原(BCMA)的CAR-T疗法,2017年12月,传奇生物与杨森达成全球合作和许可协议。交易金额上,杨森向金斯瑞支付了3.5亿美元首期款及后续里程碑付款,创下当时中国药企对外专利授权首付款最大金额记录及合作最优条件。
西达基奥仑赛结构新颖,含有4-1BB共刺激结构域和两个BCMA靶向单域抗体,旨在增加其靶向癌细胞的综合能力。而且与其他CAR-T产品相比,西达基奥仑赛临床用药剂量明显更小,使用安全性高而疗效却极为优异。
此前,西达基奥仑赛于2019年4月获得了欧盟委员会的优先药物认定,2019年12月获得美国突破性疗法认定,2020年8月在国内获得突破性疗法认定。而且,美国FDA和欧盟委员会先后于2019年2月和2020年2月授予西达基奥仑赛孤儿药资格。
2020年12月,西安杨森和传奇生物宣布开始向FDA滚动递交西达基奥仑赛治疗复发/难治性多发性骨髓瘤成人患者的BLA。而BLA的递交是基于关键性Ib/II期研究CARTITUDE-1的结果,该研究评估西达基奥仑赛在复发和/或难治性多发性骨髓瘤患者中的有效性和安全性。招募的97例受试者中,99%接受末线治疗无效,其中88%既往接受过至少3线治疗。
研究结果显示:中位随访12.4个月时,独立委员审查的ORR为97%,包括67%的sCR(严格的完全缓解),26% 的VGPR(非常好的部分缓解)和4%的PR。安全性方面,研究中≥3级细胞因子综合征(CRS)发生率为5%,≥3级神经**发生率为10%。值得一提的是,该项研究最新的18个月随访资料将于6月举办的2021年美国临床肿瘤学会(ASCO)年会及欧洲血液病学会(EHA)虚拟会议上发布。
此外,传奇生物还将在2021 ASCO年会上公布一项有关于西达基奥仑赛的代号为CARTITUDE-2的临床研究队列A初步数据。CARTITUDE-2研究是一项多队列II期临床研究,旨在评估在不同临床环境下西达基奥仑赛对MM患者的安全性和有效性,以及探讨门诊给药的适宜性。主要评估指标为微小残留病灶(MRD)阴性(最低检测灵敏度为10-5),次要指标为应答率和安全性。
截至2021年2月,中位随访时间为5.8个月,共有20例患者接受西达基奥仑赛治疗,其中1例患者在门诊接受治疗。受试者此前接受治疗中位数为2线,12例接受过≤3线疗法、8例接受过3线疗法治疗,所有患者都接受过PI( 蛋白酶体抑制剂 )、IMiD(免疫调节剂)和地塞米松治疗,95%接受过烷化剂,65%接受过达雷妥尤单抗治疗。
研究结果显示:患者的ORR为95% ,其中75%达到sCR/CR,85%达到VGPR;首次缓解中位时间为1.0个月,最 佳缓解中位时间为1.9个月,中位缓解持续时间尚未达到。4例MRD可评估患者在数据截止时均达到MRD阴性水平。
安全性方面,CARTITUDE-2研究中发生率≥20%血液学相关不良反应(AEs)包括:中性粒细胞减少、血小板减少、贫血、淋巴细胞减少、白细胞减少;CRS(细胞因子释放综合征)发生率为85%,3/4级占10%;CAR-T细胞神经**发生率为20%,均为1/2级。
在欧洲,杨森于今年4月向EMA递交西达基奥仑赛治疗复发和/或难治性多发性骨髓瘤的许可上市申请(MAA),5月份EMA正式受理该MAA。在国内,西达基奥仑赛处于II期临床研究阶段,预计今年下半年提交上市申请。
传奇生物是一家全球性的临床阶段生物制药公司,致力于发现和开发用于肿瘤学和其他适应症的新型细胞疗法,2020年6月在纳克达斯上市,成为国内第一家CART疗法上市公司。据公司官网,传奇生物还有多款在研CAR-T疗法,其中用于治疗成人复发或难治性T细胞淋巴瘤(TCL)的研究性自体嵌合抗原受体T细胞(CAR-T)疗法已于2020年12月获得FDA 新药临床试验(IND)申请的批准,成为传奇生物在美国获得批准的第二个IND申请。而且,传奇生物还在推进多项研究者发起的临床计划,包括弥漫性大B细胞淋巴瘤(DLBCL)、急性髓细胞性白血病(AML)、胃癌、胰 腺癌和非霍奇金淋巴瘤(NHL)的异体治疗。
全球获批CAR-T疗法增至5款
CAR-T疗法是一种通过使用修复的免疫细胞攻击并摧毁恶性肿瘤的新型细胞疗法,是近年来肿瘤,尤其是血液瘤治疗领域最为瞩目的创新疗法之一。据统计,目前全球已经批准5款CAR-T疗法。
从企业来看,吉利德和BMS各占两席,其中吉利德拥有的Yescarta和Tecartus是通过Kite Pharma获得。从FDA首批时间看,主要集中在近两年。
从作用靶点看,除了Abecma,其他4款均作用于CD19,这也导致Abecma与其他CAR-T疗法适应症不同。然而在国内,目前还未有任何一款CAR-T疗法获批,其中复星凯特从Kite Pharma引进Yescarta® (Axicabtagene Ciloleucel,益基利仑赛)和药明巨诺的瑞基奥仑赛进展较快,目前处于上市申请阶段。
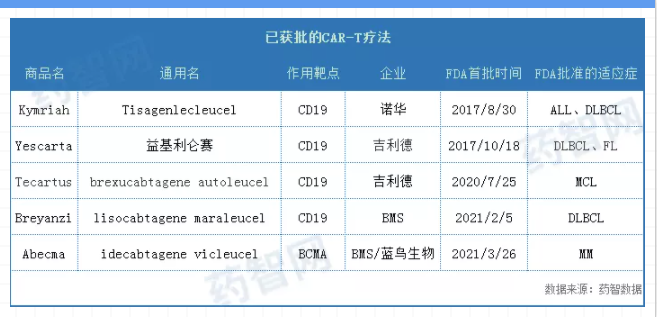
Kymriah是全球批准的首 款 CAR-T疗法,2017年8月被FDA批准用于治疗急性淋巴细胞白血病(ALL)儿童和年轻成人患者(年龄至25岁),2018 年 5 月 该药又被FDA批准用于治疗复发或难治性大B细胞淋巴瘤成人患者(先前接受过两次或以上的系统治疗),其中包括最常见的非霍奇金淋巴瘤形式——弥漫性大B细胞淋巴瘤(DLBCL)以及起因于滤泡性淋巴瘤(FL)的高级别B细胞淋巴瘤和DLBCL。2020年4月,该药被FDA授予治疗复发或难治性滤泡性淋巴瘤(R/R FL)的再生医学先进疗法(RMAT)资格,预计今年将递交该适应症上市申请。
Yescarta是全球获批的第二款CAR-T疗法,2017年10被FDA批准用于治疗经过两次或以上系统治疗的复发性或难治性大B细胞淋巴瘤成年患者,包括弥漫性大B细胞淋巴瘤(DLBCL)、原发性纵隔大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡性淋巴瘤引起的DLBCL。2021年3月,Yescarta又被FDA批准用于经过两次或以上系统治疗的复发或难治性滤泡性淋巴瘤(FL)成年患者,该批准使该药成为第一种被批准用于惰性滤泡性淋巴瘤患者的CAR T细胞疗法。
Tecartus是全球获批的第三款CAR-T疗法,2020年7月被FDA加速批准用于治疗先前接受过2种或多种系统疗法(包括一种BTK抑制剂)的复发或难治性套细胞淋巴瘤(R/R MCL)成人患者,成为第一个也是唯一一个获批治疗R/R MCL的CAR-T疗法。今年4月,吉利德又向FDA递交了该药治疗治疗复发或难治性B细胞前体急性淋巴细胞白血病(ALL)成人患者的补充生物制品许可申请(sBLA)。
Breyanzi由Juno Therapeutics开发,新基于2018年以90亿美元的价格收购Juno,将Breyanzi收入囊中,而新基在2019年被BMS以740亿美元的价格收购,该产品再次易主。该药于2021年2月被FDA批准用于治疗经过两次或两次以上系统治疗的复发或难治性大B细胞淋巴瘤成年患者,包括弥漫性大B细胞淋巴瘤(DLBCL)(包括惰性淋巴瘤引起的DLBCL)、高级别B-细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和3B级滤泡性淋巴瘤。除了复发或难治性大B细胞淋巴瘤,该药在日本还被批准用于治疗复发或难治性滤泡性淋巴瘤(R/R FL)。
Abecma是目前获批的唯一一款BCMA靶向CAR-T疗法,2021年3月被FDA批准用于治疗四种或以上前期疗法(包括免疫调节剂、蛋白酶体抑制剂和抗CD38单克隆抗体)后复发或难治性多发性骨髓瘤(MM)成年患者。
四款CD19靶向的CAR-T疗法中,除了Tecartus,其余三款均被批准用于治疗DLBCL,其中Breyanzi与另外两款CAR-T疗法有所不同,该产品加入了纯化的CD4+和CD8+细胞,安全性有明显提高,细胞因子释放综合征发生率已有明显下降。
据各公司财报,近年来全球CAR-T市场规模不断扩张,其中Yescarta销售额最高,2020年突破5亿美元。Kymriah次之,2020年销售额达4.74亿美元,而Tecartus上市首年销售额达0.44亿美元。据弗若斯特沙利文报告,2024年全球CAR-T疗法市场规模有望达到66亿美元,2030年达到218亿美元,照此来看,全球CAR-T市场还未饱和,未来势必将卷起更激烈的竞争。
在研CAR-T疗法靶点多元化
除了上述获批的5款CAR-T疗法,目前还有多款在研CAR-T疗法,如BMS/蓝鸟生物共同开发的BCMA靶向bb2127、驯鹿医疗/信达生物BCMA靶向的CT103A(IBI326)、Allogene Therapeutics公司BCMA靶向的ALLO-715、 科济生物Claudin18.2靶向的CT041和BCMA靶向的CT053、Mustang Bio公司CD20靶向的MB-106等。
从作用靶点来看,未来CAR-T疗法的靶点将越来越多元化,而BCMA是继CD19之后,又一竞争非常激烈的CAR-T疗法靶点,其中Claudin 18.2是一种四次跨膜蛋白,结构复杂,在胃癌、胰 腺癌多患者中的癌细胞中高度特异性的表达,这也使CAR-T疗法的适应症从血液肿瘤转移到实体瘤。
此外,现在已经有企业开发出了双靶向CAR-T疗法,如恒润达生的抗人CD19-CD22 T细胞注射液、亘喜生物BMCA/CD19 双靶向的GC012F等。
上述在研CAR-T疗法中,Tessa Therapeutics公司CD30定向自体嵌合抗原受体T细胞(CD30 CAR-T)疗法于2020年被FDA授予治疗R/R cHL的再生医学先进疗法(RMAT)资格,2021年被EMA授予治疗复发或难治性经典霍奇金淋巴瘤(R/R cHL)的优先药物资格(PRIME)。
Precision/施维雅的PBCAR0191是一种通用型同种异体CD19靶向CAR-T细胞疗法,来源于合格供体的T细胞、经过基因编辑去除内源性T细胞受体(TCR)的表达、并将CAR插入同一位点制备而成,2020年8月被FDA授予治疗晚期B细胞前体急性淋巴细胞白血病(B-ALL)的快速通道资格。Allogene Therapeutics公司的ALLO-715目前正被开发用于治疗R/R MM患者,2021年4月被FDA授予再生医学先进疗法(RMAT)资格。
此外,值得一提的是,CAR-T疗法的制备逐渐开始变化。
目前全球已上市的CAR-T产品都属于自体疗法,其制备需要对每个癌症病人自身的T细胞进行改造,并在扩增后重新输回该病人体内,属于量身定制的患者特异性药品。但部分病人因前期治疗导致免疫系统受损,其T细胞已无法用于制备CAR-T。同时,鉴于自体疗法的CAR-T产品生产成本非常高,国内外已有多家研究机构和制药公司在推动开发同种异体或通用CAR-T疗法,这些疗法可以从健康的供体细胞或其他现成细胞来源大量产生,经过工程改造以表达所需的CAR,然后用于多个患者。
鉴于CAR-T疗法的市场潜力,全球药企围绕CAR-T疗法的授权、合作、收购等BD交易也异常活跃,如吉利德收购Kite Pharma、新基收购Juno Therapeutics、Mustang Bio公司从Fred Hutch获得MB-106的授权、英创远达从合源生物获得CNCT19项目授权、药明康德和Juno合作建立了药明巨诺公司等。
责任编辑:三七



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57