近日,荣昌生物1类新药「注射用纬迪西妥单抗」的上市申请(相关受理号为CXSS2000044)在NMPA的状态变更为"在审批",预计不日将正式获批,成为继泰它西普之后荣昌生物获批的第二款新药。
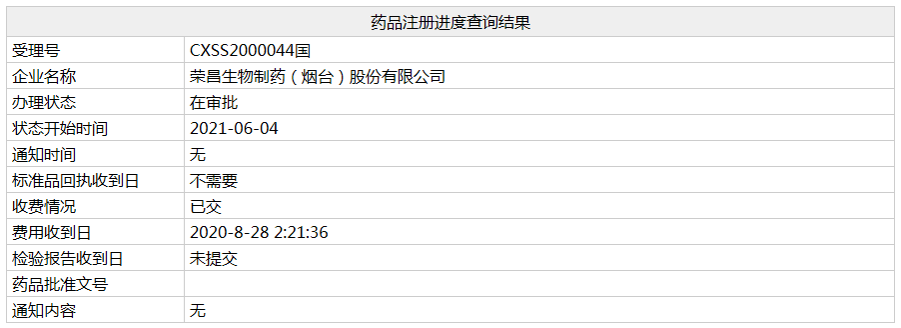
纬迪西妥单抗(研发代号:RC48,商品名:爱地希)是荣昌生物自主研发的一款抗体偶联(ADC)药物,由人源化HER2抗体和毒素载荷一甲基澳瑞他汀E(MMAE)通过可被组织蛋白酶剪切的连接子彼此偶连而成,具有优化的药物-抗体比率。2020年8月,纬迪西妥单抗治疗复发/转移后至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部癌)的上市申请获CDE受理,成为国内报产的首 款国产ADC药物。
纬迪西妥单抗治疗胃癌的上市申请是基于其在HER2阳性局部晚期或转移性胃癌患者中开展的单臂、开放、多中心关键性II临床试验数据。该研究共入组127例既往接受过2线或2线以上系统化疗的HER2过表达(包括ICH3+、IHC2+/FISH+、及IHC2+/FISH-病人)晚期胃癌(包括胃食管结合部腺癌)患者。
ASCO2020会议上公布的研究结果显示:以独立疗效评价委员会(IRC)评效的主要疗效指标客观缓解率(ORR)为24.4%,中位无进展生存期(PFS)为4.1个月,中位总生存期(OS)为7.5个月。安全性方面,RC48常见不良事件包括白细胞计数降低、脱发、中性粒细胞计数降低等,以轻中度为主,临床上基本可控。
我国是全球胃癌发病率最高的国家,发病人数约占全球患者人数的50%,然而国际上对晚期胃癌的治疗却缺乏有效的治疗方法。上述研究数据显示维迪西妥单抗对HER2阳性,包括HER2低表达(IHC 2+/FISH-)局部晚期或转移性胃癌(包括胃食管结合部腺癌)具有突出疗效,有望填补HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)三线及三线后治疗巨大且急迫的医学需求。
除了治疗胃癌,纬迪西妥单抗还被开发用于治疗HER2表达尿路上皮癌、乳腺癌、胆道癌和非小细胞肺癌等。其中维迪西妥单抗针对尿路上皮癌(UC)的适应症曾先后被FDA和CDE授予突破性疗法认定,据公司招股书预计今年上半年将递交治疗UC的上市申请。此外纬迪西妥单抗还被FDA授予针对胃癌适应症的快速通道资格。
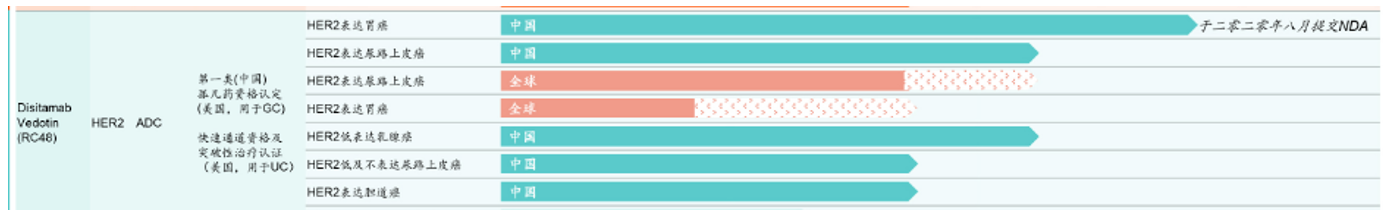
值得一提的是,在近日正在举办的2021ASCO大会上,纬迪西妥单抗(RC48)多项临床研究最新数据以壁报讨论、壁报等形式亮相。
► RC48用于HER2过表达局部进展或转移性尿路上皮癌的单臂多中心Ⅱ期临床研究。【壁报展示】
该研究在既往多线化疗失败后的HER2过表达局部进展或转移性UC患者中展开,2018年12月至2020年9月共入组64例患者,其中既往接受过二线及以上治疗的患者为85.9%
截至2021年3月,独立影像学评估的客观有效率达到50%,中位无进展生存时间为5.1个月,中位生存时间为14.2个月。最常报告的TRAEs是AST升高(46.9%)、白细胞计数减少(45.3%)、中性粒细胞计数减少(42.2%)和感觉减退(42.2%)等;最常报告的≥3级TRAEs是中性粒细胞计数减少(10.9%)、感觉减退(7.8%)和GGT升高(7.8%)。
► RC48联合特瑞普利单抗治疗局部晚期或转移性UC的Ib /II期研究。【壁报展示】
该研究是一项特瑞普利单抗联合RC48用于既往至少一线治疗失败或不能耐受/不愿意接受顺铂化疗转移性尿路上皮癌的剂量递增与扩展临床研究,主要研究终点为联合治疗的安全性。截至2021年4月28日,共有19例患者完成至少一次治疗给药,17例患者完成了至少一次疗效评估。
结果显示ORR达到94.1%(16/17),其中3例获得完全缓解,13例获得部分缓解;在19名接受过研究治疗的患者中,最常报告的TRAEs为厌食症(79.0%),疲劳(68.4%),ALT / AST升高(57.9%)和周围感觉神经病(57.9%)。
► RC48治疗HER2阳性、HER2低表达的晚期或转移性乳腺癌患者的Ⅰ期研究和1b期研究的汇总分析。【壁报讨论】
在数据截止时(2020年12月31日),118名女性乳腺癌患者被纳入研究并接受RC48-ADC治疗。70例患者(59.3%)为HER2阳性,48例患者(40.7%)为HER2低表达。基线时,77例患者(65.3%)存在肝转移,47例患者(39.8%)既往已接受了至少3线化疗。
结果显示:在HER2阳性亚组中,1.5、2.0和2.5mg/kg剂量组患者确证的ORR分别为22.2% 、42.9% 和40.0%,中位PFS分别为4.0个月 、5.7个月 和6.3个月。在HER2低表达亚组中,确证的ORR和中位PFS为39.6%和5.7个月,其中IHC 2+/FISH-患者确证的ORR和中位PFS分别为42.9%和6.6个月,IHC 1+患者确证的ORR和中位PFS分别为30.8%和5.5个月。
安全性方面:研究中最常报告的不良反应包括AST升高(64.4%)、ALT升高(59.3%)、感觉减退(58.5%)、白细胞计数降低(48.3%)、中性粒细胞计数降低(47.5%),大部分为1~2级。而最常报告(发生率≥10%)的≥3级不良反应包括中性粒细胞计数降低(16.9%)、γ-谷氨酰转移酶升高(12.7%)和乏力(11.9%)。
这些数据表明:RC48在HER2阳性和HER2低表达晚期乳腺癌中表现出一致的疗效,没有发现新的安全性风险。与其他剂量组比较,2.0mg/kg Q2W给药对乳腺癌目标人群显示出最 佳的获益风险比。
说到ADC,目前全球已经批准12款ADC药物,详见下表。可以看出从2019年开始全球ADC药物进入爆发期,连续两年批准三款。据全球知名市场调研公司Research & Markets报告,未来10年ADC市场将经历飞速发展,预计将有7-10个ADC新药上市,2024年ADC市场将达到100亿美元。
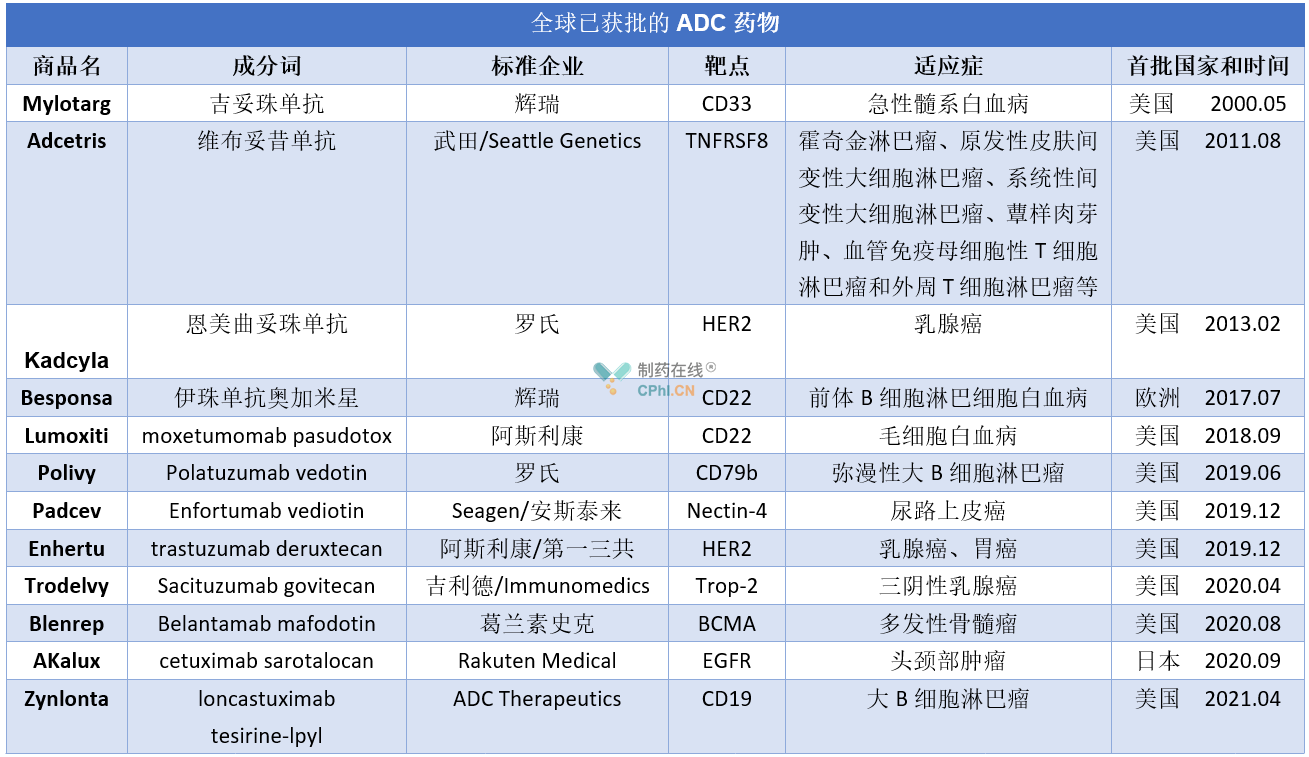
然而,我国目前仅批准两款ADC药物,即武田的维布妥昔单抗(2020/05)和罗氏的恩美曲妥珠单抗(2020/01)。从作用靶点看,维迪西妥单抗与恩美曲妥珠单抗相同,不过恩美曲妥珠单抗获批是适应症是:单药用于接受紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗。未来维布妥昔单抗一旦获批上市,没有同类竞品,市场潜力不可小觑。
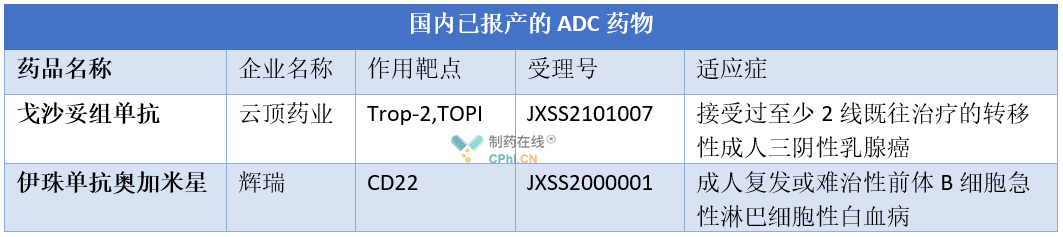
此外,除了纬迪西妥单抗,目前国内还有两款ADC药物已经报产(详见下表)。而且,我国药企也纷纷布局ADC药物市场,如恒瑞医药、齐鲁制药、科伦药业、百奥泰等,其中恒瑞医药有3款ADC药物处于临床一期,1款已经申报临床。除了自主研发,我国药业也陆续引进ADC药物或与其他企业联合开发,如领路药业从ADC Therapeutics引进CD19靶向的 ADC药物loncastuximab tesirine以及其他三款ADC候选产品、齐鲁制药从韩国生物技术公司Peptron引进一款针对MUC1的ADC候选产品PAb001-ADC,华东医药全资子公司中美华东入股诺灵生物布局 ADC 领域等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57