01/ 全球药物批准/研发动态
1.1全球新药批准情况
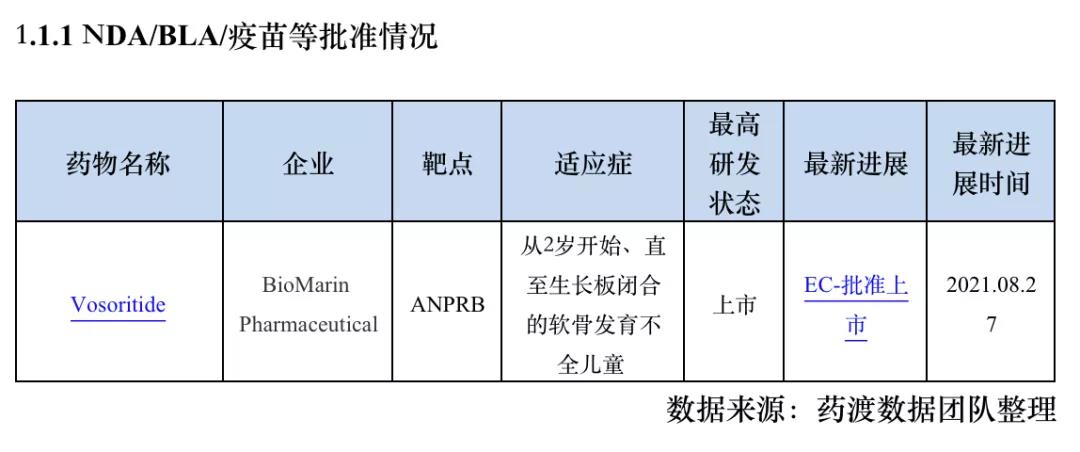
1. 欧盟首 个治疗儿童软骨发育不全的C型利钠肽类似物获批上市!
2021年8月27日,BioMarin Pharmaceutical公司宣布,欧盟委员会(EC)已经批准Vosoritide的上市申请,用于治疗从2岁开始、直至生长板闭合的软骨发育不全(achondroplasia)儿童患者,Vosoritide是每日注射一次的C型利钠肽(CNP)类似物,通过调节成纤维细胞生长因子受体3(FGFR3)信号,直接靶向软骨发育的潜在病理生理学,促进软骨内骨的形成,让患儿恢复正常生长发育。Vosoritide是欧盟批准治疗该疾病的首 款疗法。
欧盟委员会的批准结论是基于Vosoritide临床研究的全部数据,包括一项随机双盲、安慰剂对照的评估Vosoritide安全性和有效性的3期临床试验结果,该3期临床试验得到了一项正在进行的、随访周期长达5年的2期剂量探索试验的临床数据支持。研究表明,在有数据可查的5年观察期内,受试患儿的生长速率持续高于基线和预期的年生长速率,并且,在受试者中未观察到骨龄加速,说明Vosoritide未缩短总体生长持续周期。
1.1.2 新复方/新适应症/联合用药等批准情况
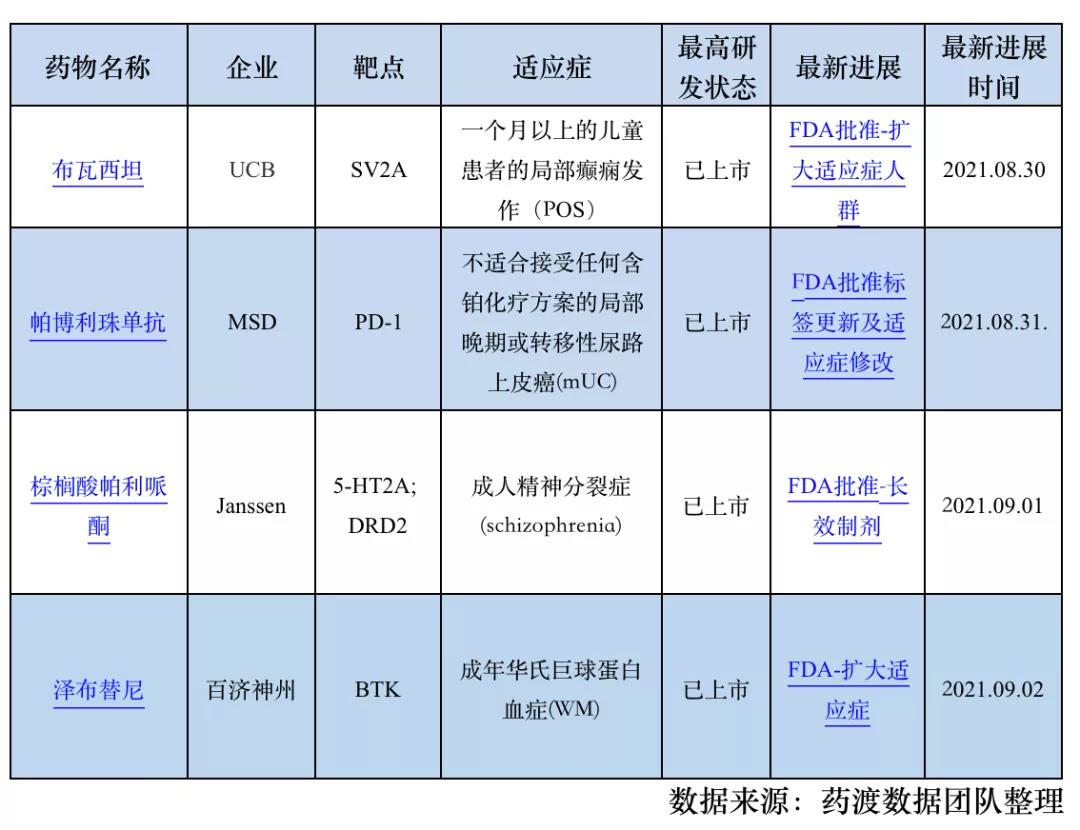
1. 超长效**分裂症治疗药物棕榈酸帕利哌酮获批,一年仅需注射两次!
2021年9月1日,强生旗下杨森制药公司宣布美国食品药品监督管理局(FDA)批准其长效非典型抗**病药物INVEGA HAFYERA?(每6个月给药一次的棕榈酸帕利培酮)上市,该产品是首 个并且是唯一一个每年仅注射两次的用于治疗成人**分裂症药物。
值得注意的是,在使用INVEGA HAFYERA?之前,患者必须接受INVEGA SUSTENNA?(每月给药一次的棕榈酸帕利培酮)至少4个月,或者INVEGA TRINZA?(每3个月给药一次的棕榈酸帕利培酮)至少1个周期。
FDA 批准 INVEGA HAFYERA ?上市是基于一项为期12个月的随机、双盲、非劣效性、全球III期研究结果,该研究招募了来自20个国家的702名成年**分裂症患者(18-70岁)。结果显示,INVEGA HAFYERA?与INVEGA TRINZA? 在主要终点(12个月治疗结束后首次复发时间)上相比具有非劣效性。接受INVEGA HAFYERA? 治疗的患者和接受 INVEGA TRINZA? 治疗的患者在第12个月无复发比例分别为92.5%和95%。试验观察到INVEGA SUSTENNA? 组和 INVEGA TRINZA?组不良反应一致,没有出现新的不良反应。INVEGA HAFYERA?组最常见的不良反应(≥5%)包括上呼吸道感染(12%)、注射部位反应(11%)、体重增加(9%)、头痛(7%)和帕金森病(5%)。
2.泽布替尼再下一城,FDA批准第二项适应症!
2021年9月2日,百济神州宣布,美国食品药品监督管理局(FDA)批准泽布替尼用于治疗华氏巨球蛋白血症患者,这是泽布替尼在FDA获得的第二项批准,也是其在全球范围华氏巨球蛋白血症中第三项获批。
此次FDA对泽布替尼在华氏巨球蛋白血症中的批准主要是基于对比泽布替尼和伊布替尼治疗华氏巨球蛋白血症患者的多中心、开放性的3期ASPEN试验(NCT03053440)的有效性结果。该研究的队列1随机入组了201例携带MYD88突变(MYD88MUT)的患者。
ASPEN试验的主要有效性终点是独立审查委员会(IRC)在总体意向性治疗(ITT)人群中评估的非常好的部分缓解(VGPR)率。根据修订版第六届华氏巨球蛋白血症国际工作组(IWWM-6)缓解标准(Treon 2015),泽布替尼组中非常好的部分缓解(VGPR)率为28%,而伊布替尼组则为19%。根据IWWM-6缓解标准(Owen et al 2013),泽布替尼组VGPR率为16%,而伊布替尼组则为7%。
在FDA批准的泽布替尼说明书中,主要有效性结果体现为IRC评估的部分缓解(PR)或更佳缓解率。而基于任一版本的IWWM-6缓解标准,泽布替尼组的部分缓解(PR)或更佳缓解率达到了78%(95% CI: 68, 85),伊布替尼组的数据为78%(95% CI: 68, 86);在12个月时,泽布替尼组有94%的患者仍在进行无事件持续缓解(95% CI: 86, 98),伊布替尼组为88%(95% CI: 77, 94)。
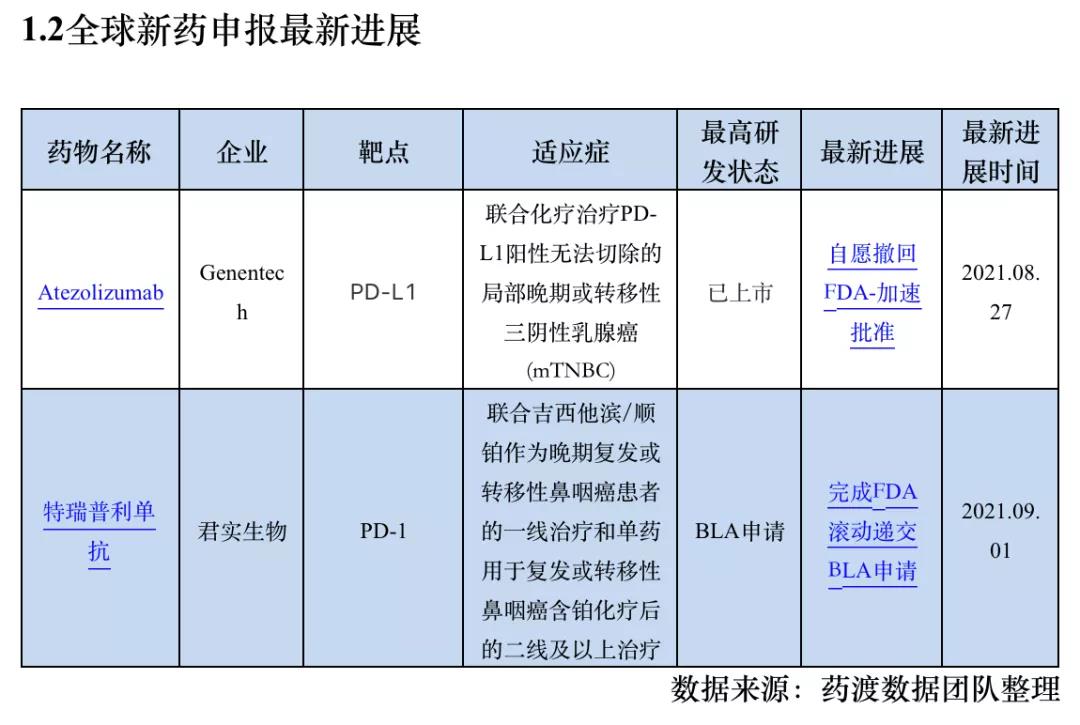
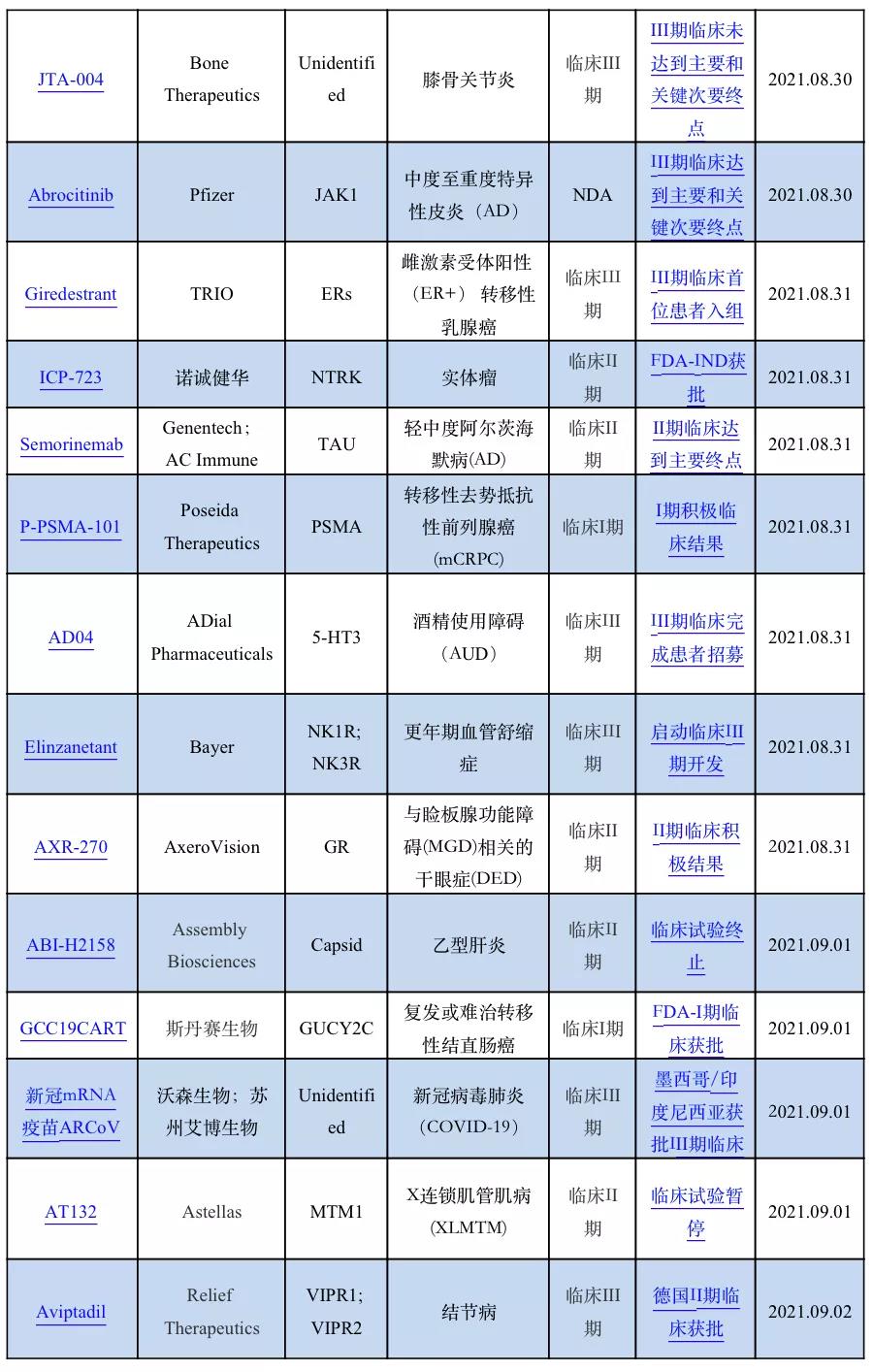
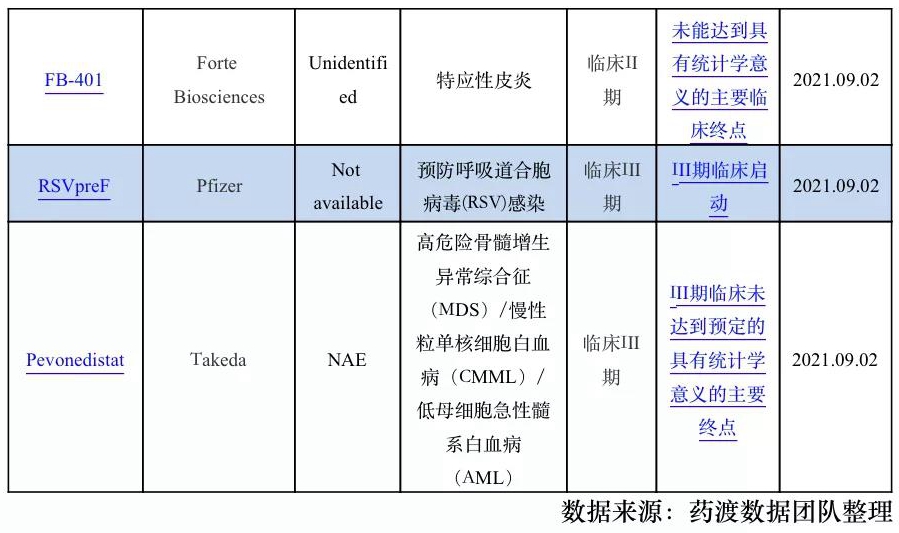
1.3全球新药研发进展
02
国内药物批准/研发动态
2.1国内新药批准情况
2.1.1 创新/改良型新药批准情况
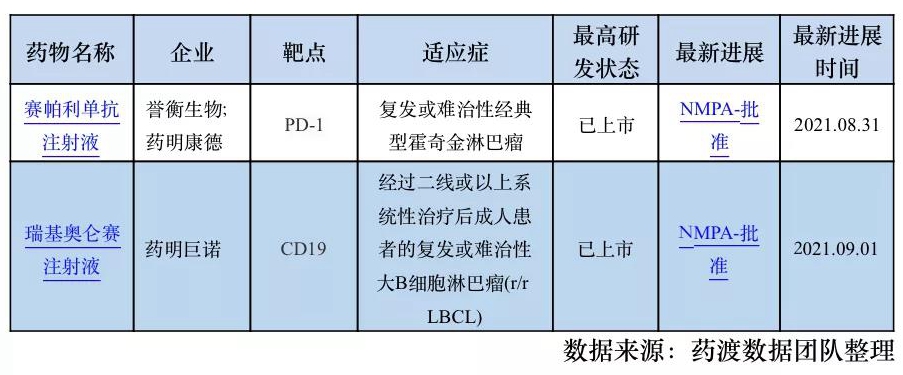
1. 国内第六家PD-1,誉衡生物赛帕利单抗获批!
2021年8月30日,国家药品监督管理局(NMPA)官网公示文件显示,誉衡生物申报的赛帕利单抗注射液(zimberelimab injection)正式获得上市批准,用于治疗二线以上复发或难治性经典型霍奇金淋巴瘤。
赛帕利单抗注射液是由誉衡生物委托药明生物开发的中国第 一个使用国际先进的转基因大鼠平台(OmniRat?)自主研发的全人源抗PD-1单克隆抗体。2017年,誉衡生物与药明生物将zimberelimab的国际权益独家授权给专注肿瘤领域的生物制药公司Arcus Biosciences,总合同金额高达8.16亿美元。Arcus正在开展多项临床试验以评估zimberelimab作为单药疗法和联合疗法的疗效。
2020年5月,赛帕利单抗首次入选2020版《CSCO淋巴瘤诊疗指南》,并获得专家的II级推荐。2021年3月,国家药品监督管理局药品审评中心(CDE)将赛帕利单抗注射液纳入突破性治疗品种,拟定适应症为接受过一线或以上含铂标准化疗后进展的复发或转移、PD-L1表达阳性(CPS≥1)宫颈癌。
赛帕利单抗治疗经典型霍奇金淋巴瘤Ⅱ期注册临床研究共纳入了85例经过二线以上系统化疗的复发或难治性经典型霍奇金淋巴瘤患者。所有患者均接受了240 mg 固定剂量,每2周一次的赛帕利单抗注射液持续给药,直至发生确定的疾病进展、死亡、不可耐受的**等。截至2020年4月18日,研究的中位随访时间达到15.8个月,经过独立影像评估委员会(IRC)评估,91.67%的患者达到客观缓解。全部患者的靶病灶直径总和与基线相比均有所减小,治疗效果显著。中位缓解持续时间(DOR)、中位无进展生存期(PFS)和中位总生存期(OS)尚未达到。研究中观察到的治疗相关不良事件(TRAE)中,大部分为1级或2级,未观察到与已上市的PD-1药品不同的不良反应。原文链接
2. 药明巨诺瑞基奥仑赛注射液获NMPA批准,国内第二款CAR-T疗法上市!
根据NMPA官网显示,2021年9月3日,药明巨诺CAR-T 疗法产品瑞基奥仑赛注射液获批上市,适应症为治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)。瑞基奥仑赛注射液是中国首 个1类按照生物制品申报获批的CAR-T产品,也是国内第2个,全球第6个获批的CAR-T产品。
2017年12月,药明巨诺向NMPA递交了瑞基奥仑赛注射液治疗复发难治淋巴瘤和白血病的临床试验申请,并于2018年6月获得批准,成为中国境内首 个获准临床的靶向CD19的CAR-T产品。
2020年底,药明巨诺在第62届美国血液学会(ASH)年会上公布了瑞基奥仑赛注射液的关键性临床研究——RELIANCE试验的数据。截止2020年6月17日,在58例可评估有效性的患者中,瑞基奥仑赛治疗后的最 佳客观缓解率为75.9%,最 佳完全缓解率为51.7%;在59例接受治疗的患者中,≥3级细胞因子释放综合征(CRS)及神经**(NT)的发生率仅分别为5.1%及3.4%。
目前,药明巨诺还在继续开发瑞基奥仑赛注射液用于治疗多种其它血液肿瘤的适应症,包括滤泡淋巴瘤(FL)、套细胞淋巴瘤(MCL)、慢性淋巴细胞白血病(CLL)、二线弥漫性大B细胞淋巴瘤(DLBCL)、成人及儿童或青少年急性淋巴细胞白血病(ALL)等。其中,瑞基奥仑赛注射液治疗复发或难治性滤泡淋巴瘤的申请,已于2020年9月被NMPA纳入突破性治疗品种。
2.1.2 新适应症/联合用药等批准情况
本周无新适应症/联合用药等新药获批。
2.2 国内新药申报最新进展
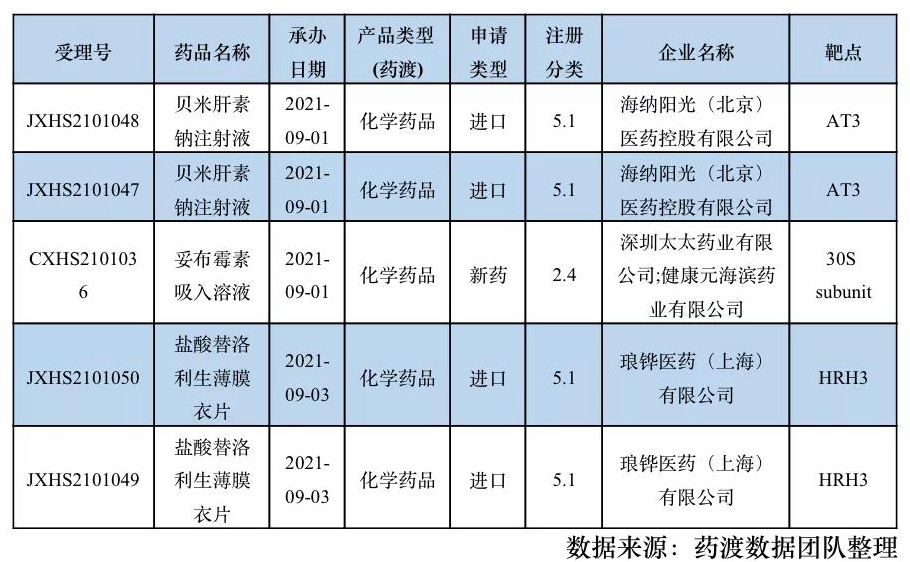
2.2.1 申报上市情况
参考:
1.https://investors.biomarin.com/2021-08-27-European-Commission-Approves-BioMarins-VOXZOGO-R-vosoritide-for-the-Treatment-of-Children-with-Achondroplasia-from-Age-2-Until-Growth-Plates-Close
2.https://www.janssen.com/janssen-announces-us-fda-approval-invega-hafyera-6-month-paliperidone-palmitate-first-and-only
3.https://ir.beigene.com/news-details/?id=802fb825-acb1-455d-b916-c95068817a9d
4.http://www.gloria.cc/index.php?m=content&c=index&a=show&catid=74&id=476
5.https://mp.weixin.qq.com/s?__biz=MzUxMTY5MzM5OQ==&mid=2247513588&idx=2&sn=ec3cd2c89ebb6b1452ac3083938839f2&chksm=f96d32ccce1abbda6befb2def89d399c1cbf1e1c475239eccfdfaeaa8538d8ff71776728e598&scene=58&subscene=0



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57