偏头痛是最常见的致残性原发性头痛,临床表现为反复发作的中重度头痛,多发生于偏侧部头痛,常为搏动性,可伴恶心、呕吐、畏光和畏声等自主神经功能紊乱症状。中国偏头痛年患病率为9.3%,女性与男性之比约为2:1。
美国FDA在2021年9月先后批准了dihydroergotamine甲磺酸盐鼻喷雾剂(商品名:Trudhesa)与atogepant 胶囊剂(商品名:Qulipta)两种新型抗偏头痛药物。Zobdeh F等人[1]对抗偏头痛药物的类别、作用机制等进行了综述,本文即以之为基础,分析了新型抗偏头痛药物的最新研发、专利与市场。
PART
0 1.
降钙素基因相关肽(CGRP)抑制剂类单克隆抗体
1.1 Eptinezumab注射液
1.1.1 简介
本品是最早由Alder公司开发的一种CGRP抑制剂类单克隆抗体,而灵北制药于2019年10月通过收购的方式获得本品的开发权,并由其启动各国/地区的行政申报工作。
本品于2020年2月获FDA批准(商品名:VYEPTI,持证商为灵北制药)每三个月静脉输液一次用于偏头痛的预防性治疗,主要的不良反应为鼻咽炎与过敏反应。
灵北制药已取得了本品在中国开展中国临床试验许可,并已经完成一项中国1期安全性与耐受性试验,另两项中国3期临床试验尚在招募中。虽然本品尚未获EMA批准,但英国国家健康与临床优化研究所(NICE)正在制订本品用于预防偏头痛的指南。
1.1.2 最新的报道
Michael J Marmura等人[2]对Eptinezumab的一项3期、双盲、安慰剂对照的PROMISE-2 研究 (NCT02974153)进行的事后分析发现,431名慢性偏头痛患者与1072名药物过量性头痛患者采用eptinezumab 100 mg、eptinezumab 300 mg与安慰剂分别治疗24周,各组受试者的每月急性偏头痛用药量依次较基线下降49%、49%与29%。Eptinezumab治疗组各类药物用药量下降率也在数值上高于安慰剂。Eptinezumab两个剂量组每个月低于药物过量性头痛阈值的受试者以及头痛与偏头痛发生率低于慢性偏头痛阈值的受试者所占比例均在数值高于安慰剂。Eptinezumab治疗组与安慰剂对照组不再接受会见且低于药物过量偏头痛/慢性偏头痛阈值的患者所占比例分别为29.0% (58/200)与6.3% (6/96)。
1.1.3 原研核心专利
Eptinezumab的Cortallis报告指出,根据Alder公司2015年发布的公告,Eptinezumab专利的有效期截至2032年。
1.1.4 已有市场规模
由于本品尚未获得美国以外国家或地区的批准,故已有市场规模相 对较小。根据IMS数据库的数据,本品2020年全球销售额(仅美国)为0.11亿美元。另据灵北制药的半年报信息,本品2021年上半年的销售额约为0.3亿美元。
1.2 Galcanezumab注射液
1.2.1 简介
Galcanezumab是由礼来公司开发的一种CGRP抑制剂类单克隆抗体,先后于2018年9月与11月获FDA与EMA批准(商品名为EMGALITY)每月皮下注射一次用于偏头痛的预防性治疗与发作性丛集性头痛的治疗。
礼来公司已经完成本品的一项中国1期安全性、耐受性试验,另一项中国3期临床试验尚在招募中。
此外,本品已获NICE推荐用于预防偏头痛。
1.2.2 最新的报道
一项3b期 CONQUER试验(NCT03559257)中,18~75岁采用既往预防性药物干预失败的发作性或慢性偏头痛患者随机分组后分别采用galcanezumab (120 mg/月,负荷剂量为240 mg,n = 232)或安慰剂(n = 230)双盲治疗3个月,而后进入为期3个月开放标签扩展期治疗(120 mg/月 galcanezumab)。Uwe Reuter等人[3]报道称,整体受试人群、发作性偏头痛人群与慢性偏头痛人群双盲治疗期与开放标签治疗期结束时的每月偏头痛天数平均变化值如下表所示。
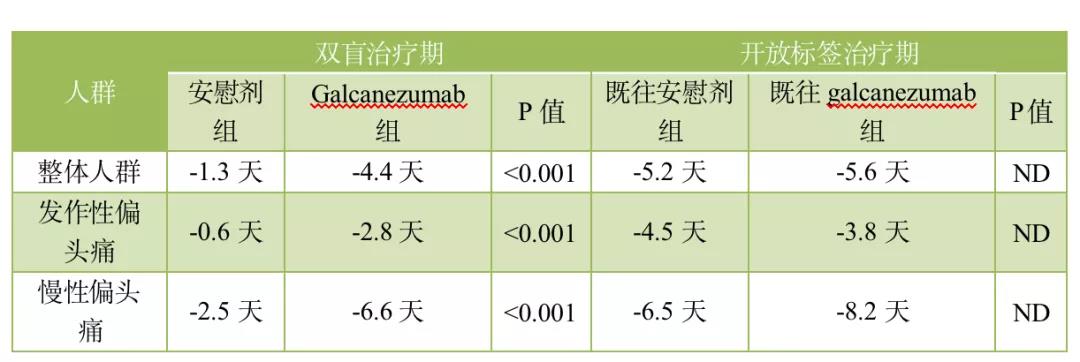
Leslie Citrome等人[4]以实现特定有效率的需要治疗人数(NNT)和需要伤害人数(NNH)以及有助或有害的可能性(LHH)为指标,以4项3期随机化、对照试验为基础,考察了galcanezumab治疗发作性或慢性偏头痛的风险效益特征。结果发现,galcanezumab 120 mg的双盲治疗期间,实现每月头痛天数较基线下降率≥30%与≥50%的NNT值在4~10之间,而下降率≥75%的NNT在5~23之间。NNH在93~1000之间,而LHH在18.6~104.6之间。基于此,作者认为,与安慰剂相比,galcanezumab 120 mg具有良好的风险效益特征。
1.2.3 现有市场规模
根据IMS数据库的数据,2018年~2020年本品的历年全球销售额依次为0.17美元、4.7亿美元与8.86亿美元,增长势头强劲。
另据NICE的数据,galcanezumab 120mg注射剂的定价为450英镑/剂。
1.3 Erenumab注射液
1.3.1 简介
Erenumab是由Amgen公司与诺华公司合作开发的一种CGRP抑制剂类单克隆抗体,已先后于2018年5月与2018年7月分别获FDA与EMA批准(商品名AIMOVIG)每月皮下注射一次用于偏头痛的预防性治疗。
诺华公司已经完成了本品的一项中国1期药代动力学研究,另两项中国3期临床试验尚在受试者招募中。
本品也已经获得NICE推荐用于预防偏头痛。
1.3.2 最新的报道
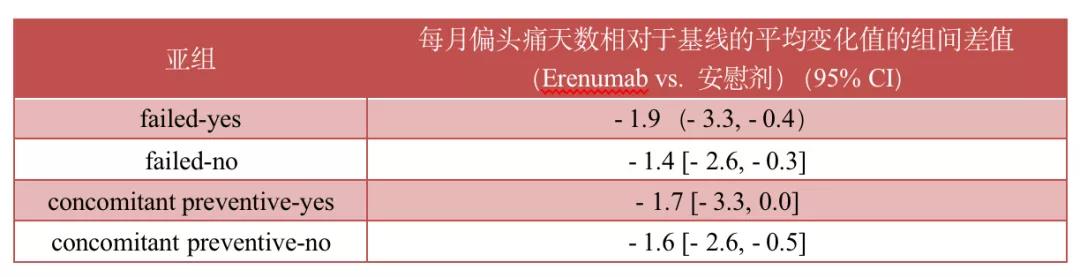
一项登记号为NCT03812224的3期、随机化、双盲的安慰剂对照试验考察了erenumab 70 mg 在有/无既往预防性治疗失败(分别为"failed-yes" 与"failed-no"亚组)与同时采用/未采用预防性治疗(分别为"concomitant preventive-yes" and "concomitant preventive-no"亚组)的日本偏头痛患者中的有效性与安全性 (分别为"failed-yes" 与"failed-no"亚组)。Koichi Hirata等人[5]对该试验进行的亚组分析结果发现,以第4~6个月每月偏头痛天数相 对于基线的减少值为主要结局指标,Erenumab 70 mg对各亚组的有效性均优于安慰剂对照组,结果如下表所示。
1.3.3 原研核心专利
CN102348722B保护了包括Erenumab在内的特异性结合人CGRP受体的分离的抗体或其抗原结合片段,有效期截至2029年12月。
1.3.4 已有市场规模
根据IMS数据库,2018年~2020年本品的历年销售额依次为2.9亿、10亿与12.0亿美元,增长势头强劲。
另据NICE数据,本品70mg或140mg注射液的价格为386.50英镑/剂。
1.4 Fremanezumab注射液
1.4.1 简介
Fremanezumab是由Teva公司开发的CGRP抑制剂类单克隆抗体,先后于2018年9月与2019年3月分别获FDA与EMA批准(商品名为AJOVY)每月或每三月皮下注射一次用于偏头痛的预防性治疗。
梯瓦公司已经获准在中国开展本品的临床试验,但尚无临床试验的公示信息。
Fremanezumab已经获NICE推荐用于预防偏头痛。
1.4.2 最新的文献报道
一项随机化、双盲、安慰剂对照的3b期临床试验中(NCT03308968),既往2~4类偏头痛预防性治疗效果欠佳的慢性或发作性偏头痛患者随机分组后分别接受fremanezumab (每季度一次或每月一次)或安慰剂治疗12周。Ladislav Pazdera等人[6]对根据既往预防性治疗药物种类而划分的亚组人群进行的分析结果发现,即使对于既往4种预防治疗效果欠佳的患者而言,fremanezumab的改善效果也显着优于安慰剂,主要结果如下表所示。
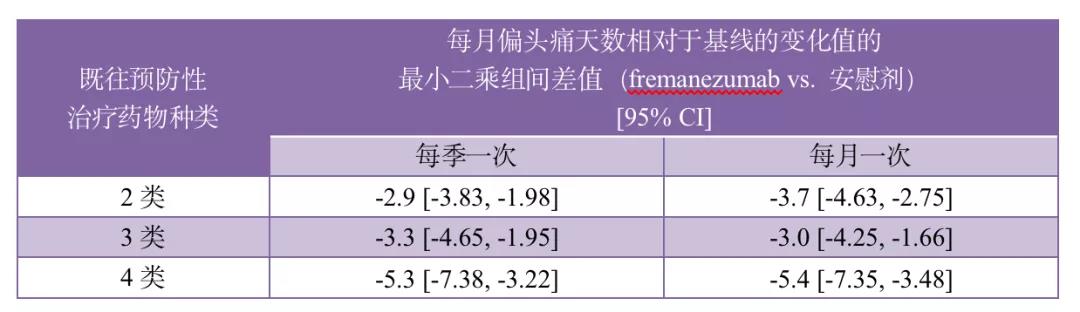
各P值均<0.05。
1.4.3 原研核心专利
CN101309704B保护了包括Fremanezumab在内的抗CGRP拮抗剂抗体。
1.4.4 已有市场规模
根据IMS数据,2018年~2020年本品的历年全球销售额依次为0.31亿、3.0亿与3.8亿美元,市场规模与增长势头不及Erenumab与Galcanezumab。
另据NICE数据,本品225mg与675mg注射液的价格分别为450.00英镑与1,350英镑。
PART
0 2.
小分子CGRP抑制剂
2.1 Atogepant片
2.1.1 简介
Atogepant是由Allergan公司(已被艾伯维公司收购)开发的一种小分子CGRP抑制剂,已于2021年9月28日(商品名为QULIPTA)获FDA批准每天口服一次用于治疗发作性偏头痛。
Allergan公司在中国开展的本品一项1期与两项3期临床试验均在受试者招募中。
2.1.2 最新的报道
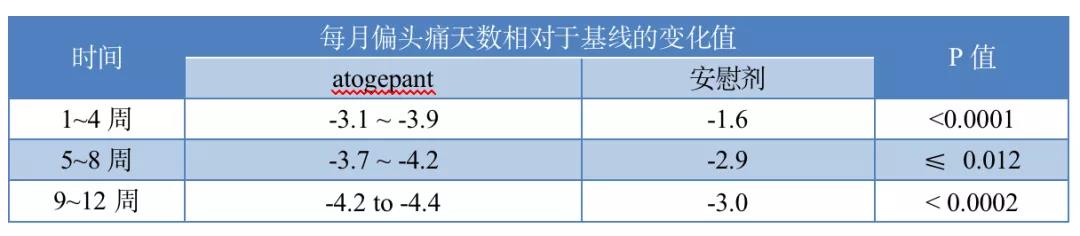
一项双盲、3期ADVANCE试验(NCT03777059.)中,每月偏头痛4~14天的患者随机分组后分别接受atogepant 10 mg、30 mg、60 mg或安慰剂口服qd治疗,均连续治疗12周。Todd J Schwedt等人[7]以每月偏头痛天数相 对于基线的变化值考察了atogepant用于偏头痛预防性治疗时有效性的时间历程,主要结果如下表所示。
2.1.3 原研核心专利
CN101448821B保护了包括Atogepant在内的羧酰胺螺内酰胺类CGRP抑制剂,有效期截至2025年9月。
2.1.4 市场规模
由于本品于今年9月获FDA批准是其全球范围内的首次获批,因此目前暂无市场信息。
2.2 Ubrogepant片
2.2.1 简介
Ubrogepant是由Allergan公司开发的一种小分子CGRP抑制剂,已于于2019年12月23日获FDA批准(商品名:UBRELVY)按需口服用于有无先兆的偏头痛的急性治疗。
本品尚未获EMA批准,也尚未启动在中国的注册申请。
2.2.2 最新的报道
Susan Hutchinson等人[8]基于两项多中心、随机化、双盲、安慰剂对照的3期临床试验(ACHIEVE Ⅰ与Ⅱ,NCT登记号分别为NCT02828020与NCT02867709.)的数据,考察了ubrogepant用于不同心血管疾病风险类别患者的偏头痛急性治疗的安全性与有效性,结果发现心血管疾病风险类别对ubrogepant的安全性与有效性均无显着的影响。
2.2.3 原研核心专利分析
CN103328478B保护了包括ubrogepant在内的哌 啶酮羧酰胺氮杂茚满酮CGRP受体抑制剂。
2.2.4 现有市场规模
根据IMS数据库,本品的2020年全球销售额为4.5亿美元。
作为口服制剂,本品在上市后第二年就取得上述销售额,可以认为是相当不错的市场表现。
2.3 Vazegepant鼻喷剂/胶囊
2.3.1 简介
Vazegepant是由Biohaven Biopharmaceuticals公司开发的一种小分子CGRP抑制剂,根据该公司的Pipeline信息, Vazegepant鼻喷雾剂与胶囊剂均处于3期临床试验阶段。
2.3.2 最新的报道
未在PUBMED数据库中检索到与Vazegepant有关的临床试验信息,Biohaven Biopharmaceuticals公司的公告称,Vazegepant是目前首 个与唯的处于晚期临床试验阶段的鼻腔给药的CGRP拮抗剂。
2.3.3 原研核心专利信息
CN102834388B保护了Vazegepant,有效期截至2031年3月。
2.4 Rimegepant硫酸盐口服崩解片
2.4.1 简介
本品是BIOHAVEN开发的一种小分子CGRP抑制剂,已于2020年2月27日获FDA批准(商品名NURTEC ODT)按需口服用于有无先兆的偏头痛的急性治疗或每隔一天口服一次用于发作性偏头痛的预防性治疗。
本品尚未获得EMA或英国MHRA批准,而NICE正在制订本品用于预防偏头痛的指南。
本品已经完成了一项在中国开展的1期临床试验,另有两项3期临床试验尚在招募受试者。
2.4.2 最新的文献报道
Karissa Johnston等人[9]对涉及rimegepant、ubrogepant与lasmiditan的一项随机对照试验进行的荟萃分析结果发现,lasmiditan 200 mg的有效性最高,rimegepant的有效性不及低剂量的lasmiditan与所有剂量的ubrogepant。然而,lasmiditan 200 mg与高发病率的不良反应(尤其是失眠、眩晕)相关。
2.4.3 原研核心专利
CN102656159B保护了Rimegepant,有效期截至2031年 3月。
2.4.4 已有市场规模
根据IMS数据库,本品的2020年全球销售额为2.7亿美元,对于口服制剂,该销售额属于差强人意的市场表现。
PART
0 3.
5-HT1F受体激动剂
3.1 琥珀酸Lasmiditan片
3.1.1 简介
是由礼来公司开发的一种5-HT1F受体激动剂,已于2019年10月11日获FDA批准(商品名)按需口服用于有无先兆的偏头痛的急性治疗。
本品尚未获EMA或英国MHRA的批准,但NICE正在制订本品用于治疗急性偏头痛的指南。
礼来公司已经完成了本品的 一项中国1期临床试验与一项中国3期临床试验,但尚未启动上市申请。
3.1.2 最新的文献报告
Uwe Reuter等人[10]对3期随机化、安慰剂对照的双盲研究进行的亚组分析结果发现,在曲普坦类药物治疗效果欠佳的患者而言,就治疗后1小时的疼痛消失率而言,lasmiditan 200mg与100mg的效果均优于安慰剂对照。
3.1.3 原研核心专利
CN100352817C保护了包括Lasmiditan在内的吡啶酰基吡啶类5-HT1F受体激动剂,有效期截至2023年3月。
CN110291079A请求保护Lasmiditan半琥珀酸盐二水合物晶型,该专利申请尚处于实质审查阶段,若授权,有效期截至2037年12月。
3.1.4 现有市场规模
根据IMS数据,本品的2020年全球销售额为0.17亿美元,其市场表现远不及同期上市的小分子口服CGRP抑制剂。
虽然偏头痛的患病率高,然而随着曾经主导偏头痛治疗的曲普坦类药物的核心专利陆续到期,偏头痛治疗药物市场近年来持续萎缩。
近年FDA批准的偏头痛新药以CGRP为主,又包括口服小分子与大分子单抗,部分药品上市后市场表现抢眼,比如部分单抗已经或即将实现重磅炸 弹级的销售额,将有望推动偏头痛市场的增长。
就核心专利而言,近年批准或处于晚期研发阶段的偏头痛新药大都有长期的专利保护,壁垒较高。当然,由于笔者精力与能力的限制,特别是大分子专利检索较难,本文所列的专利主要集中于核心专利,外周专利尚需要进一步补充。
参考文献:
1,Zobdeh F et al. Pharmacological treatment of migraine: Drug classes, mechanisms of action, clinical trials and new treatments. Br J Pharmacol. 2021 Aug 11. doi: 10.1111/bph.15657. Online ahead of print.
2,Michael J Marmura et al. Preventive migraine treatment with eptinezumab reduced acute headache medication and headache



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57