PART
0 1.
什么是脂质体?
1961年,Alec Douglas. Bangham和R.W.Horne用经过负染的磷脂调试电子显微镜时,在电镜下观察到磷脂形成了类似细胞质膜的结构,并于1964年发表了他们拍摄的电镜照片。进一步研究发现,当磷脂分散在水中时会形成多层小囊泡,并且每一层均为脂质双分子层,各层之间被水相隔开。他们将这种内部是一定量水完全由单层或多层同心(或非同心)磷脂双分子层包裹的人工囊泡称为脂质体。由于脂质体的结构类似于生物膜,故又称为人工生物膜。
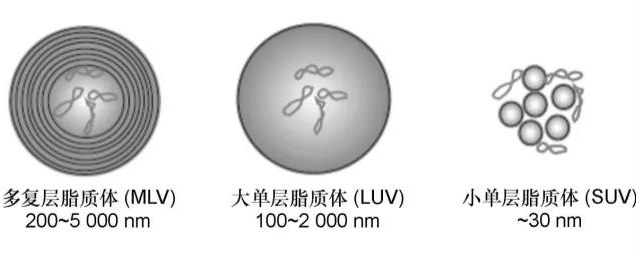
脂质体的基本结构和类型可分为单层脂质体和多层脂质体。含有单层双分子层磷脂膜的囊泡成为单层脂质体(ULV)即单室脂质体。单室脂质体又分为小单室脂质体(SUV, 粒径<100nm)即纳米脂质体、大单室脂质体(LUV, 粒径>100nm)和巨大大单室脂质体(GUV, 粒径>1000nm)。含有多层双分子层磷脂膜的囊泡称为多层脂质体(MLV, 粒径100~1000nm)。含有多个单室脂质体的囊泡称为多室脂质体(MVV, 粒径>1000nm)。
PART
0 2.
什么是脂质体包封率?
包封率是脂质体的关键质量属性,它指的是包封在脂质双分子层中的药物含量占总投药量的百分比,能反映出脂质体中药物包封程度的高低,以指导制备工艺的改进。
由于包封的药物性质不同,脂质体膜材料不同,测定每种脂质体包封率的最 佳方法往往需要经实验考察才能确定。包封率测定的关键是将包封药物和未包封的游离药物分离,再利用光谱、色谱等分析手段检测包封药物或游离药物的浓度。常用的包封率测定方法有:离心法、超滤离心法、葡聚糖凝胶柱法、微柱离心法、透析与反透析法、鱼精蛋白凝聚法、荧光法等。
(一) 离心法
按照离心转速的不同,离心法分为低速离心法和超速离心法。低速离心法适用于脂溶性药物,其工作原理是脂溶性的游离药物不溶于溶解脂质体所需的水相介质,而悬浮在体系中,采用相 对较小的离心强度和较短的离心时间,这些未溶的游离药物会因离心力的作用而沉降,但脂质体仍存在于上清液中,从而实现分离。
超速离心法要求离心转速大于20 000 r/min,离心时间一般要长于30 min。离心过程中因空气摩擦产热,需使用控温离心机。与低速离心法刚好相反,超速离心法中脂质体最终存在于沉淀中。由于脂质体和不溶的游离药物会一起沉降下来,无法实现二者的分离,所以此法适用于水溶性较好的药物的测定,可保证游离药物仍存在于上清液中。此外应注意较强的离心力作用可能会导致微粒聚集,破坏脂质体双分子层结构,导致药物发生泄漏。
(二) 超滤离心法
超滤离心法是将脂质体放入配有超滤膜的超滤管中,在适宜的转速下离心,游离药物在离心力的作用下可通过超滤膜,而脂质体则被截留,从而实现二者的分离。超滤离心法多用于测定水溶性药物脂质体的包封率。
然而“浓差极化”现象的存在限制了超滤法的应用。浓差极化现象是由于在超滤过程中,溶剂和小分子溶质能透过超滤膜,而大分子溶质被截留在膜内,这就会导致超滤膜表面的大分子溶质浓度升高,引起膜附近的渗透压增加,阻碍溶液继续向超滤膜方向扩散,进而降低了溶剂和小分子物质的膜透过率。
(三) 葡聚糖凝胶柱法
葡聚糖颗粒在溶胀后可形成凝胶状结构,其内部具有一定大小的孔径,小分子游离药物可进入孔内,实现一定程度的保留;而脂质体粒径大于凝胶孔径,脂质体无法进入孔内,于是少量洗脱液便可将其洗脱下来。利用脂质体和游离药物在葡聚糖凝胶柱上保留能力的不同可实现二者的分离。
(四) 微柱离心法
相比葡聚糖凝胶柱法,微柱离心法加入的洗脱液体积大大减小,避免了脂质体因稀释作用而发生的泄漏。此法是将溶胀好的葡聚糖凝胶或经预处理的离子交换树脂装入注射器中,反复平衡、离心后制成干燥的微柱,然后在其顶端加入脂质体混悬液,静置几分钟后再加入洗脱液,设置适宜的离心转速将脂质体洗脱下来。若凝胶对脂质体有很强的吸附作用,则不能选用该法。实验中应注意离心转速的选择,转速过大或过小都可能引起凝胶柱柱头断裂,且转速过大会将游离药物也洗脱下来。
(五) 透析与反透析法
透析法是将脂质体放入截留一定分子量的透析袋内,一般用水或PBS缓冲液作为透析介质,游离药物因透析袋内外的浓度差而向透析介质中转移,而脂质体因为粒径较大则被截留在透析袋内,二者因此实现分离。但脂溶性游离药物在透析介质中溶解度较差,会聚集在透析膜表面,堵塞膜上微孔而无法进入透析外液。
透析试验中为了满足漏槽条件,需要大量的透析介质,这无疑会稀释整个脂质体系统,破坏脂质体和周围游离药物的动态平衡,甚至导致脂质体的泄漏,并且较长的透析时间也对脂质体的稳定性有很高的要求。反透析法可以避免上述问题的发生。它是将脂质体放在透析袋外,透析袋内装入透析介质。由于透析介质用量大大减少,可有效避免脂质体因为稀释作用而发生的泄漏。
(六) 其他方法
鱼精蛋白凝聚法:鱼精蛋白是一种碱性蛋白质,带正电,它可与带负电或中性的脂质体结合形成聚合物,密度有所增加,离心后脂质体-鱼精蛋白聚合物被沉淀下来,因而与游离药物实现分离。
固相萃取法:利用色谱吸附原理,游离药物被吸附在极性相近的SPE柱固定相上,而脂质体在SPE 柱上无保留,少量水便可洗脱下来。固相萃取法对脂质体和游离药物的分离度较高,因为它是借助更特征的,更稳定的吸附能力的差异实现分离。然而该法较为复杂,药物与SPE柱固定相之间吸附作用的强弱受多种因素影响,需要进行大量实验才能摸索出最 佳的实验条件。
荧光法:目前使用的包封率测定方法大部分都需要先将脂质体和游离药物分离,而荧光法不需进行分离,只要利用包封药物和游离药物不同的荧光特性,比较脂质体破乳前后荧光强度的变化,便可计算出包封率。
表1 几种载药脂质体包封率测定方法对比
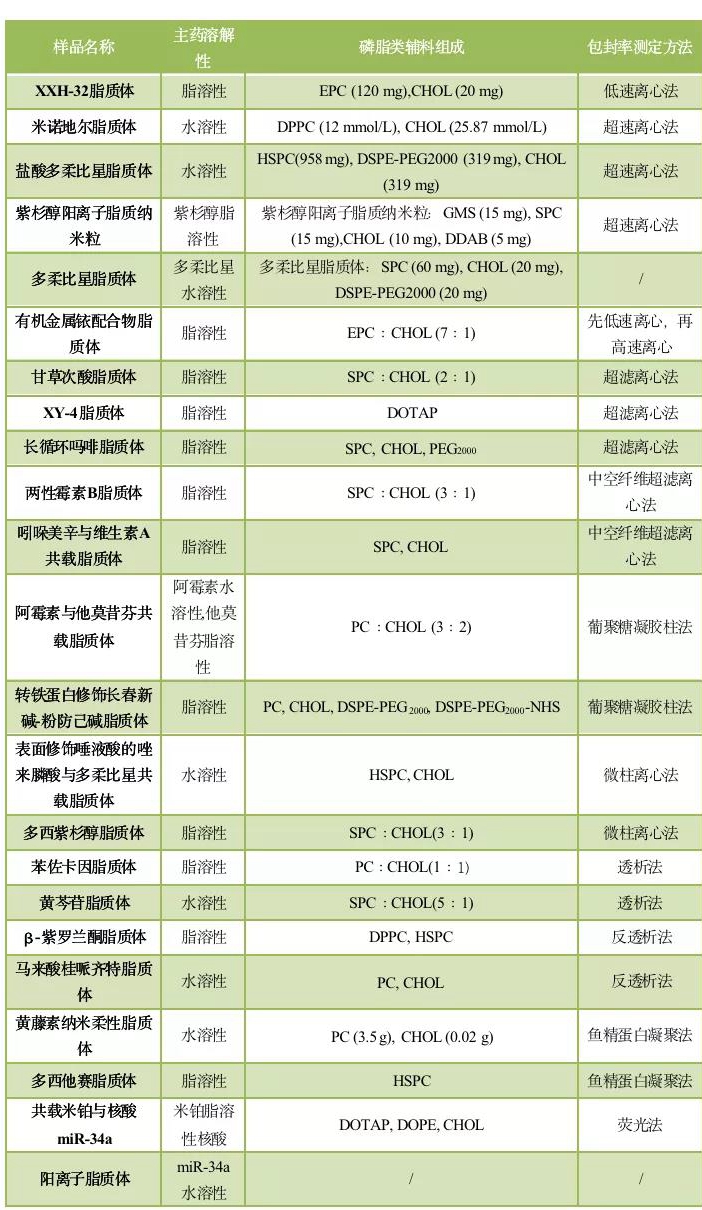
备注:EPC:蛋黄卵磷脂;CHOL:胆固醇;DPPC:二棕榈酰磷脂酰胆碱;DCP:鞘髓磷脂;GMS:单双甘油脂肪酸酯;SPC:大豆卵磷脂;DDAB:双十二烷基二甲基溴化铵;PEG2000:聚乙二醇2000;DSPE-PEG2000:二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000;PC:卵磷脂; DSPE-PEG2000-NHS:二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-N-羟基琥珀酰亚胺;DOTAP:(2,3-二油酰基-丙基)-三甲胺;HSPC:氢化大豆卵磷脂;DOPE:二油酰磷脂酰乙醇胺
PART
0 3.
如何选用最合适的包封率测定方法呢?
低速离心法适用于脂溶性药物,操作简单,且不易破坏脂质体膜结构,但脂质体和游离药物常常不能完全分离;超速离心法多用于水溶性药物,且要求脂质体膜结构有一定的硬度,能够耐受高转速的影响。超滤离心法适用范围较广,超滤膜的材料和截留分子量有多种类型,可满足试验者的多重需要;其缺点是可能会出现浓差极化现象,在一定程度上稀释脂质体待测溶液可以避免该现象的发生。葡聚糖凝胶柱法和微柱离心法均是利用分子排阻的原理来分离,但如果药物在凝胶柱上无保留或吸附过强,则不能采用这两种方法。葡聚糖凝胶柱法由于大量洗脱液的加入稀释了脂质体系统,可能会导致脂质体泄漏。但是微柱离心法的柱体积小,加入洗脱液的体积也少,不会引起脂质体泄漏,但是需要考察离心转速,以获得最 佳的分离效果。透析法也是测定包封率的常用手段,适用于水溶性药物,但是透析时间一般长达36 h以上,对脂质体稳定性有较高要求;此外大量透析介质的加入同样会稀释脂质体系统,也可能导致脂质体泄漏。反透析法极大地减少了透析介质的用量,较好地避免了因稀释作用而发生的脂质体泄漏。鱼精蛋白凝聚法只适用于带负电及中性的脂质体,而固相萃取法虽然在分离脂质体和游离药物方面有不错的效果,但是实验方法复杂,不易摸索出最 佳分离条件。荧光法可在脂质体和游离药物共存的状态下测定包封率,不要求把二者分离,但一般均需要引入荧光指示剂,发生某种荧光反应来计算包封率。
根据待测物的性质和各种测定方法的特点,总结出脂质体包封率测定方法选择决策树,见图1。
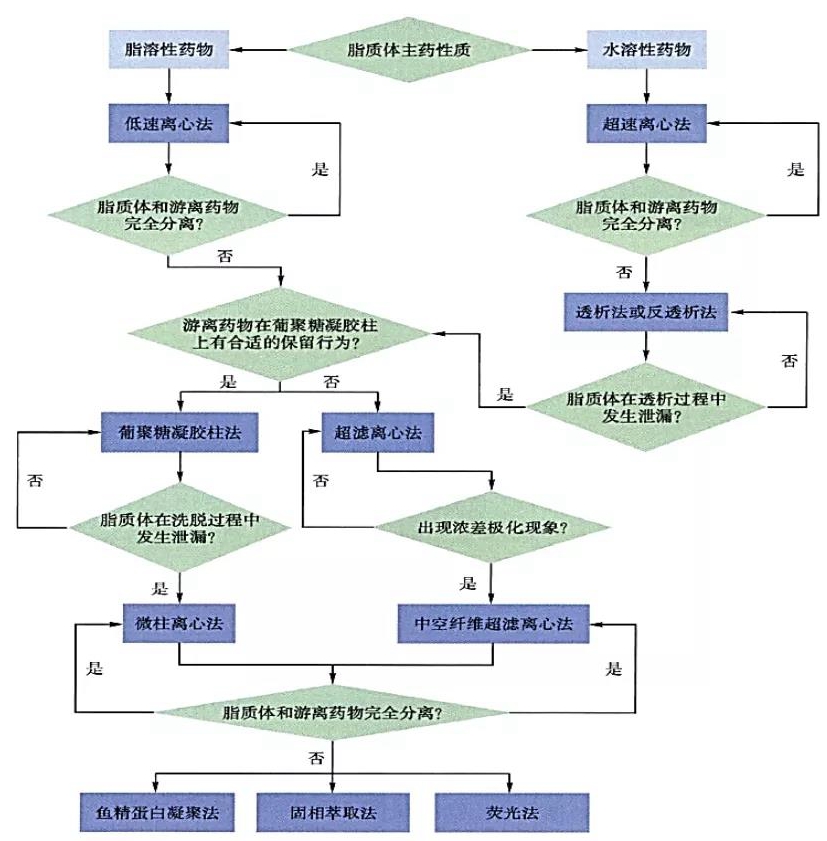
图1 脂质体包封率测定方法选择决策树
PART
0 4.
影响脂质体包封率的因素有哪些?
影响脂质体包封率的因素有很多,包括脂质膜的组成、磷脂链长、电荷、粒径大小、制备方法、药物的性质等,选择其中合适的一项或者几项进行改进,能改善或提高脂质体的包封率。
脂质膜组成和脂质体电位
脂质双层膜的组成影响着药物在膜内的分配和包封率。脂质体由大豆或蛋黄中提取的磷脂酰胆碱(phosphatidylcholine,PC)或其氢化衍生物制备而成。天然磷脂上含有不饱和脂肪酰链,而它们易氧化分解,影响脂质体的稳定性。
药物性质
药物自身的溶解度、极性和双分子层的匹配程度等因素均会对包封率产生影响。具有高亲脂性或高亲水性的药物,即lgPoct 在4.5~-0.3 的药物能形成包封率较高的脂质体。所以可以考虑将药物成盐或者酯化再形成脂质体,以提高脂质体的包封率或稳定性。
PART
0 5.
包封率如何计算?
《中国药典》2005年版(二部)附录“微囊、微球及脂质体制剂指导原则”中质量检查项目下规定:若得到的是分散在液体介质中的微囊、微球、脂质体,应通过适当的方法(如凝胶色谱柱法、离心法或透析法)进行分离后测定,按下式计算包封率。
包封率(%)=系统中包封的药量/系统中包封与未包封的总药量×100%
包封率不得小于80%。
PART
0 6.
展望
现有的包封率测定方法基本上都是利用脂质体和游离药物在粒径尺寸方面的差异先将二者分离,再准确测定某一方的浓度。但是这种物理差异专属性不强且不稳定,易受影响和干扰。未来包封率测定方法应该更多地结合光谱、色谱等手段,以增加方法的专属性和可靠性,还可利用脂质体和游离药物在物理、化学性质方面其他的不同点,开发出具有不同工作原理的新方法,并且各种方法之间可以相互印证,使测定结果更可靠。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57