2021年10月26日,国家药典委员会官网发布《细胞类制品微生物检查法》公示稿,公示期为三个月,弥补了国内细胞类制品快速微生物替代方法领域的空白。
PART
0 1.
细胞类制品微生物检查方法创新的必要性
近年来,细胞类制品(如明星产品-细胞治疗产品)突飞猛进的发展,因其在临床研究中取得的显著疗效而成为学术界和产业界共同关注的焦点,在肿瘤领域(白血病、淋巴瘤等)治疗中展现出显著的治疗效果而成为国内外研究的热点。
但该类制品在质量属性和无菌生产工艺上存在诸多特殊性,其个体差异大、产量少、效期短、临床需求紧迫,终产品需要快速放行;加上作为无菌产品在生产过程中,因细胞本身无法过滤除菌,无菌生产工艺要求更高,对过程控制要求也更高,无菌检查试验仍按现行版《中国药典》中的无菌试验方法对细菌、真菌检查,这将不利于细胞类制品的研发和最终产品的无菌保证,中检院、上海药检所等多名无菌检测领域专家发文呼吁国内应参考《欧洲药典》“细胞产品的微生物控制”(Microbiological Examinationof Cell-based Preparations),尽快制订中国特色的无菌检查方法。
PART
0 2.
2020年版《中国药典》微生物检查方法用于细胞类制品局限性
现行版《中国药典》(2020年版)传统的无菌检查方法存在局限性,表现在以下几个方面:
(1) 检测试验时间长,效率低下,一个试验周期至少需14天,不利于企业及早采取纠正措施,无法保证在产品使用前完成放行检查。根据《细胞治疗产品研究与评价技术指导原则(试行)》(20171222)当细胞治疗产品放行检验受到时间限制时,可考虑加强工艺过程中的样品质量监控,将过程控制与放行检验相结合,通过过程控制简化放行检验。
(2) 一些微生物在指定试验条件下不易生长,即现行版《中国药典》(2020年版)传统的培养基配方和培养条件可能不适合一些微生物的生长,据报道有超过30%无菌检查失败发生在第7-14天。
(3) 细胞类制品样品量少,使无菌检查试验检测污染物的能力受到限制,污染程度越轻,出现错误结果的可能性越大。
PART
0 3.
中国特色的快速无菌检查法规重点内容抢先看
《细胞类制品微生物检查法》为快速微生物检查法,主要适用于效期短、批量小,采用现行无菌检查法(通则1101)无法保证在产品使用前完成放行检查的细胞类制品。
采用本法进行产品的微生物放行检查,应在充分考虑制品生产工艺、无菌保障水平、微生物污染风险、使用者获益/风险等因素的基础上,经风险评估后有条件地施行。《细胞类制品微生物检查法》法系采用基于商品化全自动微生物培养系统检测方法,通过仪器实时监测微生物生长代谢产生的二氧化碳引起的培养瓶内反应底物的显色或荧光变化信号,或培养瓶顶空压力变化信号,结合目视观察,判定供试品中有无微生物生长,重点内容梳理如下:
1、培养基适用性检查
此部分概括了商品化的仪器适配的培养基适用性检查的确认条件。至少应有2种适宜培养基用于检测真菌、需氧细菌和厌氧细菌,包括无菌性检查和灵敏度检查。
1.1促生长试验用微生物
检测真菌、需氧细菌和厌氧细菌的培养基应分别接种不大于100CFU的试验菌,中国特色《细胞类制品微生物检查法》没有列举培养基适用性检查用微生物的种类,笔者摘录了欧洲药典,促生长试验用微生物示例,供国内研究者参考,示例如下图:

1.2培养温度
置于系统确认的培养温度下培养,除另有规定外,接种细菌的培养基应在3天内生长良好,接种真菌的培养基应在5天内生长良好,中国特色《细胞类制品微生物检查法》没有列举合理温度设定的参数,笔者摘录了欧洲药典,自动化培养系统或自动化和人工结合试验法的合理温度设定示例,供国内研究者参考,示例如下图:

2、方法适用性试验
应至少采用2个批次的供试品进行方法适用性试验,每批供试品应至少平行进行3个重复的独立实验,方法适用性试验示例如下表:

3、供试品的快速无菌检查
3.1取样
供试品应能代表细胞产品的所有组分,并从成品中取样。如成品取样不适用,可采用替代取样方案,如选取在处理细胞最后接触的液体中取样。采用本法进行生产过程的中间质控时,应从相应质控点取样。
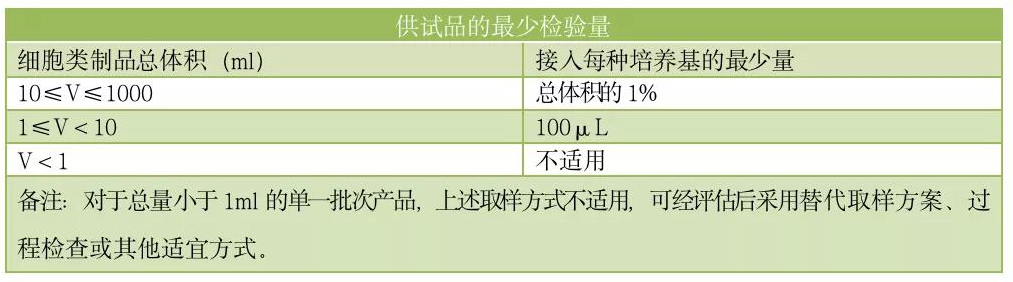
3.2供试品的最少检验量
对于单个容器且总体积(V)在1ml~1L的单一批次细胞制剂,供试品的最少检验量不应低于下表;中间产品有多个容器时,每个容器应分别取样进行检测。取样后应尽快将供试品接种至培养基,如供试品需存放,应评估存放的潜在污染风险。
3.3培养及观察
将供试品接种至培养基后尽快置于仪器中培养,禁止储存。培养时间不少于7天,根据方法适用性试验结果及特殊相关微生物的情况,可延长至14天。
3.4结果判断
(1) 若仪器判定各供试品管均为阴性结果,且目视观察未见浑浊,则供试品可判为符合规定。
(2) 若仪器判定有供试品管为阳性结果,且目视观察发现浑浊,则供试品判为不符合规定。
(3) 若仪器判定供试品管为阴性结果,但目视观察发现浑浊,或仪器判断为阳性结果,但目视观察未发现浑浊,出现以上两种情况时,取该培养物不少于1ml转种至同种新鲜培养基中,将原始培养物和新接种的培养基继续培养不少于4天,观察接种的同种培养基是否再出现浑浊;或取培养液涂片,染色,镜检,判断是否有菌。如目视观察发现浑浊或涂片发现有菌生长,判供试品不符合规定。
上述任何一种情况下如判供试品不符合规定,除非能充分证明试验结果无效,即生长的微生物非供试品所含,可对供试品进行重试,重试时,应重新取同量供试品,依法检查,结果判定同上。
应至少符合下列条件之一,判为试验无效:
(1) 无菌检查试验所用的设备及环境的微生物监控结果不符合无菌检查法的要求。
(2) 回顾无菌试验过程,发现有可能引起微生物污染的因素。
(3) 在阴性对照中观察到微生物生长。
(4) 供试品管中生长的微生物经鉴定后,确证是因无菌试验中所使用的物品和(或)无菌操作技术不当引起的。
专栏作者:滴水司南
生物医药高级工程师、执业药师,自媒体时代的药政法规搬运工,坚定终身学习的目标,坚持学用结合,努力做到知行合一。
参考文献
[1] 中国药典委员会官网、欧洲药典、中国药品标准杂志等
[2] www.gcpunion.org



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57