2021年11月12日,国家药监局再次公开征求《药品经营和使用质量监督管理办法(征求意见稿)》意见(征求意见截止日期:2021年11月26日),为贯彻落实《中华人民共和国药品管理法》《中华人民共和国**管理法》等法律法规,这是历时14年之后的一次全面大修,新版《药品经营和使用质量监督管理办法(征求意见稿)》共七章89条,整合现行《药品经营许可证管理办法》(原国家食品药品监督管理局第6号令)和《药品流通监督管理办法》(原国家食品药品监督管理局第26号令)的有关规定,制定更具针对性和操作性的《药品经营监督管理办法》。
本文对《药品经营和使用质量监督管理办法(征求意见稿)》出台的背景、主要新增修订内容进行了分析。
PART
0 1.
中国版药品经营和使用新规出台的背景
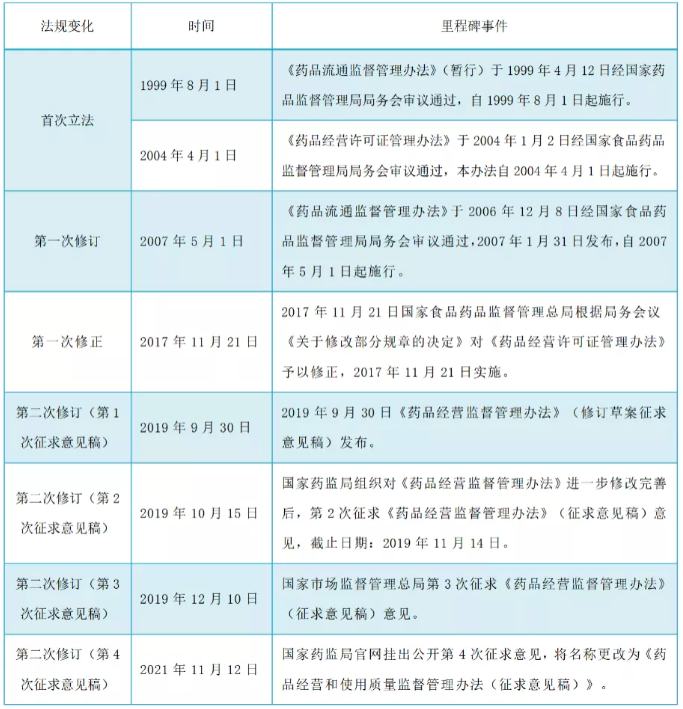
2019年年初,国家药监局正式启动《药品经营监督管理办法》的修订工作,组建起草专班,计划将《药品经营许可证管理办法》(原国家食品药品监督管理局第6号令)和《药品流通监督管理办法》(原国家食品药品监督管理局第26号令)进行整合。2019年9月30日《药品经营监督管理办法》(修订草案征求意见稿)发布,备受大家关注,从1999年首次立法到2007年第一次修订间隔了8年,而时隔14年之后,2021年我们可能迎来国内首部整合后《药品经营和使用质量监督管理办法》的落地实施。
PART
0 2.
新旧版药品经营和使用新规基本框架结构变化
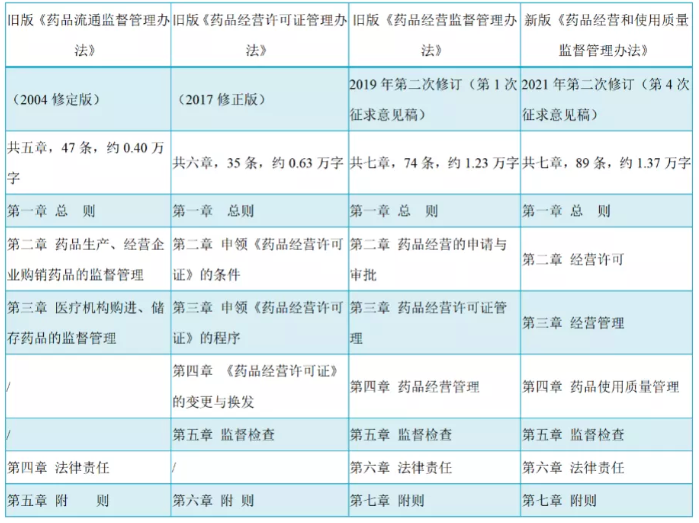
本次《药品经营和使用质量监督管理办法(征求意见稿)》是将《药品经营许可证管理办法》(原国家食品药品监督管理局第6号令)和《药品流通监督管理办法》(原国家食品药品监督管理局第26号令)进行了整合,框架与2017修正版基本保持一致,与旧版(2019年第二次修订(第1次征求意见稿)相比,2021年第二次修订(第4次征求意见稿)条款总数增加了15条,第四章标题由“医疗机构购进、储存药品管理”修改为“药品使用质量管理”,可见本次办法修改对药品使用环节的质量监管要求将大幅扩充与细化,对照如下表:
新旧版药品经营和使用新规章节对照表
PART
0 3.
新版药品经营和使用新规主要亮点内容抢先看
(1) 第一章 总 则
明确了药品经营监督的定义,对药品上市许可持有人制度、药品追溯制度提出原则性要求;增加药品使用环节质量要求,以及市场监管总局统一指导经营和使用执法职能。
(2) 第二章 经营许可
取消了药品经营企业的筹建审批和药品GSP认证,对药品经营的许可条件、开办验收标准、审批程序等进行规定。要求各省级药品监督管理部门按照《药品经营质量管理规范》及其现场检查指导原则制定验收细则,并严格组织现场检查,确保《药品经营质量管理规范》落实到位;落实“放管服”,明确只零售乙类OTC的药品零售企业实施告知承诺制审批;实施“两证合一”将原药品经营许可申请资料和药品GSP认证申请资料进行有机整合,保证标准不降低,药品监督管理部门按照药品经营质量管理规范及其现场检查指导原则、检查细则等有关规定组织开展申报资料技术审查、现场检查。经材料审查和现场检查,符合条件的,予以批准;不符合条件的,作出不予批准的书面决定,并说明理由。
(3) 第三章 经营管理
主要是对药品经营许可证的登载内容、编码规则、经营范围核定以及许可证的变更管理等作出规定,明确提出企业资质等电子化资料可以使用;“第三章 经营管理”中减少关于药品网络销售的条款,目前为原则性条款,具体要求详见《药品网络销售监督管理办法》;如首营资质电子化,明确《药品经营许可证》电子版证书与其印制版具有同等法律效力。药品上市许可持有人、药品批发企业销售药品时,首营资质资料通过网络核查、电子签章等方式确认的电子版具有同等效力。
(4) 第四章 药品使用质量管理
主要对药品经营行为提出规范要求,明确药品上市许可持有人、药品生产企业、药品经营企业的责任和义务;对零售连锁的管理明确了要求;对网络销售的条件和销售的平台义务作出了规定;明确持有人委托销售药品、网络销售药品、委托开展药品储存运输等按照备案管理。
(5) 第五章 监督检查
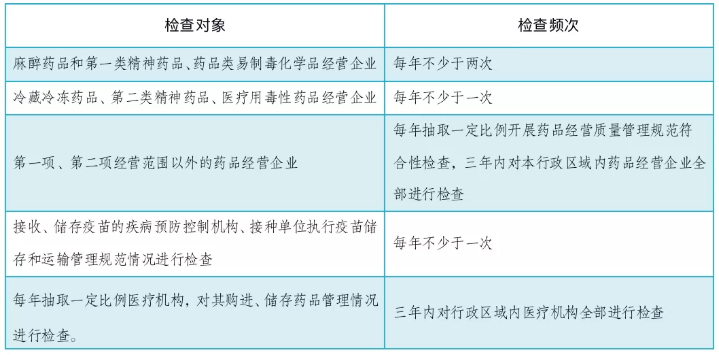
对省级、市县级药品监管部门的职责进行细化,明确了监管的形式和手段,要求药品监管部门制订年度监督检查计划,强化风险管理理念,明确检查的重点和频次,落实强化事中事后监管的要求,检查频次如:
(6) 第六章 法律责任
主要是对药品经营环节中违反经营许可规定、违反经营活动要求规定进行处罚的罚则。对《药品管理法》中未明确要求或需要再次明确的违法行为,链接《药品管理法》相应罚则,提出处罚条款,明确以销售、使用为目的购进、储存假劣药的,即直接认定为销售、使用假劣药行为。
(7) 第七章 附则
主要是对特殊管理药品、使用单位管理等未纳入正文的内容进行明确。规定了《办法》的解释权和实施时间。
参考文献
[1] www.nmpa.gov.cn和NMPAIE流通监管
专栏作者:滴水司南
生物医药高级工程师、执业药师,自媒体时代的药政法规搬运工,坚定终身学习的目标,坚持学用结合,努力做到知行合一。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57