据国家药监局药品审评中心(CDE)官网显示,2021年12月24日,南京北恒生物科技有限公司(以下简称北恒生物)自主研发的CTA101 UCAR-T(通用型CAR-T)细胞注射液产品新药临床试验申请获受理(受理号:CXSL2101509),本产品是药审中心受理的首 项“现货型”异体来源的CAR-T产品,具有重要意义。
北恒生物自主研发,具有独立知识产权的CTA101细胞注射液是国内首 个基于CRISPR基因编辑技术的免疫细胞治疗产品,是国内第一个 UCAR-T创新药,属治疗用生物制品1类新药,是一款双靶点UCAR-T细胞注射液,针对CD19和/或CD22阳性成人复发/难治急性淋巴白血病。
CTA101采用北恒生物第一代UCAR-T平台,结合CRISPR基因编辑技术,敲除TRAC基因以避免移植物抗宿主病(GvHD),同时敲除CD52基因并联合使用抗CD52单抗避免患者对CAR-T细胞的排异反应(HvG),延长UCAR-T细胞的体内存续时间。2021年4月,CTA101探索性临床研究(IIT)结果在Clinical Cancer Research 原著论文形式发表,初步数据显示,CTA101安全性及有效性良好。
关于UCAR-T
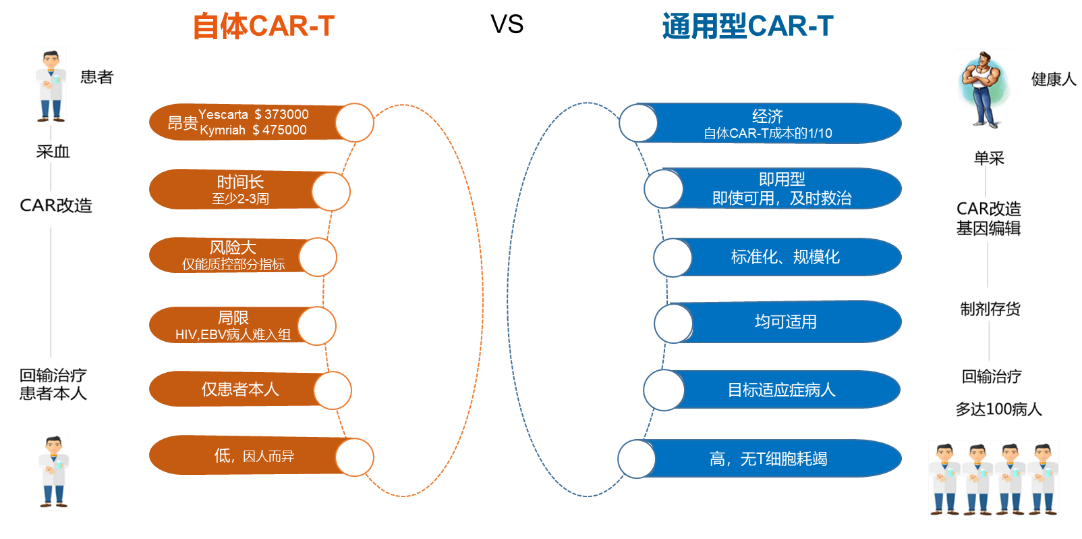
UCAR-T是使用健康人的T细胞制备完成,相比自体CAR-T,UCAR-T具有抗肿瘤活性高、成本低和可及性高等优势。通用型免疫细胞治疗无需配型,“现货"存储,即时使用,显著降低病人治疗周期,一位健康捐献者可制备成百上千人份“现货”,可显著降低细胞治疗成本。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57