01
发现与发展
要了解阿托伐他汀,那我们首先需要了解胆固醇的发现史。1816年,法国人Cherzeul率先把在胆结石中发现的一种具有脂类性质的物质命名为胆固醇。1841年,俄国Vogel证实动脉血管壁粥样硬化斑块中存在胆固醇。但此时,人们仍不知道胆固醇是引起动脉血管壁粥样硬化的罪魁祸首。1910年,被称为“类固醇之父”的德国阿道夫·温道斯(Adolf·Windaus)在研究人体尸体解剖标本中的胆固醇时,最早发现动脉粥样硬化与胆固醇异常升高有关。1913年,俄国病理学家阿尼茨科夫(Anitschkow),通过给家兔喂养高胆固醇饮食,从而成功了建立了世界上首 个动脉粥样硬化动物模型,也间接证明了阿道夫·温道斯的发现。
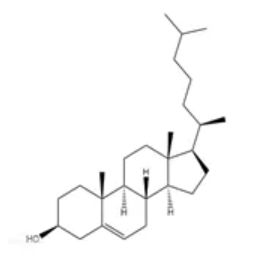
图1. 胆固醇长什么样?
动脉粥样硬化(atherosclerosis,AS)是冠心病、脑梗死、外周血管病的主要原因。脂质代谢障碍为动脉粥样硬化的病变基础。那胆固醇的合成与代谢是如何进行的呢?
关于胆固醇的代谢与合成的研究均获得过诺贝尔奖。1974年,美国科学家Goldstein和Brown以纯合子型FH(家族性高胆固醇血症)患者的皮肤成纤维细胞为对象,发现了细胞膜表面有高亲和力的LDL(低密度脂蛋白,胆固醇的一种存在形式)受体。他们也因为发现胆固醇代谢机制获1985年诺贝尔生理学或医学奖 。
1942年,布洛赫成功地发现了胆固醇生化合成的全过程。这是一套从一个名为“乙酰辅酶 A”的原料开始的、拥有30多步酶催化反应的复杂系统。该过程在肝 脏里进行着,其精巧与复杂程度简直令人目眩神迷!最终,布洛赫和发现胆固醇合成的原料——乙酰辅酶A的德国科学家费奥多?吕南(Feodor Lynen)共享了1964年的诺贝尔生理学或医学奖。
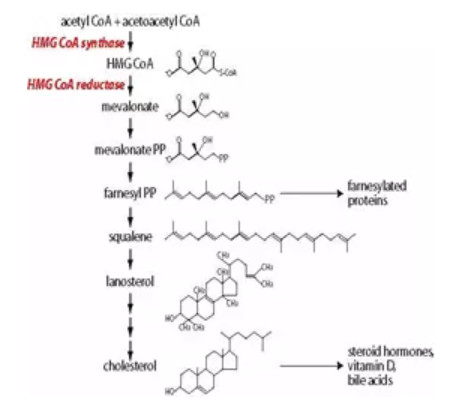
图2. 胆固醇合成机制
进行药物研发时,科学家都是在胆固醇生成途径中寻找靶点。
1959年,Max-Planck研究所首先发现了HMG-CoA还原酶;20世纪60年代,Siperstein等证明HMG-CoA还原酶的功能是催化HMG-CoA转化为MVA,抑制该酶的活性会有效减少胆固醇的生物合成,进而降低血浆胆固醇。我们通俗说的他汀类药物就是指HMG-CoA还原酶抑制剂。羟甲基戊二酸酯(HMG-CoA)是水溶性的,当抑制HMG-CoA还原酶时,存在分解代谢途径的替代途径,不会造成积累**。因此,HMG-CoA还原酶是一个极好的靶点。
1971年,就职于日本三共公司的微生物学家远藤章(Akira Endo),在桔青霉的发酵液中发现了对HMG-CoA还原酶具有强大抑制作用的天然产物——美伐他汀。他们确证了美伐他汀结构由六氢萘环骨架和β-羟基-δ-内酯两部分组成,其中内酯环开环后为3,5-二羟基庚酸侧链,是3-甲基3,5-二羟基戊酸(MVA)的结构类似物,所以美伐他汀通过竞争性阻断HMG-CoA还原酶而发挥抑制作用。
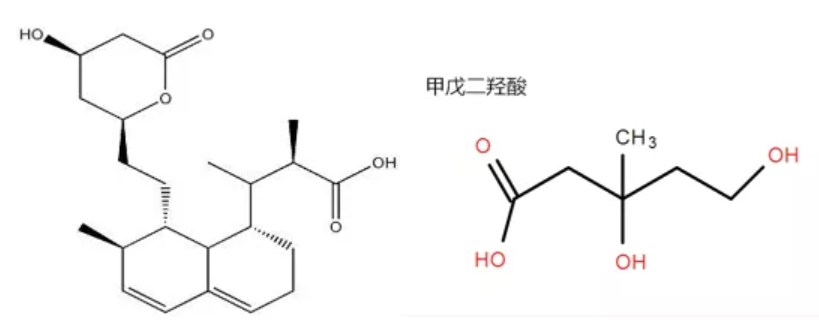
图3. 美伐他汀(左侧)和MVA(右侧)
1979年,默沙东在土曲霉的发酵液中提纯了HMG-CoA还原酶的有效抑制剂——后来命名为洛伐他汀。1982年在美国完成临床试验。1987通过FDA审批,成为第一种上市的他汀类药物,商品名为美降脂 (Mevacor)。
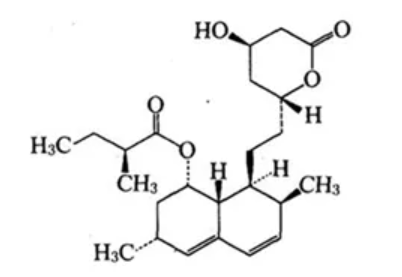
图4. 洛伐他汀
早在美降脂尚未上市的上世纪80年代中期,默克公司已经开始着手开发另一种降脂药物——后来于1992年初在美国上市、商品名为舒降之(Zocor)的辛伐他汀(Simvastatin)片。
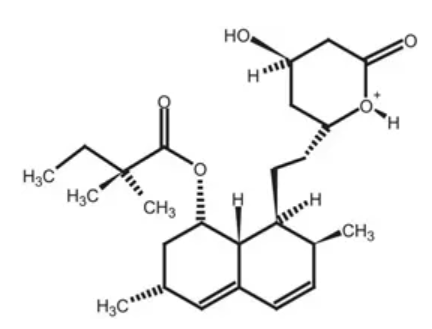
图5. 辛伐他汀
02
阿托伐他汀
1985年,Bruce Roth首次合成了阿托伐他汀钙,随后被辉瑞公司收购,并将商品命名为立普妥。在被首次人工合成后,阿托伐他汀又经历了一系列的发展,包括针对合成工艺的改良、针对适应症的积极探索、针对副作用的改良,以及市场的拓宽、仿制药的诞生等等。
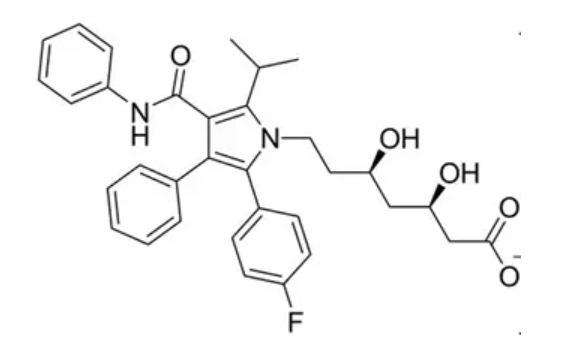
图6. 阿托伐他汀
立普妥中的阿托伐他汀钙是两分子阿托伐他汀通过Ca连接而成的化合物,其优点是在体内的药效维持时间更长,但仍需解离成阿托伐他汀发挥作用。因此,对该药物合成路径的改良,主要集中在针对阿托伐他汀单分子合成的改良。自Bruce Roth后,阿托伐他汀的新合成路径不断的被开发出来,仅仅以起始原料计就有多种分类:包括以2-(4-氟苯基)-2-溴-乙酸乙酯为起始原料、以阿托伐他汀醛为起始原料、以苯乙 酸为起始原料、以L-缬氨酸为起始原料等等,也包括以廉价易得的(R)-2-氯甲基代环氧乙烷为原料以避免雷尼镍危险性的合成路径。
在适应症的拓宽方面,阿托伐他汀也表现得非常好。我们知道,阿托伐他汀最初只是一味降血脂药,可以通过降低肝 脏的生物合成降低体内的胆固醇。但除了降脂功能外,阿托伐他汀还起到抑制血管平滑肌的增殖、迁移及促进其凋亡的作用,能够改善患者的血流变及血液黏度,从而改善心功能、血管内皮功能及凝血功能,临床上还可以用来预防冠心病和心衰等多种疾病,作用可谓广泛。
近年来,有研究指出阿托伐他汀具有抑制肿瘤细胞的增殖、促进肿瘤细胞的分化及凋亡, 影响细胞周期及分子信号传导等作用,且不良反应较常规的化疗药物小,有望将阿托伐他汀用于肿瘤的治疗。以p53基因为例,在2016年Nature Review Cancer上一篇综述详细的介绍,一条由p53基因控制的信号通路——甲羟戊酸途径(MVP),与他汀降脂通路完 美重合。野生型p53基因能在早期抑制肝癌的发生,在这个抑癌程序启动的过程中,MVP受到p53的严格控制。p53基因突变可上调MVP,从而增加癌细胞侵袭性。MVP途径既是p53基因的重要下游通路,也是体内胆固醇合成前体的重要来源。研究表明,他汀类药物在抑制MVP、降低胆固醇水平的同时,也能抑制p53突变型对MVP的上调,从而抑制癌细胞侵袭性。
03
药理学与药代动力学
在讨论阿托伐他汀的药理之前,有必要阐述一下研究背景:脂肪运输过程中胆固醇的转化和积累。背景研究表明,低密度脂蛋白(LDL)是导致胆固醇在血管壁上累积,引发心血管疾病的元凶。与之相反的是,高密度脂蛋白(HDL)则能够去除血管壁上的胆固醇,并将其运输到肝 脏吸收处理。
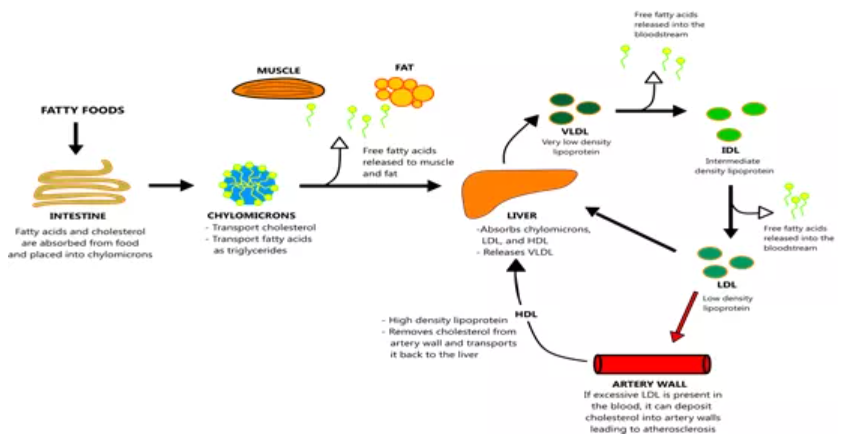
图7.脂肪运输过程与胆固醇转化和积累(图片来源:https://www.straighthealthcare.com/cholesterol-transport-figure.html)
从背景中可以看出,抑制LDL胆固醇的生成,就能起到降低血脂,从而降低心血管疾病风险的效果。研究表明,HMG-CoA还原酶是胆固醇生物合成中的限速酶(多步生物化学反应中决速步骤的催化酶)。这一步,是HMG-CoA还原酶催化HMG-CoA转化为MVA(3-甲基-3,5二羟基戊酸)。
他汀类药物的作用机理与该反应密切相关。他汀类药物的3,5-二羟基酸侧链能与HMG-CoA还原酶结合,抑制HMG-CoA还原酶与HMG-CoA的结合,从而抑制胆固醇的合成。他汀类药物的3,5-二羟基酸侧链部分的取向和键合相互作用与HMG-CoA的结合作用非常相似。大量氢键作用和离子对的存在导致蛋白质和他汀类3,5-二羟基酸侧链部分之间的电荷和形状互补,产生较强的结合能力。
与酶结合时,他汀类药物的疏水环处于一个狭窄的疏水袋中。酶蛋白质的疏水袋与他汀类药物的疏水环通过范德华力结合。阿托伐他汀的疏水基团和其他他汀类药物相比,比较明显的特征是其酰胺键的羰基能与Ser-565位点通过氢键结合,同时具有2型他汀类药物的共性:氟苯的氟原子与Arg-590位点的胍基产生强烈的极性作用。这些作用使得阿托伐他汀的疏水基同样能与酶紧密结合。
另外,阿托伐他汀的药代动力学(ADME)也已经得到了比较充分的研究。
吸收上,口服阿托伐他汀会迅速吸收,达到最 大血浆浓度(Tmax)大约需要1至2小时。药物的绝 对生物利用度约为14%。此外,阿托伐他汀与食物一同服用,或者在晚上服用时,吸收率都会有一定程度降低;
分布上,阿托伐他汀的平均分布量约为381L。它与蛋白质高度结合(≥98%),研究表明它很可能分泌到人乳中;
代谢上,阿托伐他汀的代谢主要是通过细胞色素P450 3A4羟基化来形成活性的邻羟基和对羟基羟基代谢产物,以及各种β-氧化代谢产物。邻羟基和对羟基代谢产物占全身HMG-CoA还原酶活性的70%。邻羟基代谢物通过葡萄糖醛酸化作用进行进一步的代谢;
排泄上,阿托伐他汀主要通过肝胆汁排泄消除,尿中回收率不到2%,没有发现任何肝肠循环。阿托伐他汀的消除半衰期约为14小时。阿托伐他汀还是肠P-糖蛋白外排转运蛋白的底物,在药物吸收过程中将药物泵回肠腔。
04
专利与市场
谈及阿托伐他汀的专利问题,其中最 具影响力的阿托伐他汀产品当属辉瑞公司的立普妥了。立普妥能取得骄傲成绩,疗效和营销十分重要,但同样离不开辉瑞公司的专利布局。1996年12月7日,辉瑞公司向FDA提交的立普妥新药申请正式获批;2011年底,阿托伐他汀化合物专利权到期,但由于辉瑞公司早从化合物、中间体、组合物、制备方法、晶型等不同角度,申请了一系列专利,为立普妥构建了严密的专利保护网,因此仍能在一定程度上延长相关产品的保护期限。2011年,立普妥化合物专利到期,然而其晶型专利需到2016年才到期,成为最初辉瑞保护其产品的核心专利之一。
这种多主题、多层次的专利保护布局,有效延长了其专利技术的保护周期,值得我国药企借鉴。从不同角度对企业研发的药品进行专利保护,不仅有利于有效且充分地保护技术成果,也可以延长企业对技术成果的整个专利保护期,充分享有专利保护期内药品销售市场的独占性,使收益最 大化。
作为目前世界上顶级调脂药物,阿伐他汀自1998年以来取得了优异的业绩。立普妥(阿托伐他汀钙片)在上市的当年即占据了新调脂药处方药20%的市场份额;从2004年起,连续多年销售额超过100亿美元;随着各种他汀类通用名药在世界各国陆续上市,这表明他汀类药物有强大的市场生命力。这份成功不只来源于前期各项研究的完 美结果,后期商业策略也很重要。
III期临床的时候华纳公司认识到自身在市场推广方面能力的不足,选择和辉瑞合作,以900亿美元价格被辉瑞收购。在辉瑞介入下,阿伐他汀连续多年保持了良好的销量。
为了更闪电般的占有市场,辉瑞在上市时还做了一个市场调研,发现竞争对手疏忽了一个该药物的卖点:医生推荐的处方是高剂量他汀,一般都在20-40mg之间,这个发现使辉瑞向FDA申请立普妥低起始剂量。立普妥在上市前,临床研究已经发现10mg的剂量就有降脂疗效,于是FDA批准了立普妥10-80mg的剂量范围。这一点是非常明智的,医生们在批文上看到立普妥最高剂量可以用到80mg,那么10mg无疑是安全的,这解决了医生一直以来对他汀安全性的顾虑。
当时辉瑞的市场部还调整了定价策略,通过市场分析,以及对医生和医疗机构的调研,使得立普妥的定价比默沙东的辛伐他汀低了近一半。立普妥具有降脂效果更好、价格更亲民、更易被消费者接受等优点。同时辉瑞加强对一线医药代表的培训,使他们可以准确把握患者以及医生等人群的市场。立普妥的销售团队带着样品,多次拜访心血管医生和家庭医生,并且抓住立普妥小剂量药效等同于竞争药品高剂量药效这一优点,让医生解除了对立普妥安全性的顾虑。
综上,在完善的专利布局和杰出的商业策略的支持下,世界一代畅销名药阿托伐他汀的成功推动了血脂下调及其他多种适应症的巨大发展。当然,现在原研药专利期满,也促进着药物降价和国内研究的迅速发展,推动着市场的长足跨越。
致谢
感谢吴兴新老师的《新药研发策略》课堂,带给我们关于新药研发的知识及业内人士的观点!感谢我们的指导老师王盛兰学姐为我们提供的指导及资料!也感谢“药渡”平台为我们提供了展现的舞台!
关于笔者
寻药真理团
他们是南京大学新药研发策略课程的学生,本篇为该课程中新药3组学生成员共同完成。
他们朝气蓬勃、他们斗志昂扬,他们脚踏实地学习新药研发知识,他们坚信吾爱吾师吾更爱真理。
他们是新一代医药行业接班人,他们是新药研发领域的未来之光!
*本文仅为学术内容交流,不构成任何用药建议!
参考文献
[1]刘浩.世界一代畅销名药阿托伐他汀的开发应用进展[J].黑龙江医药,2015,28(03):491-495.
[2]Peter J. Mullen,Rosemary Yu,Joseph Longo,Michael C. Archer,Linda Z. Penn. The interplay between cell signalling and the mevalonate pathway in cancer[J]. Nature Reviews Cancer,2016,16(Suppl.):
[3]Peter J. Mullen,Rosemary Yu,Joseph Longo,Michael C. Archer,Linda Z. Penn. The interplay between cell signalling and the mevalonate pathway in cancer[J]. Nature Reviews Cancer,2016,16(Suppl.):
[4]卞志家,严华,朱宁,何瑜.立普妥专利保护状况分析[J].乐山师范学院学报,2012,27(12):97-100.
[5]鱼招波.辉瑞“活法”[N]. BENCHMARKS,2015,11:55-57.
[6] 王进. 立普妥重磅之因[N]. 医药经济报,2013,9:1-4.
[7] 傅书勇. 全国集采报价策略市场博弈中的价格均衡 [N]. 医药经济报,2019,9:1-3.
[8] 刘姹. 谁执牛耳:14 个国内销售超二十亿畅销药[N]. 医药经济报,2016,4:1-4.
[9]Istvan, E. S. and J. Deisenhofer (2001). "Structural Mechanism for Statin Inhibition of HMG-CoA Reductase." Science 292(5519): 1160-1164.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57