01
流感与奥司他韦
流感,全称是流行性感冒。是由甲乙丙三型流感病毒分别引发的一种急性呼吸道疾病。流感病毒是RNA病毒,根据其表面抗原命名为HxNy(其中x=1~15,y=1~9),其中H代表血球凝集素(Hemagglutinin),N代表神经氨酸酶(Hemagglutinin)。
奥司他韦正是神经氨酸酶的特异性抑制剂,其抑制成熟的流感病毒脱离宿主细胞,从而抑制流感病毒在人体内的传播以起到治疗流行性感冒的作用。奥司他韦是基于结构的合理药物设计的成功案例。奥司他韦的研发过程中大量应用了计算机辅助药物设计的手段,根据靶酶的三维结构有针对性地设计了高效低毒专一性强的神经氨酸酶抑制剂。
奥司他韦是在扎那米韦的基础上,根据神经氨酸酶天然底物的分子结构,以及神经氨酸酶催化中心的空间结构进行合理药物设计所获得的。奥司他韦于1996年首次合成,1998年2月26日获得美国专利,1999年10月首次在瑞典推出,随后进入加拿大、欧盟和美国市场,2002年获准在中国推出。
02
奥司他韦的药理机制与设计过程
流感病毒作为一种RNA病毒,具有容易发生突变的特点,但为了其特定功能的行使,一定存在某些不太容易发生突变的片段,即高度保守序列。而奥司他韦的作用位点,正是神经氨酸酶中的部分高度保守的氨基酸序列,作为神经氨酸酶的底物唾液酸的类似物,与其结合,阻止其水解成熟病毒与宿主细胞间凝血酶-唾液酸的连接,从而阻止病毒的扩散复制。
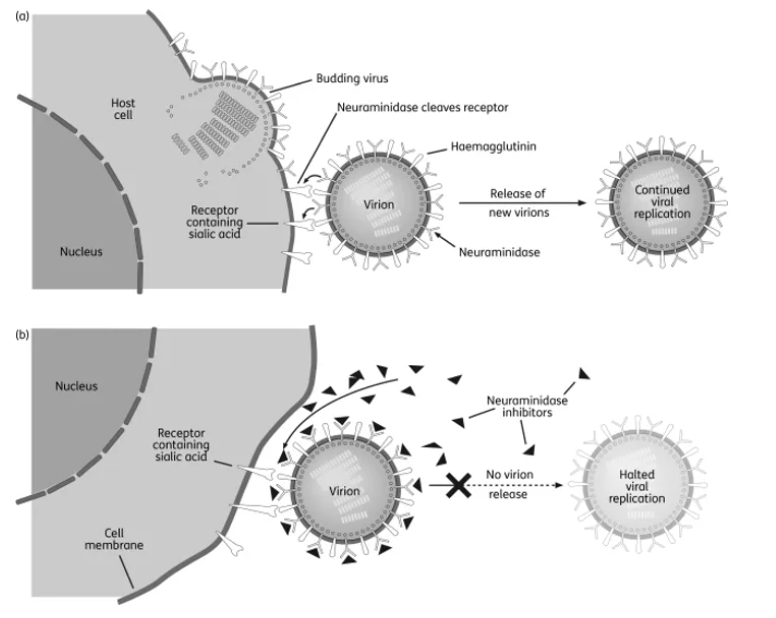
图1. 病毒复制过程与神经氨酸酶抑制剂作用机理(Davies BE,J Antimicrob Chemother,2010)
为了得到神经氨酸酶的有效抑制剂,设计初期模拟唾液酸过渡态中间体的离子构型,构建的化合物却面临体外有抑制神经氨酸酶活性但动物模型上无活性且对流感病毒无选择性的问题,这是因为一些基团的介入使得吸收困难,且不仅流感病毒,其他病毒、细菌乃至人肝微粒体中都含有神经氨酸酶,因此仍需进一步优化。
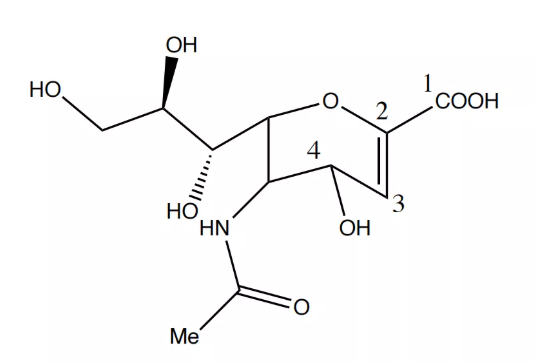
图2. 唾液酸过渡态中间体离子构型
研发人员通过电子等排的原理将过渡态中间体转化为了一类碳环化合物,易于结构修饰并减少了碳环双键上的电子云密度,其次用氨基取代了4号位上羟基增强了配体与神经氨酸酶的亲和性。为了进一步的优化,且便于设计口服药物,将丙三醇侧链取代为能够发生广泛疏水作用的2-乙基丙基,进一步增强了药物的抑制活性。最后,采取了原药酯化的方法,将2号位羧基酯化,便于口服吸收,便得到了我们所熟知的奥司他韦。
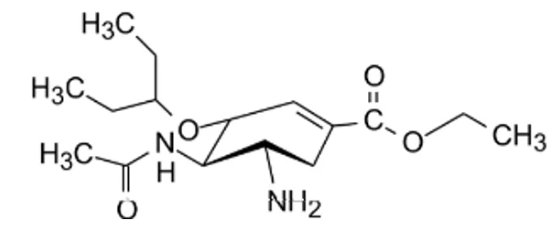
图3. 奥司他韦结构式
03
奥司他韦的合成
奥司他韦磷酸盐是第一种口服有效的流感病毒神经氨酸酶抑制剂,临床上主要用于减轻流感发病时的症状。目前主要是以莽草酸和奎宁酸为原料来合成奥司他韦。奎宁酸从金鸡纳树皮中提取得到,金鸡纳树适宜生长于温暖、终年无霜的气候环境中,要求年平均温度为21℃,平均最低温度为13.5℃,当温度低至1~2℃时受到明显冻害,低于0℃时其地上部分被冻死。因为对气候环境的严苛要求,金鸡纳树分布范围较窄且数量有限,也就导致了奎宁酸原料供应的不稳定。在由奎宁酸合成奥司他韦的过程中还涉及有毒的叠氮化物。因此,来源于香料八角的莽草酸理论上是更好的选择。下图为从莽草酸到磷酸奥司他韦的合成路径:
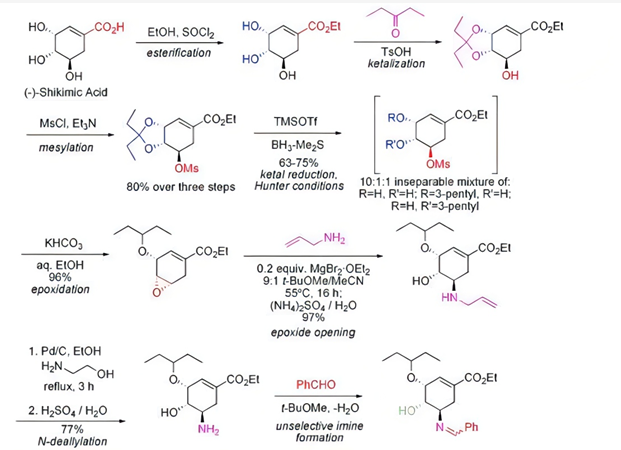
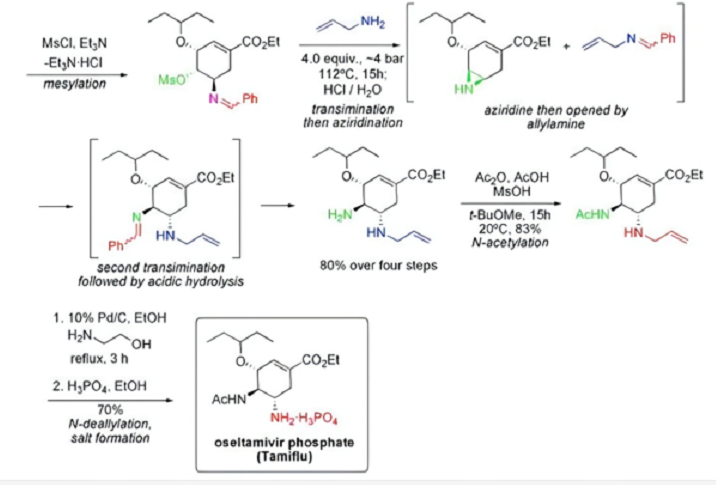
图4. 磷酸奥司他韦合成途径
04
ADME
奥司他韦的活性代谢产物的药代动力学曲线与剂量呈线性相关。研究中,血浆和尿液样品中的奥司他韦及其活性代谢物是采用灵敏的液相色谱或串联质谱法测定的。
1 吸收 Absorption
口服给药后,磷酸奥司他韦在胃肠道被迅速吸收,经肝 脏和肠壁酯酶迅速转化为活性代谢产物奥司他韦羧酸盐(别称Ro 64-0802)。口服奥司他韦产生的活性代谢物的绝 对生物利用度为80%。口服30min后,血浆中即可检测到活性代谢物且其浓度在3~4h后达到最 大浓度。相对于活性代谢物,少于5%的药物以药物前体的形式存在。与静脉注射给药相比,口服奥司他韦后活性代谢产物在血浆中能存留更长时间。除半衰期差异外,静脉给药与口服给药的药代动力学无明显差别。进食或在改变胃中pH的条件下给药均不会影响奥司他韦的生物利用度。
活性代谢产物的血浆浓度与奥司他韦服用剂量成正比,并仅表现出小程度的个体间变异。
2 分布 Distribution
对白鼬、大鼠和兔的研究显示,药物的活性代谢产物可以到达所有流感病毒感染的部位。研究显示,口服磷酸奥司他韦后其活性代谢产物在肺、支气管、肺泡灌洗液、鼻粘膜、中耳和气管中均可达到抗病毒的有效浓度水平。
3 代谢 Metabolism
对大多数人而言,活性代谢产物在积累到血浆峰浓度后会以6~10h的半衰期下降。除了通过肝 脏或肠道酯酶广泛转化为Ro 64-0802,在人类中未发现奥司他韦的其他代谢物。体外研究表明,磷酸奥司他韦或其活性代谢产物都不是细胞色素P450同工酶的底物或抑制剂;奥司他韦及其活性代谢物均不与人细胞色素P450混合功能氧化酶或葡萄糖醛酸转移酶相互作用。
4 清除 Elimination
奥司他韦主要通过转化为活性代谢产物并通过肾 脏排泄来清除(>90%)。大约60~70%的口服剂量在尿液中表现为活性代谢产物形式,小于5%以奥司他韦形式存在。肾 脏对奥司他韦及其活性代谢产物的清除率均超过了肾小球滤过率,表明除了肾小球滤过外,奥司他韦还依赖于肾小管分泌的阴离子转运途径被清除。口服奥司他韦后检测粪便发现其中的残留药物不到初始给药剂量的20%,其中50%为奥司他韦,50%为其活性代谢物。
5 不良反应
最常见:胃肠道不良反应,如恶心、呕吐、消化不良、腹痛等,发生率为 6%-15%,大多症状较轻,停药后即可消失。根据奥司他韦药动学特点,食物对于该药的吸收没有影响,但是奥司他韦和食物一起服用或可以降低胃肠道不适,提高耐受性,因此建议随餐服用。
少数:可能发生过敏反应,表现为皮疹。
个别病例:可能有头晕、头痛、幻觉、行为异常、嗜睡、焦虑等症状,严重者可发展为抑郁甚至自杀。
6 补充
半衰期(half-life,T1/2)指体内药量(或血药浓度)吸收、分布和消除一半所需时间,称吸收半衰期(T1/2ka)、分布半衰期(T1/2α,二房室模型)和消除半衰期(T1/2ke,一房室模型)、(T1/2β,二房室模型)或(T1/2λ,非房室模型)。此处半衰期指的是消除半衰期T1/2β。
细胞色素P-450混合功能氧化酶能与分子氧形成“活性氧”复合体,氧化进人肝、肺的外源性化学物质。人体内代谢药物的主要酶是细胞色素P450超家族(Cytochrome P450 proteins, CYP),它们是一类主要存在于肝 脏、肠道中的单加氧酶,多位于细胞内质网上,催化多种内、外源物质的(包括大多数临床药物)代谢,所产生的代谢产物可能有**。P450酶能通过其结构中的血红素中的铁离子传递电子,氧化异源物,增强异源物质的水溶性,使它们更易排出体外。
05
专利和市场
奥司他韦于最早由吉利德科技公司首次研制成功。1995年,相关体外实验已经确定了药物有效安全,可以申请人体临床试验了。但耗资高达几个亿美元的临床试验对当时的吉利德公司来说是个天文数字,这时必须寻找合作伙伴了。1996年1月,吉利德公司开始就转让使用权和多家大药企谈判,罗氏成了最 佳选择。同年9月30日,吉利德和罗氏达成协议,将GS4104的生产和销售权转让给罗氏,罗氏付给吉利德1千万美元继续试验,如果临床试验顺利,罗氏再付4千万美元,正式上市后,罗氏也会分一部分销售利润给吉利德。
奥司他韦化合物的专利是吉利德公司于1996年12月27日向美国专利商标局提交并于1998年6月9日批准获得专利权的,后随即转让给罗氏制药公司。到了2005年下半年,禽流感又有全球蔓延的趋势。WHO也发出了警告,罗氏公司向WHO药品储备库捐赠了300万盒达菲,但是由于全球销量激增,仍然有很多组织和个人指责罗氏垄断专利。在这种情况下,虽然专利仍未到期,罗氏公司也最终决定授予部分国家和地区自行生产权。
在2010年11月15日,印度仿制药公司Natco(就是电影我不是药神里面生产格列宁的原型)就提交了第一个PIV挑战。经过复杂的专利之争,原研药公司与仿制药公司达成和解。2016年8月3日,FDA批准了来自Natco的第一个磷酸奥司他韦仿制药,该仿制产品也获得了180天的市场独占期。磷酸奥司他韦的首仿地位值得艳羡,但仿制的路,并不平坦:从Natco最早对达菲的专利发起挑战,到仿制产品最终获批上市,仿制药公司与原研药公司之间的专利纠葛持续了整整6年。要知道,磷酸奥司他韦从化合物筛选到产品上市总共不过用了7年,而仿制药公司用了6年的时间获得一个首仿品种,从这个角度来看,成功仿制一个优秀产品,也并不是个简单的事情。到2019年,FDA批准了11家磷酸奥司他韦仿制药生产商,中国上海医药和东阳光也相继获得了生产授权。此后,两家药企分别以商品名奥尔菲和可威上市销售,实现了奥司他韦的国产化。
严格意义上讲,葛兰素史克公司的扎那米韦才是神经氨酸酶抑制剂的First-in-Class,但市场表现方面,磷酸奥司他韦远比扎那米韦表现的强劲。从时间来看,两个药物在1999年几乎同时上市,但市场表现却有着天壤之别。其中最 大的原因在于给药方式的差异。而这一点,从根本上又源于科学家不同的新药设计思维。扎那米韦的理化性质决定该药并不适合口服给药,为解决该问题,GSK的科学家们计划将该药开发成粉雾吸入剂。他们认为:一方面,吸入剂可以提高药物生物利用度,直接解决口服给药生物利用度不高的问题;另一方面,流感本身属于呼吸系统传染性疾病,而吸入给药可直接作用于呼吸系统。
对于磷酸奥司他韦,当时一开始也面临着同样的问题,但吉利德科学家们的思维与葛兰素史克的截然不同:首先,在给药方式方面,他们认为流感患者往往存在呼吸困难的症状,面对吸入和口服两种给药方式,患者可能更倾向后者。因此,为解决口服生物利用度问题,吉利德采用了前药技术,对原有化合物进行酯化得到磷酸奥司他韦。后来的事实证明,口服给药更容易被患者接受。
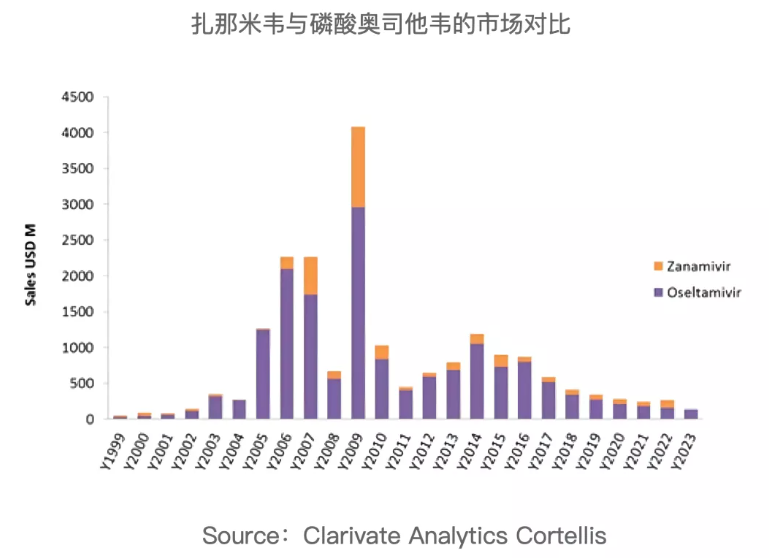
再看国内市场。就奥司他韦目前的品牌市场格局来看,近几年来罗氏的市场份额直线下滑,上海医药的销售额占比一直不超过10%,宜昌东阳光药通过加大品牌推广,终端下沉,占据了该品种绝大多数的市场份额。可以看出东阳光“可威”的市场运作可谓是非常成功,市场优势的取得主要依赖以下几点:
1 扩大用药人群
奥司他韦原本只有75mg的胶囊剂,东阳光药基于自身研发实力,推出“可威”颗粒剂,主打儿童用药市场。随之近几年“二胎政策”放开及儿童专用药的短缺,“可威”颗粒剂抓住市场机遇,快速做大。随着家长对儿童支付意愿的提升,“可威”儿童市场前景可期。
2 增强市场替代性
奥司他韦原本主要是针对大规模爆发性流感及重症流感,现在由于奥司他韦的安全性,有效性和经济性,在各项指南中,已被推荐为流感的一线用药,同时,加强医生和患者教育,将奥司他韦由一款重大流感疫情爆发的应急用药逐渐转变为流感预防、治疗药物,逐步替代传统的金刚烷和金刚乙胺。随着临床用药范围扩大、用药人群增加,市场替代效应的发挥,流感抗病毒用药市场已达80%以上。
3 自建销售团队
相比东阳光,罗氏和上海医药并未对该品种药物给予足够的重视。由于抗流感病毒 药物不属于罗氏的主要战略发展方向,因此罗氏并未投入太多的资源用于达菲在中国的推广;而上海医药品种多、产品线复杂,因此奥尔菲的销售额始终较为低迷,且慢慢已开始退出市场。基于此,东阳光大力投入“可威”的临床推广,过去可威的销售主要以招商代理为主,2012年之后东阳光开始自建学术团队,加强医生和患者的用药教育。凭借着自身销售团队,将“可威”打造成为公司的主力产品。
4 价格优势显著
从奥司他韦的中标数据可以看出,“可威”的中标价仅为“达菲”的60%,与“奥尔菲”中标价接近,而随着“奥尔菲”逐步放弃市场,“可威”凭着价格优势,与“达菲”的价格竞争优势显著。综上所述,东阳光可威的竞争优势比较明显。
奥司他韦从1992年吉利德公司成立研发小组到1999年成功批准上市,研发历程仅仅用了短短七年,这在近代新药研发历史上是非常罕见的,成为合理药物设计的经典案例。这也带给了我们很多启发:
首先是研究药物项目选择方面,在找到一个突破口后,应果断开展研究,并高效合理地使用科研经费,特别是在我国创新药物研究经费投入相对不足的情况下。其次奥司他韦的例子告诉我们, me-too、me-better药物也是研发新药的有效途径之一。然后是在科技迅速发展的今天,药物研发人员应该学会利用各种资源,特别是结构生物学和计算机辅助药物设计技术,这样既可以很好地节约科研成本,又能够提高研发效率。最后是在药物设计过程中,不仅要考虑化合物的活性,也应该注意药物顺从性,从患者的角度去考虑问题,这将决定药物的市场竞争力。
致谢
感谢吴兴新老师和徐忆竹学姐为本篇推文撰写所提供的帮助和指导。
关于笔者
寻药真理团
他们是南京大学新药研发策略课程的学生,本篇为该课程中新药5组学生成员李雨婷、羊函昱、曾妍、张笛雅和刘强共同完成。
他们朝气蓬勃、他们斗志昂扬,他们脚踏实地学习新药研发知识,他们坚信吾爱吾师吾更爱真理。
他们是新一代医药行业接班人,他们是新药研发领域的未来之光!
*本文仅为学术内容交流,不构成任何用药建议!
参考文献
[1] He G,Massarella J,Ward P. Clinical pharmacokinetics of the prodrug oseltamivir and its active metabolite Ro 64-0802.[J]. Clinical pharmacokinetics,1999,37(6).
[2] 袁兵,李润峰,杨春光,张晟,张云辉,角建林,张荣平,夏雪山,杨子峰.奥司他韦在树鼩体内的药动及药效学应用研究[J].中国比较医学杂志,2019,29(02):7-13.
[3] Davies BE. Pharmacokinetics of oseltamivir: an oral antiviral for the treatment and prophylaxis of influenza in diverse populations. J Antimicrob Chemother. 2010;65 Suppl 2(Suppl 2):ii5-ii10. doi:10.1093/jacq015.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57