FXR(法尼醇X受体)是近几年来非酒精性脂肪性肝病(NAFLD)研究的一个热门靶点。FXR是核受体超家族的成员之一,该受体于1995年由Forman等发现,因其转录活性可被法尼醇及其代谢物增强而命名,后研究发现胆汁酸是FXR的内源性配体,因此FXR又称胆汁酸受体。
FXR在哺乳动物中有两个成员:FXRα和FXRβ。FXRβ在人类和灵长类动物中是一种假基因,但在其他物种中编码一种功能性受体。FXRα基因编码四种亚型:FXRα1-α4,这四种亚型以组织依赖的方式表达。FXR与配体结合后可以与视黄醛衍生物X受体(retinoid X receptor, RXR)形成二聚体,进而调控靶基因的转录。FXR靶基因包括多个胆汁酸代谢/转运相关基因、脂质代谢相关基因和糖代谢相关基因等。因此FXR参与维持上述内源活性物质的稳态并参与多个病理过程,具有广泛的生物活性。[1]
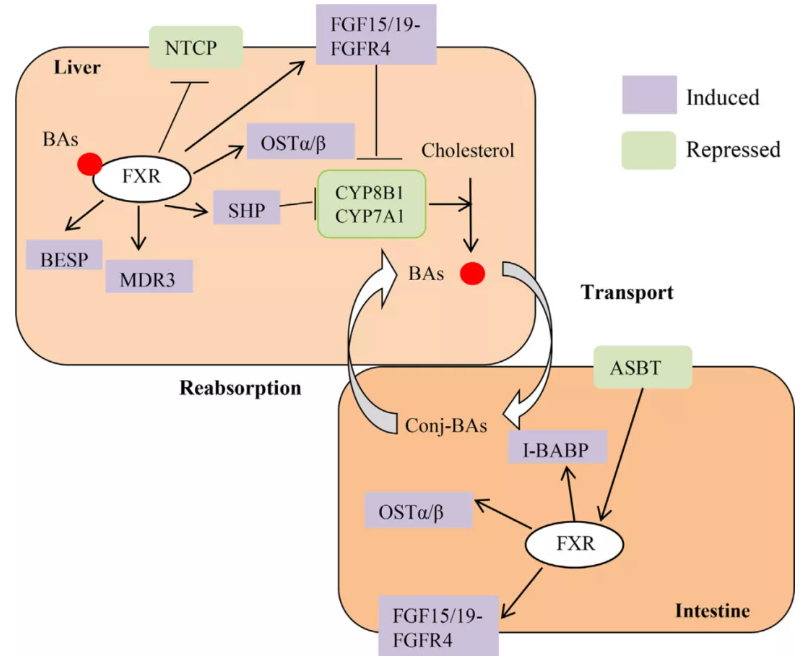
图1. FXR在胆汁酸肠肝循环中的重要性
1
FXR的作用
1 负调控胆汁酸合成
FXR被激活后,诱导小异源二聚体伴侣(SHP)基因的表达,导致限速酶胆固醇7α单加氧酶(CYP7A1)和肝 脏受体同源物1 (LRH-1)的转录抑制。FXR还能通过刺激成纤维细胞生长因子19 (FGF-19)的合成来抑制CYP7A1和固醇12α-羟化酶(CYP8B1)的表达,FXR/SHP和FXR/FGF19/FGFR4通路是胆汁酸合成的主要负调控路径。[3](图1)
2 调控胆汁酸外排
FXR通过SHP依赖机制抑制牛磺胆酸钠共转运多肽(NTCP),从而抑制肝 脏对胆汁酸的摄取,这是FXR对胆汁酸重吸收的负调控。FXR可上调胆盐输出泵(bile salt export pump, BSEP)和多药耐药蛋白3 (multidrug resistance protein-3, MDR3)基因的表达,增加BA从肝 脏向小管腔的外排;FXR还能增加有机溶质转运体α / β (OSTα/β)的表达,从而增强BA从肝 脏向门静脉的外排。上述转运体(BSEP、MDR3、OSTα/β)均受 FXR正调控。[3]此外肝细胞基底侧膜上的MRP4也参与胆汁酸外排,该转运体受FXR负调控。综上所述,FXR激活和抑制均可通过诱导不同的转运体表达影响胆汁酸外排,而对肝 脏中胆汁酸浓度的最终影响取决于对各个转运体调控作用的"净效应" 。[4]
3 FXR调控脂代谢
与野生型小鼠相比,FXR-/-小鼠表现为血浆和肝 脏中胆固醇和甘油三酯( triglyceride, TG) 水平升高,后续研究发现FXR对胆固醇和TG的代谢、转运均具有调控作用。肝肠 FXR均参与TG代谢。肝 脏FXR转录激活及肠道FXR转录抑制均可以抑制TG合成,降低肝 脏TG 水平。
4 FXR调控糖代谢
FXR可以调控肝 脏糖酵解、糖原合成、糖异生及胰岛素敏感性。且机体不同组织部位的FXR的作用各异。FXR-/-小鼠表现为外周高血糖、糖耐量受损以及胰岛素抵抗。肝 脏过表达或转录激活FXR后,可以显著降低血糖水平。然而肠道FXR表达缺失或者转录抑制可以降低血糖水平。
2
FXR的研究进展及不良反应
迄今为止FXR激动剂的研究较为成熟。多个FXR激动剂已进入临床研究阶段,用于治疗多种肝病,包括原发性胆汁性肝硬化和非酒精性脂肪肝疾病( NAFLD)和非酒精性脂肪性肝炎( NASH)。2016年5月奥贝胆酸被FDA正式批准用于临床治疗对熊去氧胆酸(UDCA)无反应或不耐受的原发性胆汁性胆管炎(PBC),但其副作用——如严重的瘙痒症状却限制了它在临床上的应用。另外,较高剂量奥贝胆酸导致晚期肝病患者和肝硬化患者出现肝功能恶化,FDA 于2018年初发出“黑框警告”。
FXR激动剂产生副作用的可能原因:目前有报道称奥贝胆酸导致鼠类模型急性肝损伤的机制可能是通过FXR通路产生,这些副作用被认为是全FXR激动剂的药理给药导致的。由于核受体参与多种内分泌功能,FXR的调节容易引起FXR配体将信号改变转化为基因表达的改变,从而引起参与胆汁酸、葡萄糖和脂质代谢的多种基因改变所致的副作用。
奥贝胆酸的临床试验已经表明,广泛的FXR激活破坏了胆固醇的稳态,FXR的激活通过SHP /FGF19的上调和胆固醇7α-羟化酶( CYP7A1) 的下调阻止了胆固醇向BAs的代谢转化。由于该途径是胆固醇代谢的主要途径,其长期的药理阻断可能会产生严重后果。靶向激活肝细胞的FXR受体,而不激活促炎细胞的FXR受体,可能是安全利用FXR作为药物靶点的最 佳途径。其次,可以联合使用FXR拮抗剂保护促炎细胞的 FXR受体,因为这样可以减少相关的副作用。
所以,为了探索这些新策略,在分子水平上更深入地探索FXR的靶向激活是必要的。目前,小剂量奥贝胆酸不完全激活FXR是可行的临床方案,显著减少了副作用的发生。[5]
但是FXR拮抗剂的研究相对滞后,有关 FXR拮抗剂的体内体外活性相对较少,但随着对FXR生物功能认识的加深,尤其是 FXR转录抑制对脂肪肝的良好作用以及OCA等FXR激动剂的不良反应的发现,目前有关FXR拮抗剂的研究逐渐增多。
根据药渡数据库,截止时间2021年12月31日,列出了表1目前临床在研的FXR抑制剂和拮抗剂(未包含复方)的临床进展和几个代表性的临床前药物。除了已经上市的奥贝胆酸(PBC获批,NASH被拒),吉利德的Cilofexor(GS9674)是目前临床进展最快的FXR激动剂,其中原发性硬化性胆管炎,非酒精性脂肪性肝炎等适应症处于临床三期,GS9674是由第一种非甾体强效激动剂GW4064改造而来的激动剂。
目前只有一款FXR拮抗剂进入临床,是由上海医工院和江苏柯菲平联合开发的SIPI-7623,目前处于临床一期,适应症为混合型高血脂。另外,上海药物所开发的FXR拮抗剂HS218处于临床前,适应症为II型糖尿病。歌礼制药开发的ASC43F是THR-β/FXR激动剂,适应症为非酒精性脂肪性肝炎,目前处于临床一期。歌礼制药还开发了一款FAS/FXR激动剂(FAS抑制剂),适应症为非酒精性脂肪性肝炎,目前处于临床前。Intercept Pharmaceuticals开发的INT-767是FXR/TGR5双激动剂,适应症为非酒精性脂肪性肝炎,目前处于临床一期。这几类双靶点FXR激动剂的设计可能是为了降低FXR全激动剂带来的瘙痒等副作用。 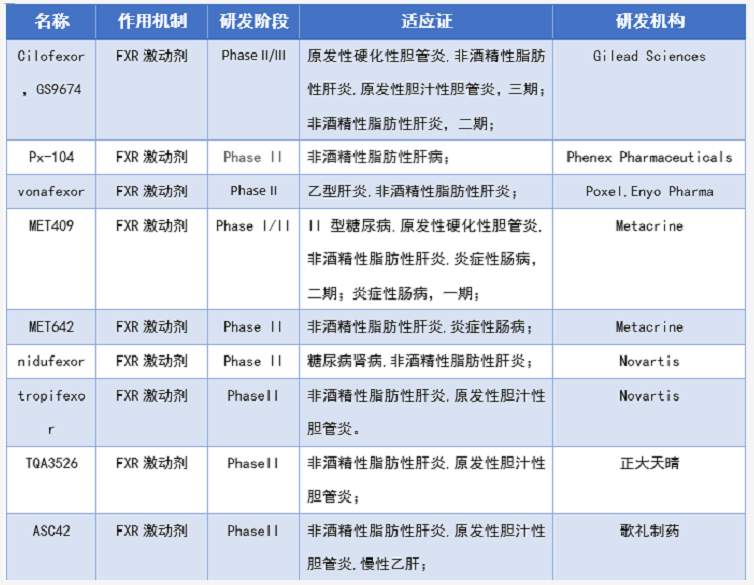
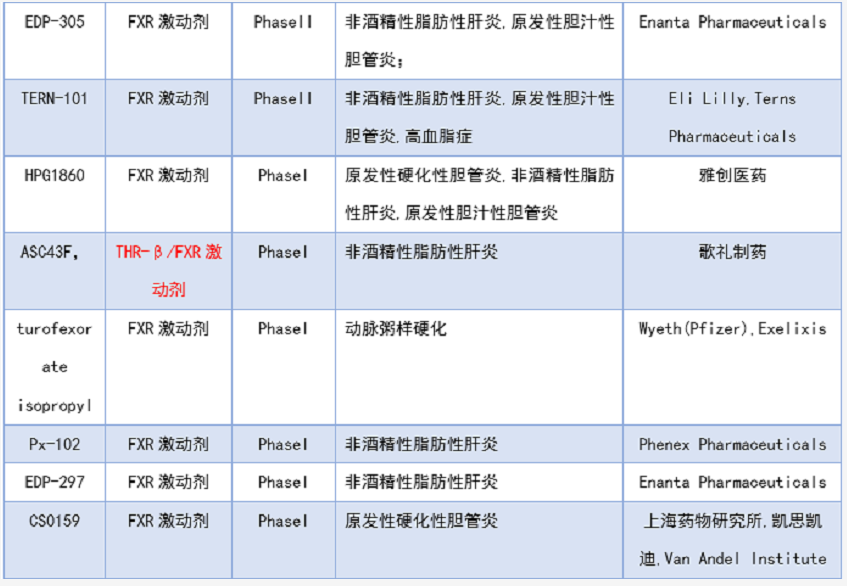
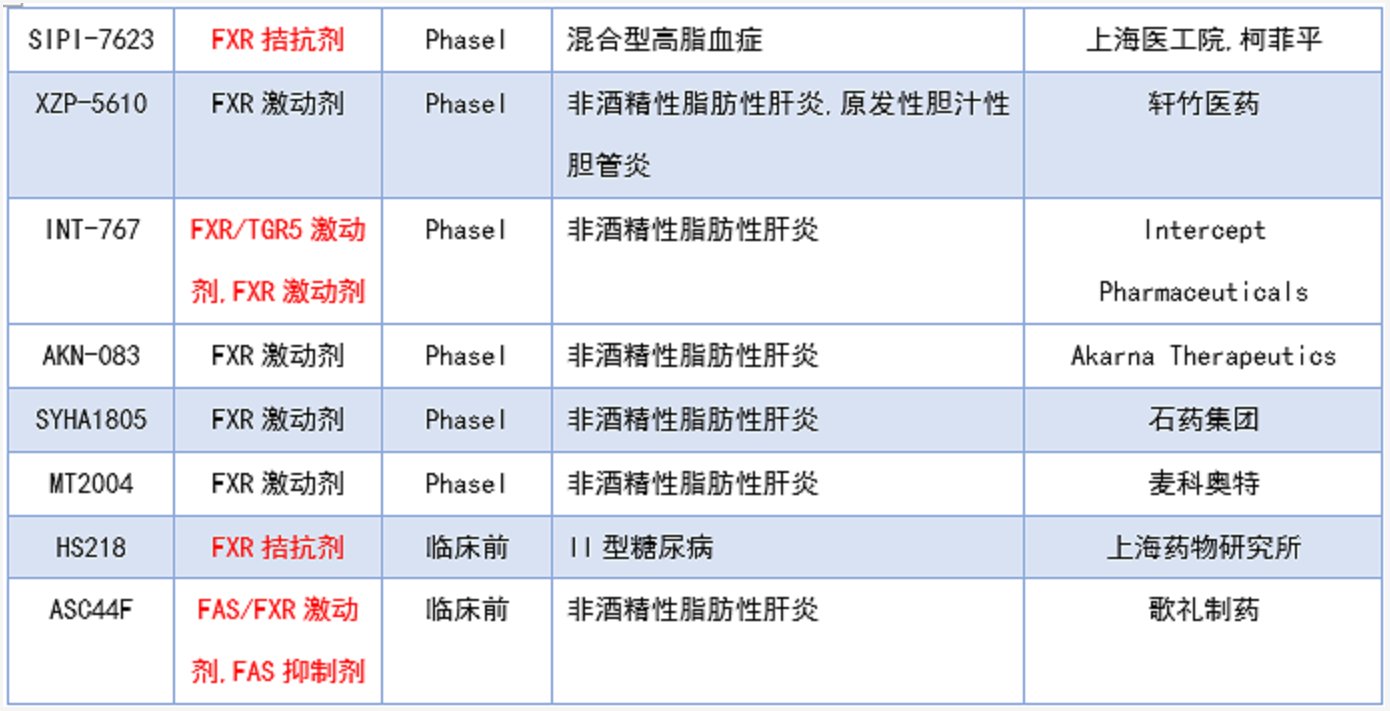
表1. 临床在研FXR抑制剂/拮抗剂[9]
3
FXR的结构
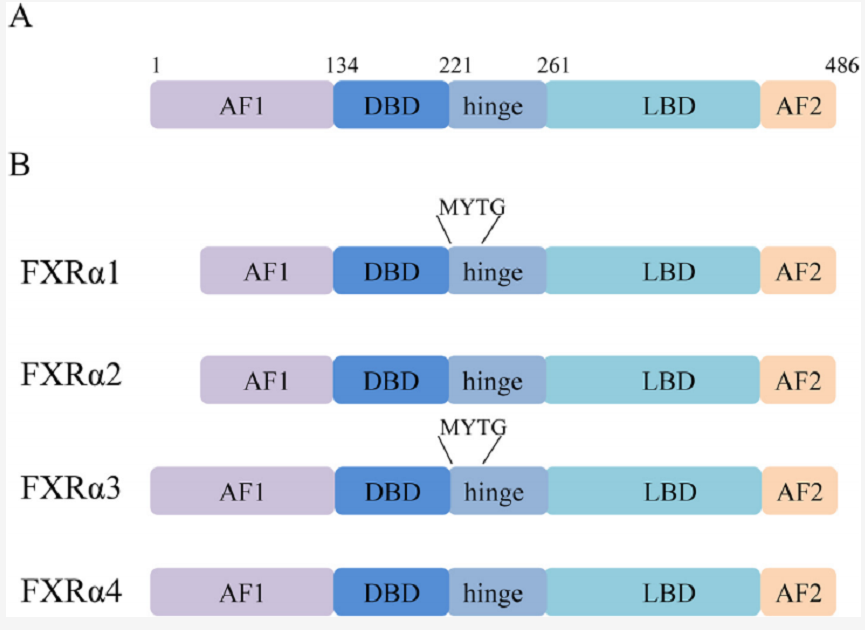
图2. FXR简图及四种FXRα蛋白异构体示意图
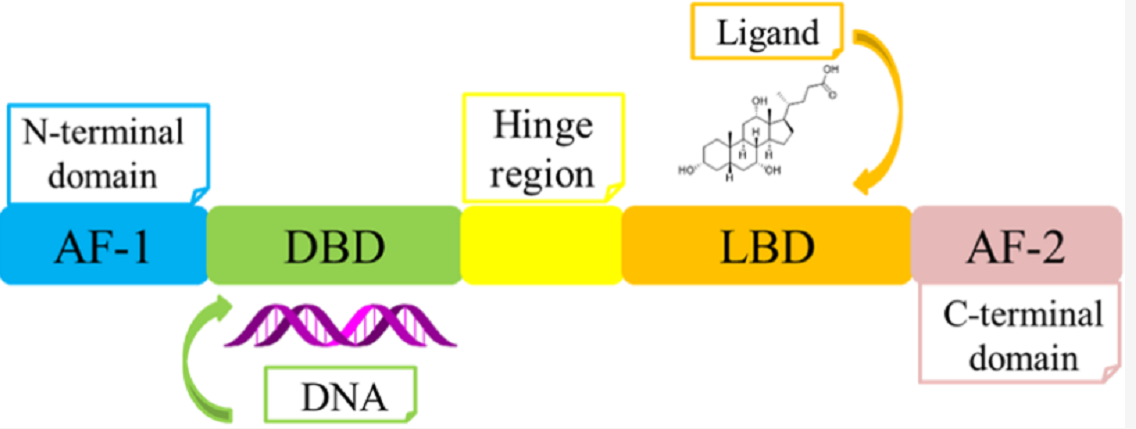
图3. FXR-DBD的模型结构和FXR-LBD/OCA配合物
FXR都具有一个经典的核受体(NR)组织(图2A),一个与配体无关的转录激活域(AF1),核心DNA结合域(DBD),铰链区,C末端配体结合域(LBD)和配体依赖激活功能域(AF2)。AF1结构域是一个高度无序的结构域,可与调控蛋白协同作用。选择性剪切导致了多种AF1域异构体的产生。与FXRα1和FXRα2相比,FXRα3和FXRα4有一个扩展的N端(图2B)。FXR-DBD与DNA建立碱基特异性的相互作用,使特异性DNA序列的识别成为可能。DBD区域高度保守,包含两个α螺旋(H1和H2)和两个四半胱氨酸/锌核模块(图3)。铰链域是一类短而灵活的linker,具有较少的序列和保守尺寸。FXRα1和FXRα3在这个区域各有一个插入的4个氨基酸(MYTG)(图2B);FXR-LBD与它的配体如奥贝胆酸结合并与辅调节蛋白相互作用。
这个结构域由12个α螺旋组成,折叠成三个平行的层,形成一个α螺旋三明治,并在受体的底部包含一个疏水的配体结合口袋(LBP),以容纳它的配体。AF2在LBD中,包括H12。与其他核受体相似,FXR的H12在与不同配体结合时发生动态构象变化,AF2取向的改变促进了与不同调控蛋白的相互作用。[3]
4
几种肝 脏相关疾病
NAFLD(非酒精性脂肪性肝病)是指在没有过度饮酒或其他可归因的情况下,肝 脏内的脂质异位积聚,包括以炎症和纤维化为特征的疾病的更高级形式(非酒精性脂肪肝(NASH))。非酒精性脂肪肝可能影响占世界人口的20-40%,可发展为晚期纤维化、肝硬化和肝细胞癌。
FXR激动剂通过纠正中间代谢和脂质积累的异常,抑制代谢应激诱导的p53激活,抑制纤维化的进展和减轻炎症,具有治疗肝病的潜力。FXR调节BA稳态,这在生理上对消除胆固醇和激素调节很重要,因此,FXR激动剂和拮抗剂对于原发性胆道胆管炎(PBC)和原发性硬化性胆管炎(PSC)的治疗都具有重要的治疗价值。[2](图4)
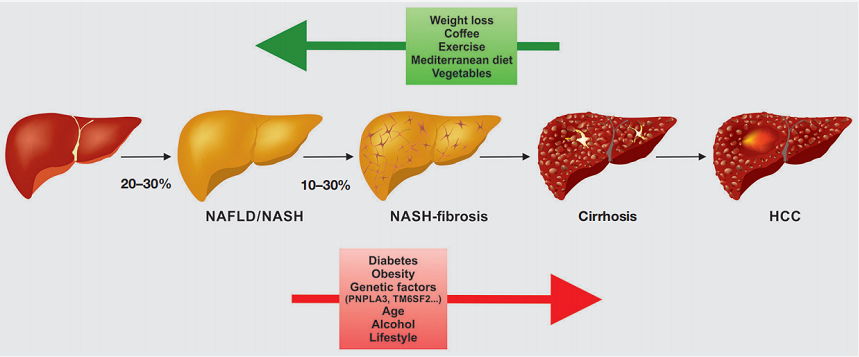
图4. 从正常肝 脏到NAFLD、NASH、肝硬化和HCC的临床情况[2]
5
FXR激动剂的改造策略
代表性的FXR激动剂有以下几种:obeticholic acid (OCA)、 cilofexor (GS-9674)、TERN-101 (LY2562175)、nidufexor (LMB763)、tropifexor (LNJ-452)、EDP-305,目前正处于NASH、PBC、PSC和肝纤维化的临床试验中(表1,图5)。但是由于副作用,许多化合物已在临床前或临床试验中停止,包括高密度和低密度脂蛋白浓度的血脂异常效应,瘙痒以及肝硬化PBC患者肝 脏失代偿风险增加。FXR激动剂通过调节反向胆固醇运输降低HDL浓度,在临床前模型中不会加剧动脉粥样硬化。
然而,瘙痒和肝 脏失代偿的机制尚不清楚,这是FXR激动剂发展的一个重要障碍。这些严重的、剂量限制性**推迟了FXR激动剂作为治疗药物的批准和广泛使用,这可能是由于FXR的全激动作用,而不是脱靶效应。因此,设计有效但不引起不良反应的FXR激动剂对药物化学家来说仍然是一个挑战。[1]
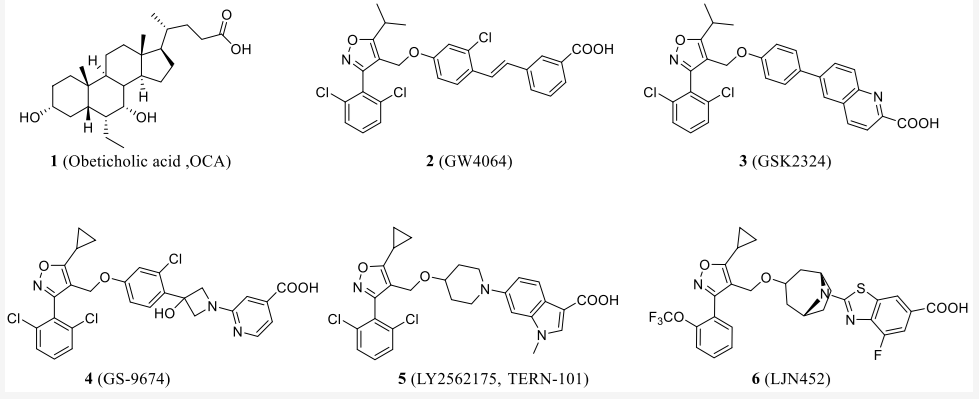
图5. 列举的FXR受体激动剂的结构[7]
根据其化学结构,FXR激动剂分为甾体类和非甾体类。大多数类固醇类BA的候选药物都有不良的副作用。因此,在第一种强效激动剂GW4064被发现后,学术界和制药公司更专注于开发非甾体激动剂。在GW4064基础上设计的GS-9674、LY2562175、LMB763、LNJ-452等分子已进入临床试验阶段。虽然是二十年前发现的分子,GW4064仍然是FXR激动剂药物发现中的主要先导化合物,图6列出了过去几年GW4064的主要结构修饰以及用来改善PK/PD特性的最重要片段。[1]
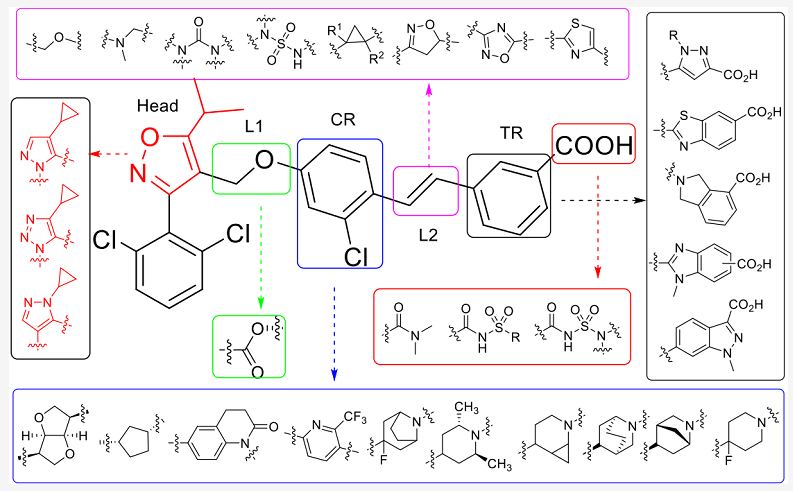
图6. 总结了GW4064的结构改动,以及用来替换其关键结构的重要的片段[1]
近年来随着对FXR研究的深入,人们对FXR在胆汁酸代谢中的调控作用越来越关注,FXR有望作为治疗胆汁酸代谢相关疾病的新型药物靶点。目前,在FXR的研究中仍存在以下问题:
其一,FXR在机体内有太多的靶基因,仍有部分与 FXR作用相关的靶基因尚待进一步被发现,同时FXR作用于一些靶基因的具体途径不清楚,需进一步研究;
其二,选择性地调控FXR部分靶基因的新型激动剂也有待于继续探讨和发现;
其三,参与胆汁酸调节的核受体除了FXR还有其它核受体如G蛋白偶联受体、孕烷 X受体、维生素D受体,在探讨胆汁酸代谢时还应考虑 FXR与其它核受体之间的作用。[8]
此外FXR激活和抑制均可通过调控胆汁酸转运体改善胆汁酸蓄积、通过调控糖脂代谢降低血脂血糖,最终改善代谢综合征。FXR激动剂或拮抗剂的最终药理活性取决于其对FXR众多靶基因的调控作用的“净效应”。尤其值得注意的是不同组织部位FXR的生物功能各异。如肝 脏FXR转录激活抑制糖异生,相反肠FXR转录抑制可以抑制糖异生,肝 脏 FXR转录激活抑制脂质合成,相反肠道FXR转录抑制可以抑制脂质合成。基于此组织部位特异性/限制性的FXR激动剂/拮抗剂更易取得良好的药理活性。尤其是肠道特异性FXR拮抗剂预期对糖尿病等代谢综合征取得更好的疗效。[4]
FXR与一些配体的复杂结构已被解析,并为理解FXR的激活或抑制提供了参考,这对相关疾病的治疗也具有重要的意义。
专栏作家
星星狐
药物化学背景,曾从事靶点调研、专利分析与突破、改良新药、创新药分子设计方面的工作;热爱医药行业,愿与各位同行互相学习、进步,见证创新药最好的时代。
参考文献:
1. Bahaa Elgendy et al; Recent Advances in the Medicinal Chemistry of Farnesoid X Receptor: https://doi.org/10.1021/acs.jmedchem.1c01017;
2. Ralf Weiskirchen et al;Non-alcoholic fatty liver disease (NAFLD)/non-alcoholic steatohepatitis (NASH)-related liver fibrosis: mechanisms, treatment and prevention;Ann Transl Med 2021;9(8):729.
3. Yongheng Chen et al ; Farnesoid X receptor (FXR): Structures and ligands; Computational and Structural Biotechnology Journal 19 (2021) 2148-2159.
4. 王 洪等;法尼醇 X 受体拮抗剂及药理活性研究进展;中国临床药理学与治疗学 2020 Jul;25(7)。
5. CHEN Li-xin et al; Efficacy and mechanisms of obeticholic acid in treatment of non-alcoholic fatty liver disease: pros and cons of bile acid drugs in non-alcoholic fatty liver disease; Chinese Journal of New Clinical Medicine,2021,14,(8),756-761.
6. Moritz Helmstadter et al; A New FXR Ligand Chemotype with Agonist/Antagonist Switch; ACS Med. Chem. Lett. 2021, 12, 267?274.
7. Yu Zhou et al; Discovery and Optimization of Non-bile Acid FXR Agonists as Preclinical Candidates for the Treatment of Nonalcoholic Steatohepatitis, J. Med. Chem. 2020, 63, 12748?12772。
8. Yujuan Shan et al; Advanced Progression in the Mechanism of Bile Acid Metabolism Targeting FXR; Hans Journal of Biomedicine , 2018, 8(4), 62-68.
9. 药渡数据库.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57