题接上篇《辉瑞新冠口服药Paxlovid国内紧急获批,利好CDMO供应商和国产口服药?》,最近随着利好政策的不断发布,医药行业持续回暖,尤其是新冠治疗药物概念表现突出。
为鼓励研究和创制新药,满足临床用药需求,及时总结转化抗疫应急审评工作经验,加快创新药品的审评速度,2022年2月22日药审中心(CDE)发布了《药审中心加快创新药上市申请审评工作程序(试行)》的征求意见稿(以下简称《征求意见稿》),受集采和《以临床价值为导向的抗肿瘤药物临床研发指导原则》等政策的打击,医药行业2021年进入寒冬,《征求意见稿》的发布成为《“十四五”医药工业发展规划》(简称《纲要》)发布之后医药行业在寒冬中迎来的又一道光,尤其是利好创新药,可以看出我国发展高端制剂尤其是创新产品的决心。
该《征求意见稿》适用于纳入突破性治疗药物程序的创新药,凸显了以临床价值为导向的新药研发方向。突破性治疗药物是指用于防治严重危及生命的或者严重影响生存质量的疾病,或,能够治疗尚无有效防治手段的疾病,或,与现有治疗手段相比,具有明显临床优势的药物和疗法。目前已有74个品种被纳入突破性治疗药物名单。为突破性治疗药物制定进一步的加快审评工作程序,可以加快有临床价值的创新药上市速度,鼓励药企尤其是创新药企在新药研发中更加注重以临床价值为导向的新药研发。
通过早期介入、研审联动,滚动提交、检查检验靠前的方式加快创新药的上市申请。
适用的研发阶段:适用于申请人在探索性临床试验完成后,已具备开展关键性临床试验条件至批准上市前。本程序无需申请人申请,纳入突破性治疗药物程序的创新药品种可自动按照本程序开展后续沟通交流及审评审批工作。
时限要求:沟通交流时限为30日,品种审评时限同优先审评品种时限为130日。
此次发布的加快创新药上市申请审评的工作程序结合过去提前介入、研审联动的工作思路进一步优化和完善了流程。
(1)优化和完善沟通过交流环节
在沟通交流环节,CDE审评团队在关键确证性临床试验开始前早期介入,申请人可滚动提交沟通交流资料,与审评团队进行充分沟通,会议申请时限按照 30 日管理。
(i)关键性临床试验相关沟通交流
在沟通交流时CDE就根据品种及利益冲突情况、部门适应症分组、审评任务特点及人员利益冲突情况,组建审评团队,审评团队负责该品种申报前沟通交流至受理后技术审评全过程,一般包含审评人员、合规审查人员、受理人员及项目管理人员,在这一阶段药审中心将持续与申请人对接和指导。同时,药审中心受理人员可提前介入,指导申请人按照要求整理申报资料,以保证品种全链条跟进和管理。
(ii)上市许可申请前(pre-NDA)沟通交流
申请人在提出药品上市许可申请前,可提出沟通交流申请,明确提出拟讨论的问题及相关支持性材料,提交符合注册申报资料格式和内容要求的研究资料。药审中心根据申请人提出的咨询问题安排审评团队进行沟通交流并就研究资料进行初步审评。药审中心可就目前申报资料存在的问题反馈申请人,申请人进一步补充完善后可再次提出沟通交流申请滚动补充资料。
(2)检查检验靠前
为加快品种审评进度,鼓励申请人在正式申报上市前即向药品检验机构提出注册检验,如未提出注册检验的,在受理时即开具检验通知书,告知药品检验,并在受理后 10 日内完成启动注册核查任务电子推送。整个工作程序的沟通交流时限为 30 日,品种审评时限同优先审评品种时限为 130日。
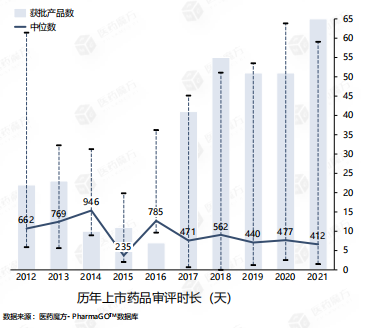
近5年,CDE药品审评效率明显提升,上市药品审评时长明显缩短,中位审评时长约为400-450天,《征求意见稿》中规定品种审评时限同优先审评品种时限为 130日,随着效率的不断提升,创新药上市路径将更加通畅。
近期,建议关注被纳入突破性治疗名单的企业以及具有源头创新品种的公司,这些公司与me too类药物的创新具有更现实的临床价值,如恒瑞医药、百济神州、和记黄埔、信达生物、君实生物、微芯生物、迪哲医药、科济药业、康方生物、荣昌生物、艾力斯等。
总之,《征求意见稿》和《纲要》等利好医药行业的政策相继发布,利空政策市场已经基本适应,可以简单地预判医药行业的底部可能基本已经确认,创新药最黑暗的时间可能已经过去,静待中国的创新药开花结果。
最后提供两组数据,(1)通过恒瑞医药已经上市的10款创新药2021年上半年销售情况,窥探一下恒瑞每种创新药市场情况(附表1);(2)了解一下已经被CDE纳入突破性治疗品种名单(附表2)。
附表1 恒瑞在国内上市的10款创新药
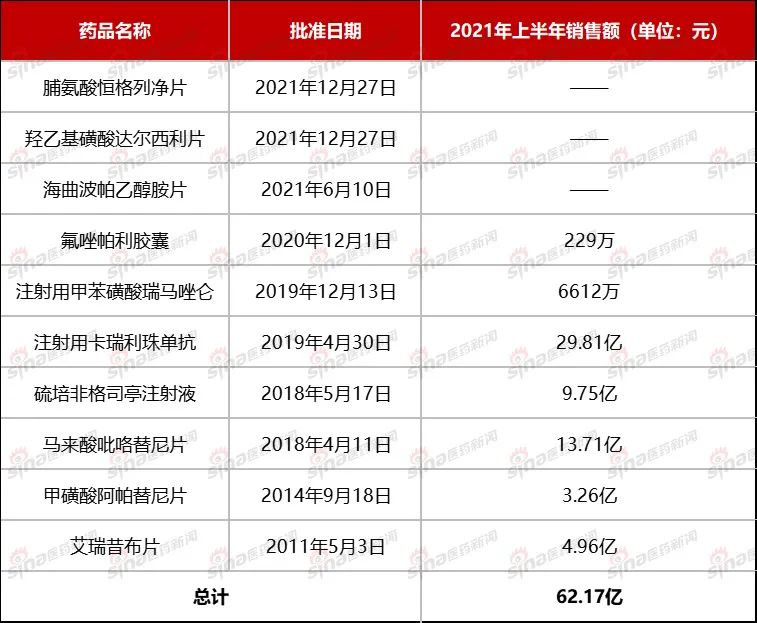
注:2021年恒瑞医药中报显示营业收入为133亿元,创新药收入52.07亿元与米内数据有些许出入。
附表2已经纳入突破性治疗品种名单(数据来自CDE)


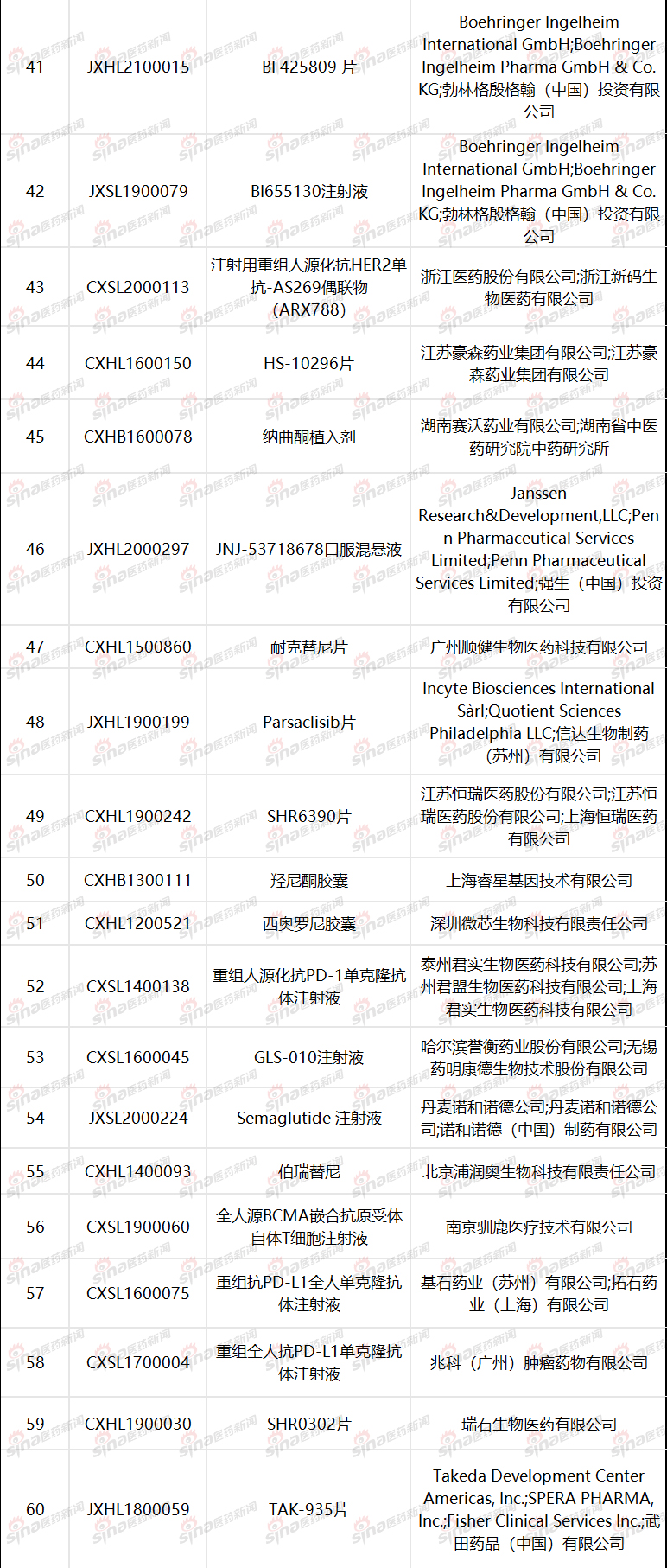
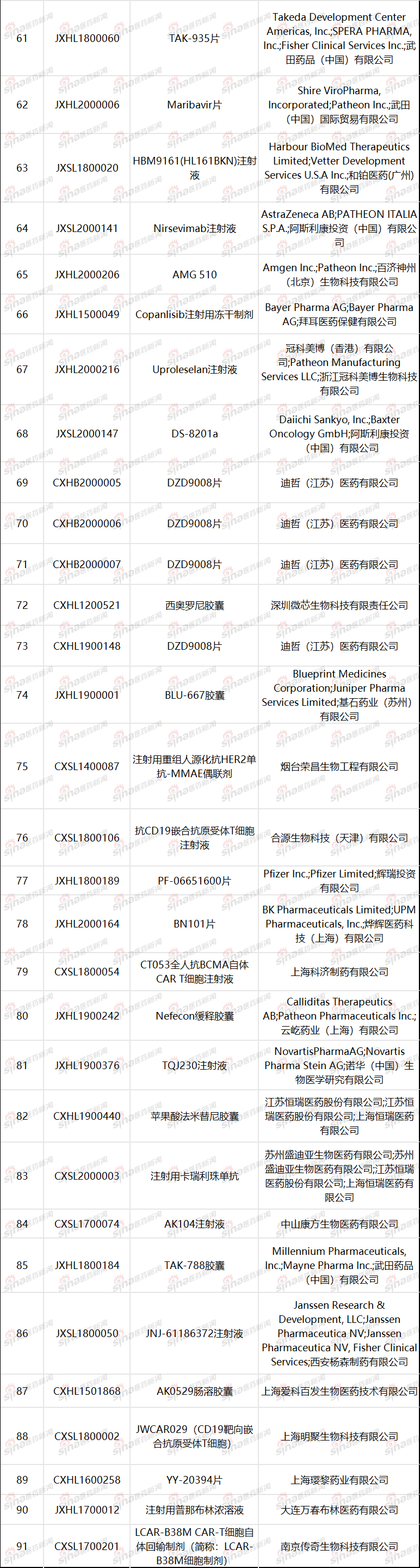
参考资料:《药审中心加快创新药上市申请审评工作程序(试行)》



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57