美东时间2月28日,美国FDA正式批准了传奇生物的靶向BCMA嵌合抗原受体T细胞(CAR-T)产品Ciltacabtagene autoleucel(cilta-cel,西达基奥仑赛,商品名为Carvykti)。作为第2款BCMA CAR-T,Carvykti的定价为46.5万美元。
cilta-cel是传奇生物自主研发的一款用于治疗成人复发和/或难治性多发性骨髓瘤(R/RMM)的靶向的BCMA的CAR-T疗法,包含一个4-1BB共刺激结构域和两个BCMA靶向单域抗体。
此次,传奇生物cilta-cel正式在美获批上市,成为首 个国内首 个自主研发CAR-T产品出海成功典范。
cilta-cel:传奇生物旗下CAR-T疗法“领跑者”
cilta-cel是传奇生物一举成名的产品,此前在监管动态方面亦是不乏“魅力”:
2018年,该疗法获得中国国家药品监督管理局首 个CAR-T临床试验申请(IND)批件和美国FDA的IND批准;
2019年,cilta-cel获得欧洲药品管理局优先药物认定(PRIME)资格及美国FDA授予的突破性疗法认定。
2020年12月,向美国FDA提交cilta-cel的生物制剂许可申请(BLA);
2021年5月,cilta-cel上市申请以优先审评获得受理, 处方药使用者费用法案(PDUFA)时间为2021年11月29日,
2021年11月,传奇生物宣布FDA已将cilta-cel的PDUFA 目标行动日期延迟3个月至2022年2月28日。(此次FDA延长了审评时间,但是并没有要求公司提交新的临床数据,意味着此次延期审批与cilta-cel试验数据无关)
据悉,cilta-cel递交上市申请(BLA)主要是是基于关键性Ib/II期CARTITUDE-1研究的结果,该研究评估了ciltacel在复发和/或难治性多发性骨髓瘤患者中的有效性和安全性。招募的97例受试者中,99%接受末线治疗无效,其中88%既往接受过至少3线治疗。
研究结果显示,中位随访12.4个月时,独立委员审查的ORR为97%,包括67%的sCR(严格的完全缓解),26% 的VGPR(非常好的部分缓解)和4%的PR。≥3级细胞因子综合征(CRS)发生率为5%,≥3级神经**发生率为10%。
除了此前突出的临床数据,在不久前的第40届摩根大通医疗健康年会中,传奇生物的首席执行官兼首席财务官黄颖博士又公布了cilta-cel临床试验的最新数据:在中位24个月的长期随访后,主要终点指标总缓解率(ORR)达到97.9%,VGPR为94.9%,其中82.5%的患者达到sCR。有60.5%的患者在2年后存活且无疾病进展。MRD可评估的61例患者,92%的患者达到了10-5MRD阴性。
除了这款跑在监管胜利终点的cilta-cel,在血液瘤领域,传奇生物开发了针对多个潜力靶点的单靶点/双靶点/三靶点 CAR-T 产品,包括 BCMA、CD4、CD20、CD33/CLL-1、CD19/CD20/CD22 等。其中,自体CD4靶向CAR-T疗法LB1901已经通过了FDA的IND申请,并在美国启动Ⅰ期临床试验,用于治疗成人复发性或难治性外周T细胞淋巴瘤(PTCL)或皮肤T细胞淋巴瘤(PTCL),为传奇生物旗下管道中研发进展较快的产品。
值得注意的是,在本月早些时候,传奇生物收到FDA邮件表示:旗下这款LB1901的I期临床试验被暂停。至于暂停原因,FDA及传奇生物均未提及。不过,据了解临床试验并非是被FDA叫停的,而是受试的患者出现了状况。
在实体瘤领域,传奇生物开发了多款产品以应对胃癌、肝癌、小细胞肺癌、非小细胞肺癌和卵巢癌,其中靶向Claudin18.2的LB1908和靶向MSLN的LB1902都已经进入到I期临床。
此外, 传奇生物旗下还拥有嵌合抗原受体自然杀伤细胞(CAR-NK)平台。
CAR-T市场前景辽阔,首 款靶向BCMA产品迎对手
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy)细胞疗法目前已被证明是对抗血液类癌症的强大武器。该疗法是一种治疗肿瘤的新型精准靶向疗法,其原理是将患者血液的天然抗感染和抗癌的免疫细胞T细胞在体外进行基因重编程,这种被重新编辑的患者T细胞,经过体外培养和改造,重新输入患者身体后,能够识别患者体内癌细胞上的抗原标记物。随后,再利用细胞培养技术扩增这些CAR-T细胞,并将其重新注入患者体内以攻击癌症。
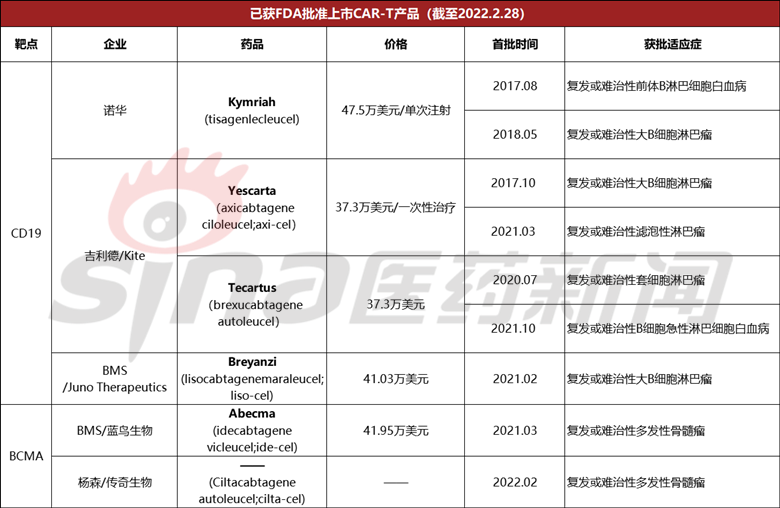
截至目前,美国FDA已经批准了6款CAR-T细胞疗法上市,其中四款靶向CD19,两款靶向BCMA。
市场方面,根据弗若斯特沙利文的数据,全球CAR-T细胞治疗市场从2017年的0.1亿美元增长到2019年的7亿美元和2020年的11亿美元,预计未来几年将加速增长,2024年将扩大至66亿美元,2030年市场将进一步增长至218亿美元。
根据各大药企近日来发布的2021年业绩公告:
最早上市的诺华的Kymriah在2021年销售额达到5.87亿美元,同比增长24%。
紧接着吉利德的两款产品:Yescarta在2021年的销售额为6.9亿美元,较去年增加23%;Tecartus在首 个完整财年也实现1.7亿美元销售收入。
百时美施贵宝于去年上市的Breyanzi首年业绩表现并不如意,仅0.87亿美元,而晚一个月获批的Abecma,作为当时全球仅有的一款靶向BCMA的CAR-T疗法,其首年销售额为1.64亿美元,接近于Breyanzi全年销售额的两倍。
而cilta-cel作为全球第二款获批上市的靶向BCMA的CAR-T疗法,其上之后最直接的竞争对手——来自同一赛道来自百时美施贵宝的Abecma,该产品的销售额对cilta-cel存在一定的参考价值,尽管该产品的首年销售额相较于早期几款CAR-T产品而言可能不尽如人意。
不过,根据此前临床数据,经Abecma治疗的先前接受过3类疗法患者中位OS为24.8个月,ORR为73%,33%的患者达到CR。上文介绍到,传奇生物cilta-cel临床数据显示:其ORR达98%,80%的患者实现了sCR,同时安全性也有一定差异化优势。
由此可见,cilta-cel在未来的销售或许要略胜一筹。
据了解,早在cilta-cel成形之前,传奇生物就已受到了巨头MNC的青睐。2017年12月,传奇生物与强生旗下杨森达成全球合作和许可协议。根据合作协议,在大中华区,传奇生物和杨森按照7:3的比例共同承担成本和分享收益;在全球其他区域,两家公司五五分成。
目前,传奇生物已经获得了3.5亿美元的预付款以及2.5亿美元里程碑付款。
国内企业不甘落后,CAR-T靶点竞争蓄势待发
国内方面,目前国家药监局已经批准上市两款CAR-T产品,均为靶向CD19。这两款产品分别是复星凯特的阿基仑赛注射液以及药明巨诺的瑞基奥仑赛注射液,据悉,两款产品均为合作引进产品,阿基仑赛注射液由复星凯特向Kite公司引进,瑞基奥仑赛注射液由药明巨诺向Juno公司引进。
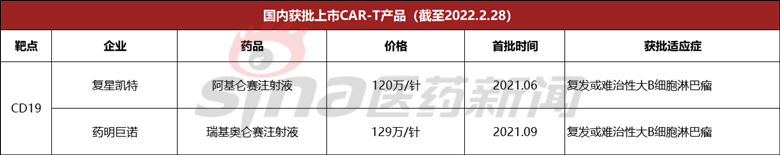
值得一提的是,2月27日,药明巨诺发布公告称,旗下CAR-T产品瑞基奥仑赛注射液第二项适应症目前已获国家药监局的受理,用于治疗复发或难治性(r/r)滤泡淋巴瘤(FL)患者。
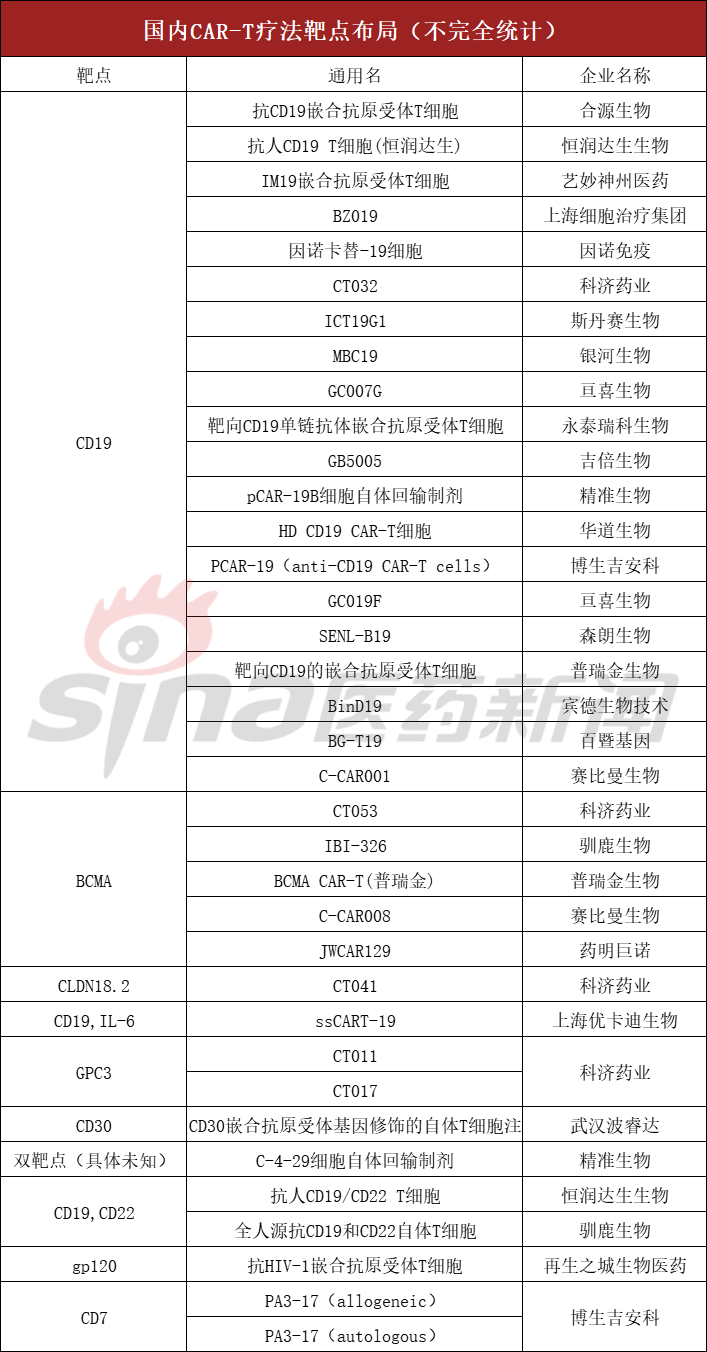
另外,国内还有合源生物、科济药业、艺妙神州等企业踊跃加入,旗下均有产品已迈入临床阶段。其研发靶点主要集中于CD19,其次为BCMA,也不乏双靶点产品。
参考来源:药渡《全球CAR-T疗法研发图鉴》



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57