华东医药公告称,公司海外合作伙伴 ImmunoGen对外公布了用于治疗卵巢癌的ADC药物Mirvetuximab Soravtansine(IMGN853,简称Mirvetuximab)美国关键性单臂临床试验(SORAYA)的全部研究结果。目前试验已达到主要研究终点,确认的客观缓解率(ORR)为32.4%,包括5例完全缓解;更新的中位缓解持续时间(mDOR)为6.9个月,临床试验结果显示其在叶酸受体α(FRα)高表达的铂耐药卵巢癌中具有临床意义的抗肿瘤活性、一致的安全性和良好的耐受性。ImmunoGen预计本月在美国递交Mirvetuximab的生物制品许可申请(BLA)。
Mirvetuximab为华东医药与ImmunoGen在抗体偶联药物(ADC)领域合作开发的全球首 个针对叶酸受体α(FRα)阳性卵巢癌的ADC在研药物。Mirvetuximab在中国的I期临床试验PK药代研究和中国III期临床试验均完成首例受试者入组及给药,相关临床工作正按计划推进。
近日,华东医药美国合作伙伴ImmunoGen在 SGO 年会上展示Mirvetuximab治疗卵巢癌的积极关键性试验结果。结果显示,SORAYA试验达到主要终点,确认的客观缓解率为 32.4%,包括5例完全缓解;更新的中位缓解持续时间为 6.9 个月。Mirvetuximab在FRα 高表达的铂耐药卵巢癌中表现出有临床意义的抗肿瘤活性、一致的安全性和良好的耐受性。
“铂耐药卵巢癌患者的治疗选择有限,这些与低缓解率和显著**有关,”Dana-Farbe癌症研究所妇科肿瘤部门主任、哈佛医学院医学教授、SORAYA联合主要研究者、医学博士Ursula Matulonis说,“凭借32.4%的客观缓解率,远远超过目前治疗的水平,中位缓解持续时间接近7个月,Mirvetuximab继续在已接受过贝伐珠单抗治疗的铂耐药患者中显示出令人印象深刻的疗效。”他们表示,SORAYA 试验中表现出的抗肿瘤活性以及一致的安全性和耐受性数据,进一步强调了Mirvetuximab的潜力,如果获得批准,将成为这些患者的实践改变、生物标志物驱动的护理标准。
SORAYA是一项针对Mirvetuximab用于治疗铂耐药卵巢癌患者的单臂临床试验,这些患者的肿瘤存在FRα高表达,并且已经接受过一到三种先前的治疗方案,其中至少一种包括贝伐珠单抗。该研究的主要终点为研究者评估确认的客观缓解率(ORR),关键的次要终点是缓解持续时间(DOR)。该研究是为了进一步提升单药化疗12%的ORR(AURELIA研究,患者接受过1到2种化疗方案)。
ImmunoGen高级副总裁兼首席医疗官、医学博士Anna Berkenblit表示,在经过多线治疗的铂耐药卵巢癌患者人群中,SORAYA的结果与Mirvetuximab以前临床试验的结果非常的一致,其中包括先前使用过贝伐珠单抗的患者人群。基于在SORAYA中观察到的令人印象深刻的抗肿瘤活性、缓解持续性和安全性,Mirvetuximab有可能取代单药化疗成为FRα高表达铂耐药卵巢癌的标准治疗。 我们非常感谢所有为这项研究付出时间和精力的患者和医生,凭借这些积极的结果,我们预计本月将提交 Mirvetuximab 的 BLA,以支持今年在美国的潜在加速批准。SORAYA数据的强度和一致性使我们对正在进行的确证性MIRASOL试验的积极结果充满信心,该试验旨在支持 Mirvetuximab的潜在全面批准,预计在第三季度获得关键数据。”
除SORAYA试验外,目前Mirvetuximab正在开展国际多中心随机对照Ⅲ期研究MIRASOL,还有多个联合疗法,包括与贝伐珠单抗、卡铂等联合,可以进一步提高卵巢癌的响应率。ImmunoGen预计2022年第三季度可以获得MIRASOL试验的关键数据(top-line data)。
华东医药已在ADC领域取得重要的阶段性进展。Mirvetuximab在中国首 个临床试验申请已于2021年3月获得国家药品监督管理局(NMPA)批准,包括上述一项国际多中心Ⅲ期研究和一项评价中国成人患者中的安全性、耐受性和药代动力学的Ⅰ期研究。另一项中国关键性单臂临床试验也于2021年8月获得国家药品监督管理局(NMPA)批准。
ImmunoGen是全球研发抗体偶联药物(ADC)的领军Biotech,与多家知名药企达成合作。此外,华东医药于今年2月28日宣布股权投资德国Heidelberg Pharma,也是全球ADC药物研发的明星公司。华东医药计划以6.44欧元/股的价格认购Heidelberg Pharma公开增发的股票并从交易对方收购部分股权,投资完成后取得Heidelberg Pharma共计35%的股权,成为其第二大股东,股权投资金额1.05亿欧元。Heidelberg Pharma是全球ADC药物研发的顶尖Biotech之一,背后第一大股东是德国知名dievini Hopp 家族基金,专注于生物技术领域投资。
华东医药通过引入多款Heidelberg Pharma的ADC创新产品,进一步丰富了公司肿瘤领域创新产品管线,并在ADC领域实现差异化纵深布局。值得一提的是,Heidelberg Pharma 拥有独家 ATAC?平台(Antibody Targeted Amanitin Conjugate,抗体-鹅膏蕈碱偶联物),是全球首 个成功将Amanitin(鹅膏蕈碱)及其衍生物开发用于癌症治疗的公司,并成功利用该毒素的独特生物学特性开创了一种全新的治疗方法。
事实上,近年来,华东医药在ADC领域持续加大差异化纵深布局,先后投资了抗体研发生产公司荃信生物、ADC连接子与偶联技术公司诺灵生物,孵化了拥有ADC药物毒素原料全产品线的珲达生物,控股了多抗平台型研发公司道尔生物,与ADC领域全球新兴的科技公司Heidelberg Pharma开展股权投资及产品合作,形成华东医药独有的ADC全球研发生态圈,逐步打造属于华东医药的ADC领域全球一流的自主研发产业平台。
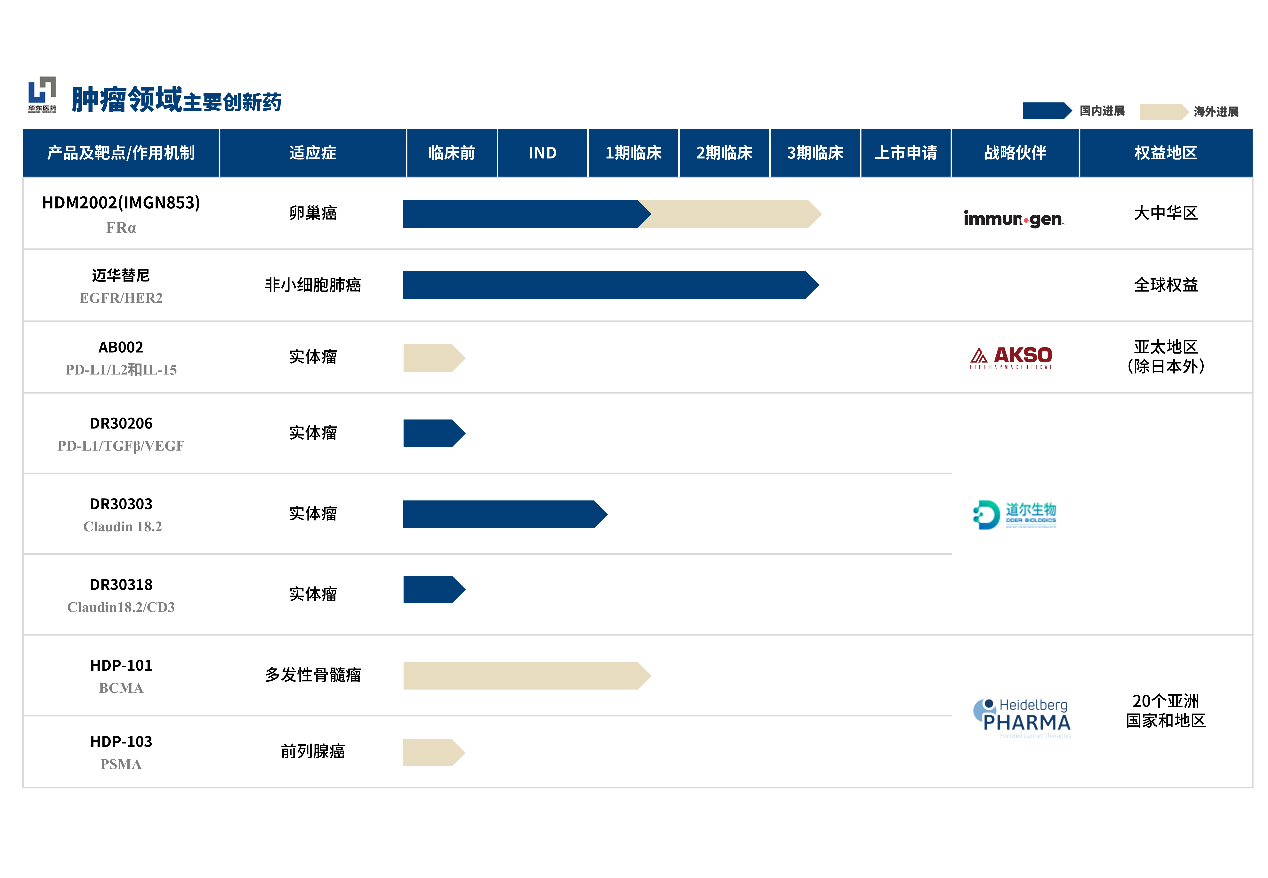
肿瘤用药作为全球第一大药物市场,仍有众多临床需求无法被满足,市场增长潜力巨大。目前,通过自主研发及外部合作的驱动模式,华东医药在肿瘤领域已形成了多条产品管线,拥有近十款全球创新药,覆盖实体瘤与血液瘤领域。
据华东医药最新披露,公司与盛诺基合作市场推广产品——抗肝癌小分子免疫调节国家一类创新药(First-in-Class) “淫羊藿素软胶囊”即将于2022年4月初正式商业化上市销售。今年1月15日,华东医药宣布拿下“淫羊藿素软胶囊”于中国大陆27个省份的独家市场推广权。华东医药聚焦抗肿瘤、内分泌、自身免疫三大重点领域,以未满足临床需求为导向布局差异化市场。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57