CAR-T疗法是细胞与基因疗法(CGT)中的典型代表,也是目前最成熟的细胞疗法,在淋巴瘤、多发性骨髓瘤的治疗中展现出惊艳的治理效果。截止到3月底,全球已经上市或者BLA(Biologics License Application)的CAR-T药物有7种(Yescarta和奕凯达算一款),但是CAR-T疗法只是CGT的一种,笔者来为大家梳理一下可能引导下一代治疗技术的CGT。
CGT是一种利用基因治疗载体将外源的治疗性基因转导至细胞,再通过外源基因的转录和翻译,改变细胞原有基因表达与治疗疾病的方法。主要分为细胞治疗、基因治疗两种。CGT产品的主要形式包括基因治疗载体、溶瘤病毒产品、细胞产品(如CAR-T、NK细胞)等。细胞治疗主要涉及体外治疗,将病患的细胞在体外进行一定的修饰后再回输回患者体内,从而达到治疗的效果,典型代表就是CAR-T疗法。
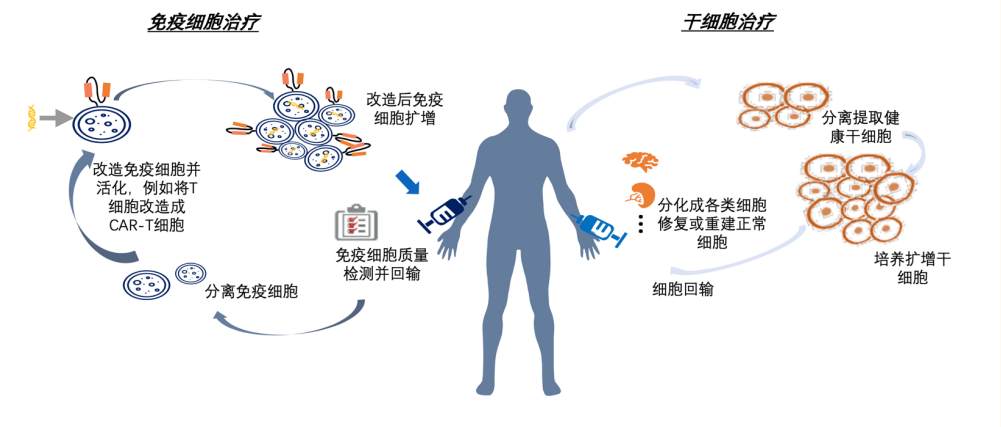
图1 细胞治疗过程
基因治疗主要涉及体内治疗,将外源基因导入到患者体内的靶细胞内,然后在基因层面治疗调控蛋白的表达,从而达到治疗疾病的目的。体内治疗主要借助非病毒或病毒载体将功能基因转入宿主细胞,常用的非病毒载体包括聚合物胶束、脂质颗粒、质粒等,常用的病毒载体包括腺病毒、腺相关病毒(AAV)、逆转录病毒、慢病毒等。
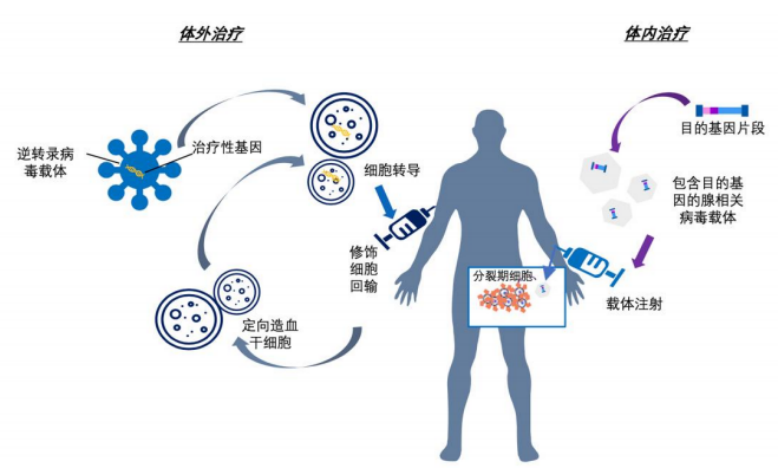
图2 体内、外基因治疗过程
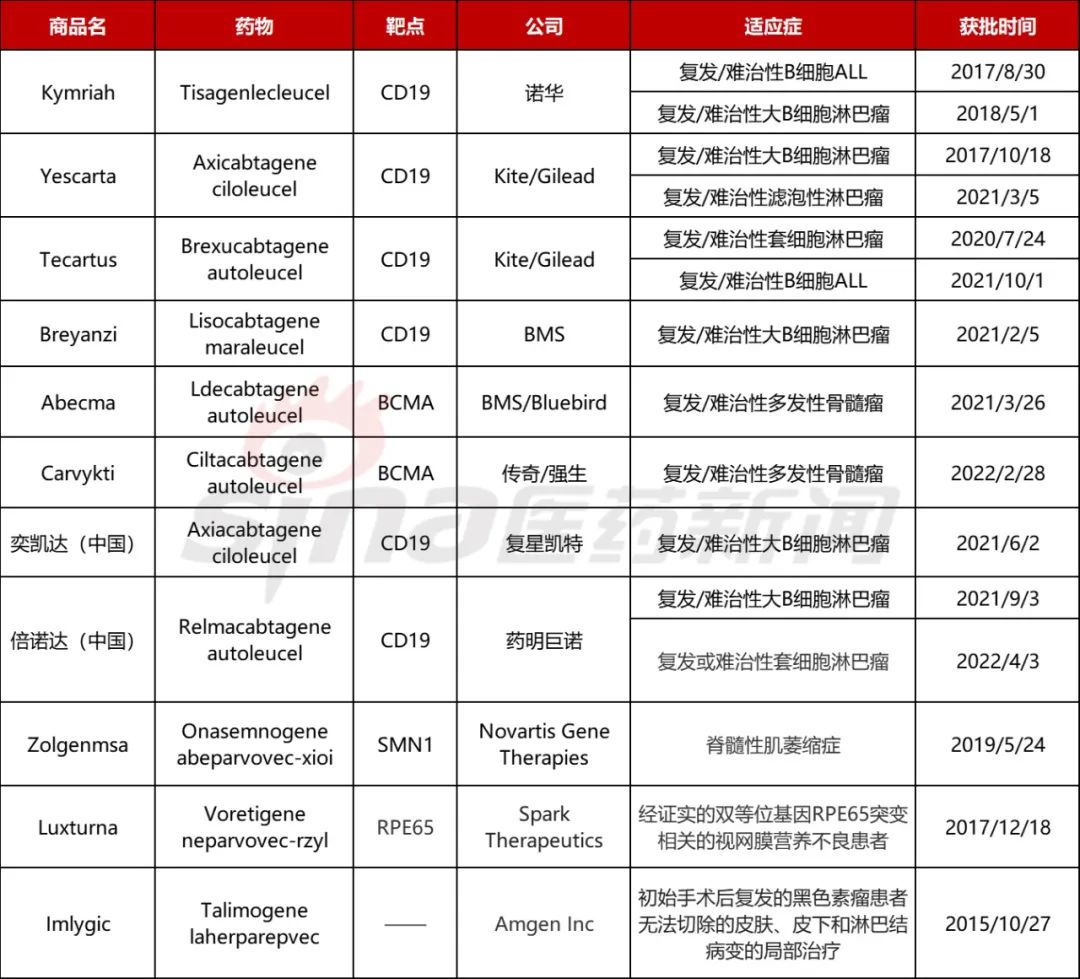
01国内外多种CGT药物上市CGT的发展与分子生物学、基因组学等基础科学的发展密切相关。可以追溯到1953年DNA双螺旋结构提出和1972年首次提出基因治疗的概念,随后CGT行业不断发展。2003年,全球首 个基因治疗药物重组人p53腺病毒注射液(今又生)在中国获批,后续多个CGT产品陆续获批。目前FDA除了已经批准的6个CAR-T药物还批准了2个病毒载体疗法(Zolgenmsa和Luxturna)和1个溶瘤病毒疗法(Imlygic),中国也有两种CAR-T药物获批。
表1 全球已上市或BLA阶段的CGT药物
02 在研管线丰富,未来CGT市场可期
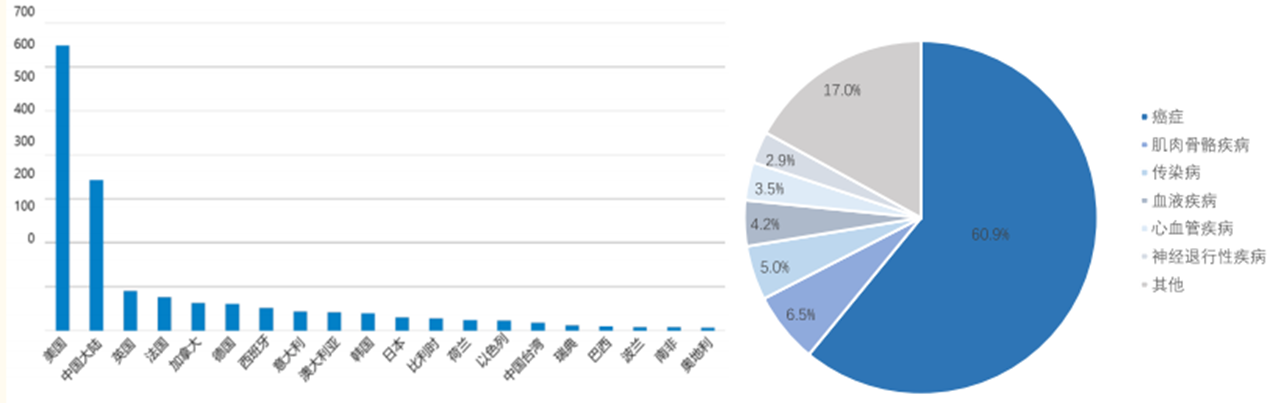
图3 全球各国的CGT在研管线数量(图左)和在研管线各治疗领域占比(图右)
受益于技术、政策、资本等方面的利好,与CGT相关的研究开发正在如火如荼地进行,全球大约有1300多个细胞与基因治疗项目处于临床阶段,按照地区来看,美国是CGT管线数量最多的国家,有超过600多项,其次是中国,累计超过300项。治疗领域广泛,主要以癌症领域为主,占比超过了60%。从临床分期来看,全球39.5%的临床处于I期,28%处于临床I-II期,25%处于临床II-III期,6%处于临床III期。从临床管线来看,多数CGT项目尚处于临床早期,随着临床管线的推进,CGT产品可能会呈现加速上市的态势。
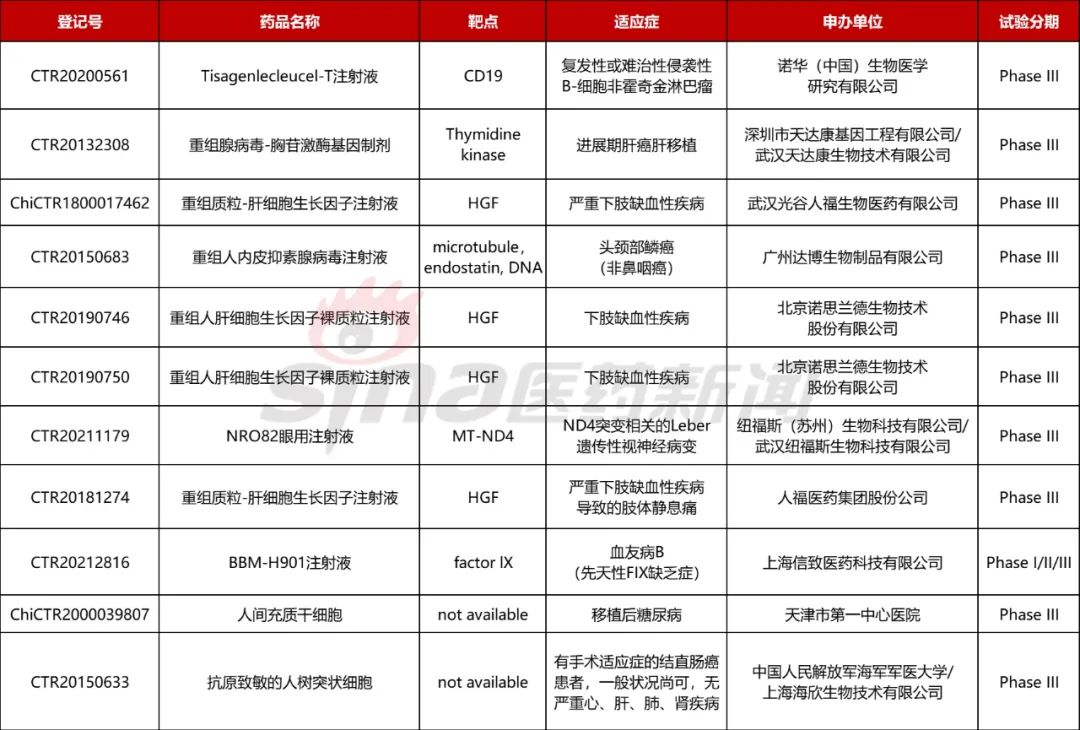
表2 中国目前处于临床3期的CGT在研管线
自2017年获批以来,Yescarta与Kymriah的销售额节节攀升,2020年两款产品分别实现销售额5.63亿美元与4.74亿美元。2017-2020年复合年均增长率分别为332%与329%。高速放量使得更多CGT产品未来拥有成为重磅药物的潜力,也有望带动CGT研发的“掘金热”。
2021年可谓是国内CAR-T细胞疗法的元年,去年6月批准了复星凯特的CAR-T产品阿基仑赛注射液(奕凯达),9月批准药明巨诺的CAR-T产品瑞基仑赛注射液(倍诺达)。这两款药物的上市为国内晚期血液肿瘤患者提供了全新的治疗手段。
奕凯达是一种自体免疫细胞注射剂,由携带CD19 CAR基因的逆转录病毒载体进行基因修饰的自体靶向人CD19嵌合抗原受体T细胞(CAR-T)制备,是中国首 个获批的CAR-T药物。它是复星凯特引进美国Kite(吉利德科学旗下公司,全球首 个获批治疗非霍奇金淋巴瘤的CAR-T产品)的Yescarta后,进行技术转移并获授权在中国进行本地化生产的靶向人CD19自体CAR-T细胞治疗产品。奕凯达获批是基于复星凯特在中国开展的一项单臂、开放性、多中心桥接临床试验结果,在难治性侵袭性弥漫大B细胞淋巴瘤中国患者中验证了其有效性和安全性。
倍诺达是国内第2款获批上市的CAR-T产品,也是国内首 个获批的1类CAR-T、全球第6款获批上市的CAR-T产品。瑞基仑赛注射液是在美国Juno公司JCAR017的基础上,由药明巨诺自主开发的CAR-T产品。2022年4月3日CDE已授予倍诺达用于治疗套细胞淋巴瘤的突破性治疗药物认定。
03 CGT治疗行业政策
2021年6月复星凯特的阿基仑赛注射液率先获批,成为中国首 款上市的CAR-T产品。在此之前,CGT疗法一度因为对其安全性的质疑而受挫,但从国家政策层面来看,经过十余年的鼓励与规范化政策指导,中国CGT治疗领域经历了三个发展阶段,目前已经进入规范化发展阶段。我们来梳理一下这三个阶段。
➣自由发展阶段(1993-2015年)
2009年,卫生部颁布《允许临床应用的第三类医疗技术目录》,将自体免疫细胞(T细胞、NK细胞)治疗技术归入第三类医疗技术目录。
2015年,《干细胞临床研究管理办法(试行)》提出对于干细胞治疗临床研究申报要求和规范,干细胞治疗相关技术不再按照第三类医疗技术管理。同年国务院取消第三类医疗技术临床应用准入的非行政许可审批,简政放权,医疗技术的行政管理从审批制转为备案制,减少了各种繁琐的审批手续造成的时间和精力成本。
➣ 调整阶段(2016年)
2016年4月的“魏则西事件”敲响了CGT疗法安全性的警钟,国家卫计委立即暂停了所有未经批准的第三类医疗技术的临床应用,明确要求所有免疫治疗技术仅可用于临床研究。
2016年《“十三五”国家科技创新规划》提出发展先进高效生物技术,开展重大**、抗体研制、免疫治疗、基因治疗、细胞治疗、干细胞与再生医药、人体微生物组解析及调控等关键技术研究。
➣ 规范化发展阶段(2016年-至今)
2017年,国家药监局颁布《细胞治疗产品研究与评价技术指导原则(试行)》,提出细胞治疗产品药学研究、非临床研究、临床研究阶段的安全、有效、质量可控的一般技术要求。
2019年,CDE就《基因治疗产品和免疫细胞治疗产品的药学研究与评价技术指导原则》征求意见,对基因治疗和免疫细胞治疗产品的药学研究及生产过程做出指导。
2021年,《免疫细胞治疗产品临床试验技术指导原则(试行)》对细胞免疫治疗产品探索性临床试验和确证性临床试验的技术问题提出建议和推荐,规范产品的安全性和有效性的评价方法。
04 总结
总之,CGT治疗是继小分子、大分子之后又一重磅药物,具有单次治疗的疗效持久、靶点多、可以覆盖难治疾病的优势,同时CGT技术以基因治疗载体为核心,工艺开发和质控难度大,与基因等基础研究联系紧密。《中华人民共和国国民经济和发展的第十四个五年(2021-2025)规划和2035年远景目标纲要》提出攻关科技前沿领域,基因与生物技术,基因组学研究应用,遗传细胞和遗传育种、合成生物、生物药等技术创新,**、体外诊断、抗体药物等研发,CGT相关领域在国内具有很好的发展前景。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57