5月18日,通化东宝发布公告称,公司收到德国监管机构(BfArM)签发的关于可溶性甘精赖脯双胰岛素注射液(THDB0207注射液)三项I期临床试验批准通知书后,已经启动德国I期临床试验,并于近日成功完成CT046-ADO05试验的首例受试者入组。

2018年4月26日,通化东宝与法国SA ADOCIA公司签订了《胰岛素基础餐时组合合作和许可协议》,Adocia公司将BioChaperone的专利平台技术、专利权有偿许可给通化东宝,通化东宝利用该等专利平台技术,获得许可产品BC Combo,即可溶性甘精赖脯双胰岛素注射液,在大中华地区的国家和地区,以及马来西亚、新加坡等国家和地区的独家临床开发、生产和商业化权利。
2020年3季度,通化东宝完成了技术转移、制剂开发、注册批生产工作,随后开展了临床前药学和质量研究、药理毒理研究,并制定了临床开发计划(包括在德国开展三项I期临床试验用于中国的注册申报)。2021年2季度通化东宝向国家药品监督管理局药品审评中心(CDE)提交了沟通交流会议申请,CDE同意公司提出的将在德国开展三项I期临床试验的临床开发计划后,公司分别于2021年12月和2022年2月向CDE和德国监管机构(BfArM)提交了临床试验申请,并于2022年3月8日获得了CDE的药物临床试验批准通知书,2022年4月陆续获得了BfArM三项I期临床申请的全部批准。
上述三项已在德国启动的I期临床试验,使得可溶性甘精赖脯双胰岛素注射液能够在获得领 先技术标准下的钳夹研究数据的基础上,更快完成支持Ⅲ期临床试验的早期临床药理学研究。
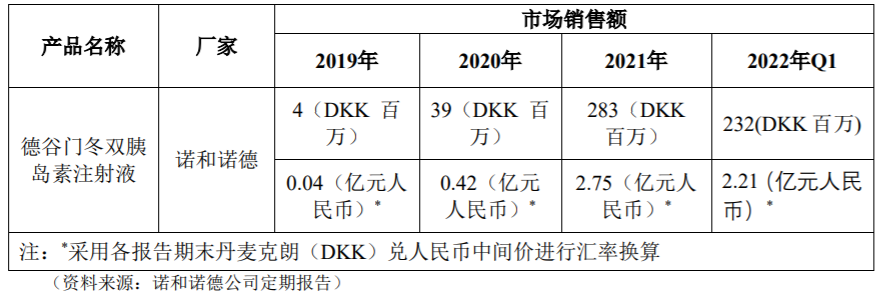
可溶性甘精赖脯双胰岛素注射液属于目前唯一能将长效甘精胰岛素和速效赖脯胰岛素成功组合的复方制剂。目前全球范围内的双胰岛素产品仅有诺和诺德公司的德谷门冬双胰岛素注射液(商品名称:诺和佳®、Ryzodeg®),Ryzodeg®于2012年起陆续在日本、欧洲和美国等多个地区上市,2019年5月在中国获批上市,中文商品名为诺和佳®。
目前我国上市销售的双胰岛素产品仅有德谷门冬双胰岛素注射液,近年来的市场情况如下:



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57