国内审评审批·新动态
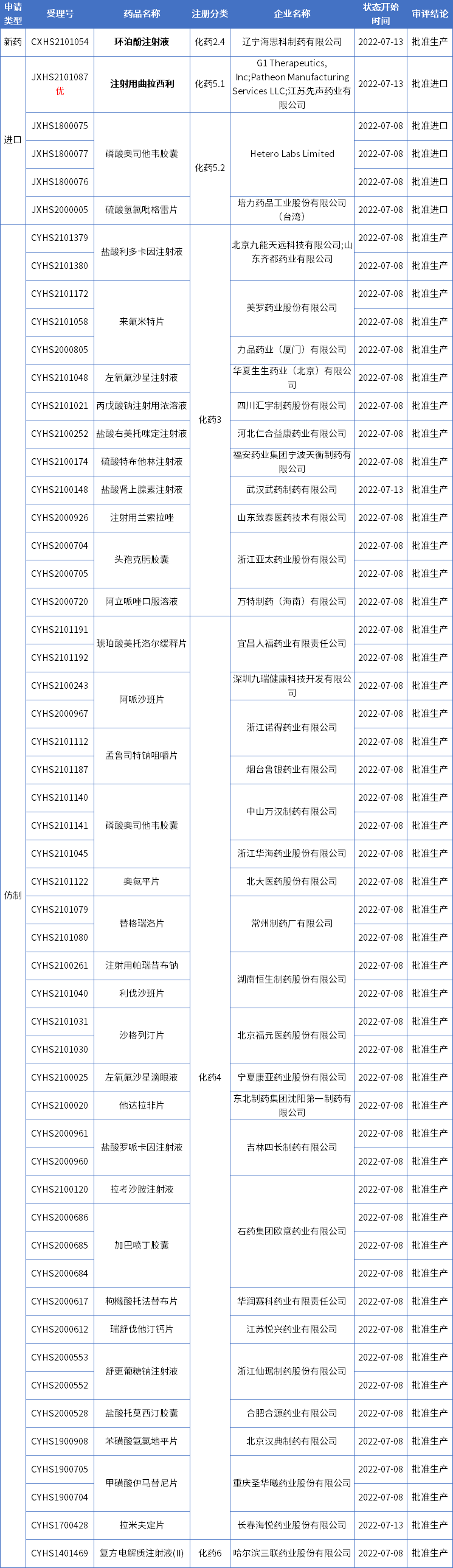
本期CDE有54个受理号(36个品种)报生产办理状态更新,其中辽宁海思科的环泊酚注射液和先声药业的注射用曲拉西利备受关注。更多动态如下:
数据来源:药智数据
海思科环泊酚注射液获批新适应症
药智数据显示,海思科环泊酚注射液第4项适应症已获NMPA批准上市。
环泊酚(HSK3486)是海思科开发的全新的具有自主知识产权的静脉麻 醉药物。该药是经典麻 醉镇静药丙泊酚的改良型新药,其效能显著高于丙泊酚,且安全性好于丙泊酚。
目前,环泊酚已申报5 项适应症,其中“全身麻 醉诱导”、“非气管插管的手术/操作中的镇静和麻 醉”、“全身麻 醉诱导和维持”及“重症监护期间的镇静”四项适应症已获得国家药品监督管理局批准上市;“妇科门诊手术的镇静及麻 醉”尚在上市申请审批中。
根据《国家医保目录(2021版)》,环泊酚经国家谈判被纳入医保。
先声药业引进的骨髓保护新药在国内获批!
近日,先声药业引进的全球首创新药曲拉西利(商品名:科赛拉)附条件获批在中国上市,用于既往未接受过系统性化疗的广泛期小细胞肺癌患者,在接受含铂类药物联合依托泊苷方案治疗前预防性给药,以降低化疗引起的骨髓抑制的发生率。据先声药业新闻稿,该药有望作为‘化疗卫士’,填补小细胞肺癌治疗领域重要的临床空白。
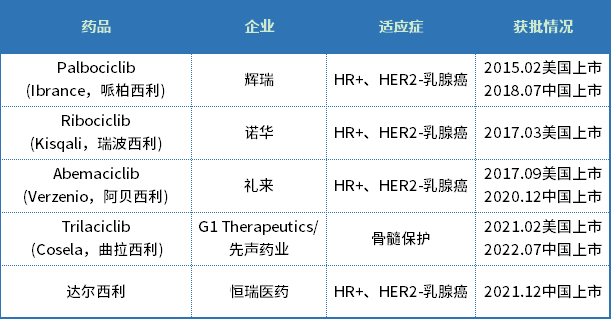
曲拉西利是先声药业与G1 Therapeutics合作研发的一款细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂。目前,全球共有五款CDK4/6抑制剂获批上市,分别是哌柏西利、瑞波西利、阿贝西利、曲拉西利和达尔西利。
数据来源:药智数据
这5款CDK4/6抑制剂中,大多数针对的适应症为晚期乳腺癌,唯有曲拉西利另辟蹊径,专门针对CDK4/6不敏感的肿瘤,通过将骨髓细胞短暂停留在对化疗不敏感的细胞周期,避免化疗药物对其的“杀伤”,成为全球首 个在化疗前预防性给药以全面保护骨髓和免疫细胞的产品。
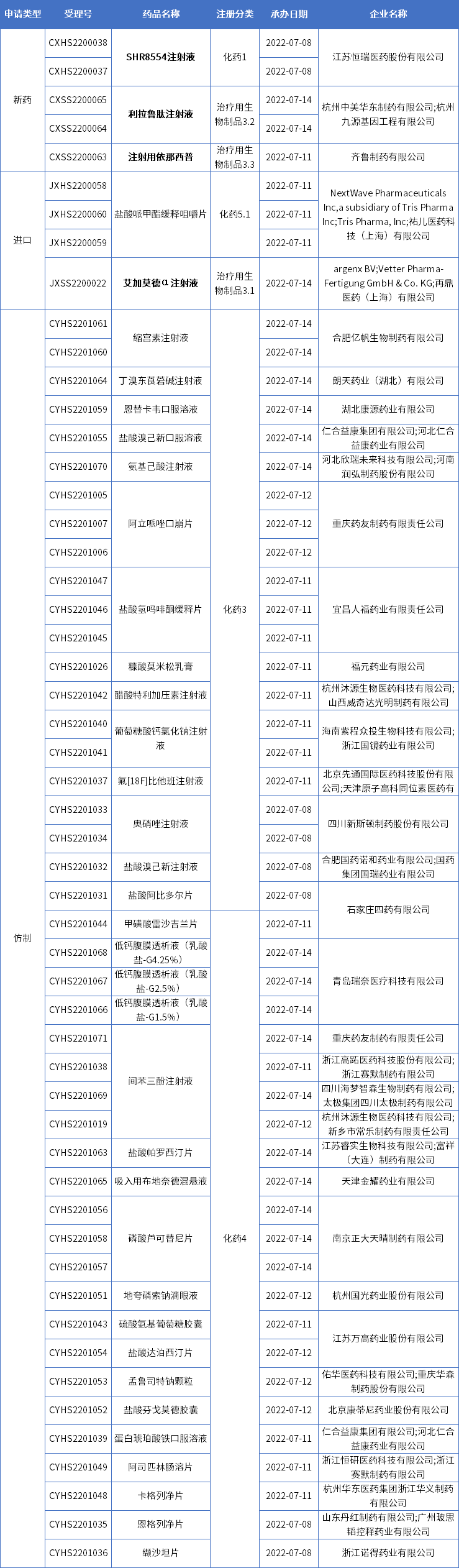
国内审评审批·新受理
本期CDE新增报生产受理号53个,共37个品种,其中恒瑞医药的SHR8554注射液、华东医药的利拉鲁肽注射液、齐鲁制药的注射用依那西普、以及再鼎医药的艾加莫德α注射液备受关注,更多动态见下表:
数据来源:药智数据
恒瑞医药1类新药SHR8554申报上市
近日,恒瑞医药自主研发的1类新药SHR8554注射液治疗腹部手术后中重度疼痛适应症上市许可申请获得CDE受理。
阿 片类药物是治疗中重度急慢性疼痛最常用的药物。但经典的μ-阿 片受体(MOR)激动剂可以同时激活G蛋白偶联通路和β-arrestin2信号通路,产生强大的中枢镇痛效果的同时,会引起胃肠道不良反应等副作用。
SHR8554注射液是恒瑞医药自主研发的1类新药,是一种靶向μ阿 片受体(MOR)的小分子药物。与经典的 MOR 激动剂相比,SHR8554 在产生类似的中枢镇痛作用的同时,降低常见的胃肠道不良反应发生率。目前,国内尚无同类药物上市。
SHR8554 注射液的 Ⅲ 期临床试验(SHR8554-301)表明,SHR8554注射液能够有效治疗腹部手术后中重度疼痛,显著提高受试者对镇痛治疗的满意度。
除了用于腹部手术后镇痛,恒瑞医药还在开发SHR8554注射液用于骨科手术后镇痛,联合靶向κ阿 片受体(KOR)的激动剂SHR0410用于术后急性中到重度疼痛等适应症。
华东医药利拉鲁肽“减重”适应症上市申请获受理
近日,华东医药提交的利拉鲁肽注射液用于肥胖或超重适应症的上市许可申请已获CDE受理。这是GLP-1受体激动剂类药物的体重控制适应症在国内首次获受理。
利拉鲁肽为人胰高血糖素样肽-1(GLP-1)受体激动剂,中美华东的利拉鲁肽注射液为诺和诺德公司产品诺和力®的生物类似药。在美国,GLP-1受体激动剂司美格鲁肽、利拉鲁肽等药物已获批用于肥胖和体重控制。在中国,中美华东为国内首家提交利拉鲁肽生物类似药两个适应症(糖尿病适应症、肥胖或超重适应症)注册申请并有望成为首家获批的企业。而且华东医药也是国内最早提交利拉鲁肽生物类似药上市申请的企业,于 2021 年 9 月获 CDE 受理,有望在今年年内获批。
围绕GLP-1靶点,华东医药还布局了司美格鲁肽注射液、DR10624、HDM1003(SCO-094)、TTP273等项目。
齐鲁制药依那西普再次提交上市
药智数据显示,齐鲁制药的生物类似药「依那西普」再次提交了上市申请。早在 2019 年 5 月齐鲁制药就曾提交过该药的上市申请,不过根据今年 6 月 NMPA 发布的通知件,该项申请未能获得批准 。
依那西普是第一个批准用于类风湿性关节炎(RA)的TNF拮抗剂,原研公司为安进/辉瑞,于1998年11月2日获得美国FDA批准,2010 年 2 月在国内获批上市(商品名:Enbrel,恩利®)。目前国内已有3款依那西普生物类似药获批上市,首 款来自三生国健,于 2005 年 1 月首次获批,早于原研药恩利®。另外两款分别来自赛金药业和海正药业。
再鼎医药又一款罕见病新药报上市
7月13日,再鼎医药引进的同类首创的FcRn拮抗剂艾加莫德α注射液(efgartigimod)上市申请获CDE正式受理,用于治疗全身型重症肌无力。
根据再鼎医药新闻稿,Efgartigimod是首 个且目前唯一获批的FcRn拮抗剂,2021年12月在美国获批上市用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力;2022年1月,在日本批准上市,用于治疗对类固醇或非类固醇免疫抑制疗法(ISTs)没有充分应答的全身型重症肌无力成人患者。美国和日本的获批是基于efgartigimod关键性3期ADAPT研究,结果显示,68%接受efgartigimod治疗的患者获得缓解,安慰剂组这一数值为30%。
2021年1月,再鼎医药与argenx达成独家授权合作,在大中华区开发和商业化efgartigimod,交易总额为1.75亿美元。此前,该药已成功落地海南博鳌乐城国际医疗旅游先行区。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57