
任哲郯1,谢雨瑶1,刘安琪2*
心血管疾病 (Cardiovascular Disease,CVD) 是迄今为止世界上的主要死因,每年造成1770万人死亡[1]。而我国心力衰竭发生率居高不下:25岁以上患病率1.1%,总数超过1200万,主要病因为高血压及冠心病[2]。因此心血管疾病的防控仍面临巨大的挑战。一系列损害心室血液充盈或流出的结构或功能障碍可导致心力衰竭 (heart failure, HF)[3]。心力衰竭作为具有多种病因及各种因素影响的临床综合征,由于缺乏对发病率、普遍性和预后的可靠的基于人群的估计,一直没有办法做到准确评估HF的程度 [4、5]。斑马鱼胚胎期的心脏发育很迅速,心脏功能容易观察和量化。对于反向遗传学,通过使用吗啉反义寡核苷酸和CRISPR-Cas9来调控基因功能,使斑马鱼成为体内选择基因的主要动物模型之一[6]。斑马鱼有很强的心脏再生能力,它们的心肌细胞能够通过恢复到不成熟状态,然后增殖并替换受损的心脏组织[7]。然而,利用斑马鱼模型来增加对心力衰竭和心脏重塑(包括心脏肥大和增生)的了解,却没有得到应有的重视。本文将会系统回顾药物诱导斑马鱼心血管疾病模型的方法,并对其优缺点进行对比,以期为斑马鱼模型在研究人类心血管疾病机制和治疗中提供新思路。
1 斑马鱼作为人类疾病动物模型的优缺点
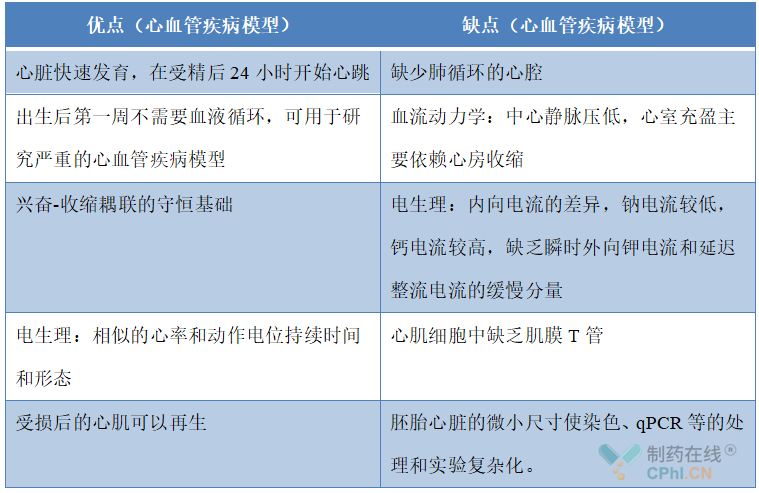
在过去的研究中,斑马鱼已经成为研究心脏疾病的一个强大的脊椎动物模型。越来越多地被用来研究发育、解剖和生理学,通过遗传学、药理学和其他医学实验技术[7],构建斑马鱼模型的优势越来越明显(表1)。斑马鱼作为心血管系统疾病的常用模型,也具有许多优点和缺点(表2),即便如此,斑马鱼的心肌细胞再生能力和电生理特点也使其成为在心肌损伤和心力衰竭治疗的重要突破口。
表1 斑马鱼作为人类一般疾病模型的优缺点
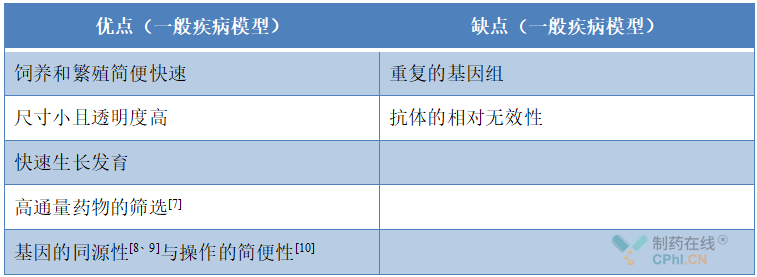
表2 斑马鱼作为人类心血管疾病模型的优缺点
2 药物诱导的斑马鱼心力衰竭模型
2.1 异丙肾上腺素
已知β-肾上腺素能受体(β-AR)信号在人类HF中失调。在啮齿类动物中,异丙肾上腺素 (isoproterenol, ISO, 又名喘息定) 的急性或慢性β-AR激活会导致心肌损伤,导致心脏功能障碍和心室重构,Grimm等[11]、Heather等[12]、Wang等[13]依据此建立了HF模型。在成年斑马鱼中,ISO连续给药14天会引起类似于哺乳动物的严重收缩性心脏功能障碍,伴随着β-AR成分的转录变化、ANP和BNP基因表达的增加、细胞死亡增加、炎症加剧和心肌细胞对Ca2+处理受损等[14]。然而,与哺乳动物模型不同的是,斑马鱼模型没有检测到心肌细胞的纤维化。在胚胎斑马鱼中,ISO连续给药5天诱导收缩性心脏功能障碍以及ANP和BNP基因表达的增加[14]。因此,给予胚胎和成年斑马鱼ISO刺激对于心脏肥大、心脏重塑和HF的病理生理机制的研究是可行的。
2.2 去氧肾上腺素
去氧肾上腺素(phenylephrine, PE, 又名新福林)是选择性α1 -肾上腺素能受体激活剂。Iaccarino等[15]给予小鼠PE会增加血压并通过增加心室后负荷导致心脏肥大。Romano等[16]用PE处理离体培养成年斑马鱼心脏会诱导其肥大。用鬼笔环肽染色的肌动蛋白和胚胎心外膜标记物WT1提示,经PE处理的离体成年斑马鱼心脏可诱导心肌细胞肥大和心外膜增生。这种离体培养成年斑马鱼心脏肥大模型类似于哺乳动物模型,因其实验条件简单,可能在某种程度上为研究心脏肥大提供优势。
2.3 马兜铃酸
马兜铃酸 (aristolochic acid, AA) 是一种常见于马兜铃科开花植物中的化学物质。AA是一种中草药成分,已知对多种器官有毒 性[17]。 在胚胎斑马鱼中,给予AA会导致心脏肥大和心肌收缩力逐渐减弱。这种病理变化是对动物模型及人类有严重生命危险[18]。取经AA处理的胚胎斑马鱼样本,进行石蜡包埋切片染色,电子显微镜镜检显示心内膜丢失、心肌细胞肥大和心脏纤维紊乱[17]。该作者还展示了该模型在药物发现方面的潜力,并确定了三种可减弱HF的化合物:丝裂原活化蛋白激酶1(MEK-1)、查耳酮衍生物C25和酚类化合物A11[19]。另一项使用相同AA诱导的HF模型的研究表明,使用恩格列净(一种钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂),用于治疗II型糖尿病和HF,减弱心脏形态变化,并降低ANP和BNP基因表达以及胚胎斑马鱼的死亡率[20]。
2.4 多环芳烃
污染导致的多环芳烃(polycyclic aromatic hydrocarbons, PAH)暴露与心脏病变有关,例如心脏肥大、心律失常和收缩功能障碍[21]。Hicken等[22]、Incardona等[23]在斑马鱼中,胚胎发育过程中接触多环芳烃也具有心脏毒 性,并对心脏发育产生不利影响。高环多环芳烃、苯并(a)芘 (benzoapyrene, BaP) 在高浓度下会导致心动过缓和心包水肿[23]。Huang等[18]说明胚胎斑马鱼发育过程中暴露于低剂量BaP会导致成年斑马鱼心脏肥大,表现为心脏重量与体重比增加、心脏中胶原蛋白沉积以及ANP、BNP和原癌基因c-Myc的表达升高。同样,胚胎斑马鱼短暂暴露于低浓度原油会影响后期的心脏功能[22]。
2.5 盐酸苯肼
盐酸苯肼(phenylhydrazine hydrochloride, PHZ)是一种小分子,Norman等[24]可通过裂解红细胞引起贫血。Sun等[25]证明慢性贫血导致成年斑马鱼的肥大和增生导致心脏肥大。Ernens等[26]给予成年斑马鱼PHZ 5周后,短轴缩短率降低,心室直径增加。然而,由于斑马鱼具有从HF中恢复的巨大能力,因此在停止给予PHZ 3周后,心脏功能恢复到给药前水平。因此,该模型可用于研究心脏修复机制。
2.6 维拉帕米
维拉帕米(又名异搏定)是一种钙通道阻滞剂,用于治疗心律失常、高血压和心绞痛。过量服用维拉帕米会导致人类HF。Zhu等[27]开发了一种用于药物筛选的维拉帕米诱导的胚胎斑马鱼HF模型。给予维拉帕米可引起胚胎斑马鱼心包水肿和静脉淤血,心输出量和血流速度降低[27]。该模型通过测试8种人类HF药物的疗效进行验证,这些药物对斑马鱼HF模型均显示出显着的治疗效果[27]。因此,这种胚胎斑马鱼HF模型可用于体内药物筛选。
2.7 托特罗定
托特罗定是一种M毒蕈碱受体拮抗剂,Burczyk等[28]已确定其为斑马鱼胚胎心脏传导的抑制剂。托特罗定治疗会导致心率减慢、心包水肿和心律失常。此外,它还诱导Tbx18基因的表达,这对于心肌细胞分化为起搏细胞至关重要。用托特罗定靶向抑制M受体可能会在人类心脏中诱导新的起搏细胞并改善心律失常起到一定作用[28]。因此,该模型可用于研究心脏传导系统。
2.8 特非那定
特非那定是一种常用的H1受体阻断药,用于治疗过敏。然而,特非那定治疗过敏是常常伴有发生心律失常的风险。Gu等[29]开发了特非那定诱导胚胎斑马鱼的扩张性心肌病DCM模型。给予特非那定后,胚胎斑马鱼表现出循环血量减少、心率和心肌收缩力降低、房室传导阻滞、心包水肿和心室体积扩大[29]。此外,心肌细胞发生凋亡,BNP基因表达增加。这种快速而简单的模型可用于非缺血性HF的药物筛选和毒 性测定。
2.9 蒽环类药物
蒽环类药物是常用的抗癌药物,具有严重的不良反应,这其中就包括严重的心脏毒 性。Han等[30]已经在胚胎斑马鱼中研究了蒽环类药物对心脏发育的毒 性,其对心脏的影响与哺乳动物模型相似。阿霉素是一种高效的蒽环类化疗药物,Liu等[31]利用阿霉素诱导胚胎斑马鱼的CM心肌病模型概括了人类患者中观察到的心肌细胞凋亡和收缩力下降。该模型可用于筛选心脏保护药物和研究心脏保护机制。
3 讨论
心功能不全分为两种类型,其一是常见于冠心病和心肌病等引起的心脏 收缩力降低[射血分数降低的心力衰竭 (heart failure with a reduced ejection fraction, HFrEF)],另一类是常见于高血压伴左室肥厚和肥厚型心肌病等引起的心肌舒张功能异常[射血分数保留的心力衰竭 (heart failure with preserved ejection fraction, HFpEF)][32]。根据流行病学调查,HFpEF正在成为HF的主要存在形式[33]。HFpEF的病因尚不完全清楚,并且缺少改善预后的药物。因此,在构建HF动物模型时,尽可能准确地表述不同的心功能不全类型非常重要。目前,斑马鱼HF模型在收缩或舒张功能障碍方面在很大程度上仍然没有主要特征。然而,随着超声动态心动图的发展和可用性,成年斑马鱼HF亚型的特征变得越来越普遍[34-36]。而在成年斑马鱼超声动态心动图中,建立一套完整标准化成像条件(麻 醉、水温等)指南和表征心脏功能的标准等对于HF亚型分型显得尤为重要。另外,目前胚胎斑马鱼HF模型在说明HF亚型分型中也有一定进展[37]。
随着心脏负荷的逐渐增大,心脏重塑也在缓慢发展。成人心肌细胞是终末分化细胞,不能随着压力的增大而数量增加。相反,心肌细胞的体积会发生代偿性增大(心脏肥大)来维持足够的心脏功能满足机体的需求。随着时间的推移,这种适应性肥大变得不适应并通过许多分子信号通路发展为HF,这其中的机制在很大程度上仍然不清楚[38、39]。目前已知这些导致心脏重塑的机制包括细胞生长和增殖调控、基因表达、免疫反应、细胞代谢、线粒体功能、纤维化、细胞内钙离子处理受损、细胞死亡等[40]。心脏肥大对机体是有益的还是有害的的问题目前仍不清楚[41]。与人类不同,斑马鱼的心脏能够通过心肌细胞增殖和细胞大小的增大(肥大)来应对心脏负荷的增大。而且胚胎斑马鱼心脏中心肌细胞数量和大小的量化相对简单。这使得斑马鱼成为研究代偿性与失代偿性心脏重塑具体机制的重要模型。
4 结论
本文系统回顾了药物诱导斑马鱼心血管疾病模型的方法。这对于斑马鱼作为人源化动物模型具有十分重要的意义,斑马鱼模型目前已用于体内高通量药物和药物毒 性的筛选、药物诱导的心脏毒 性研究,以及作为纳米颗粒载体对于机体的毒 性[42、43]。并且,在心电图中药物对QT间期的影响也显示出人和斑马鱼之间良好的相关性[44]。在胚胎斑马鱼HF模型中,用于治疗HF的药物已被证明可以预防急性HF[45]。另外,基于斑马鱼体积小、繁殖速度快等特点,一些物理构建模型的方法也有待探究。因此,相信在不久的未来,斑马鱼模型将会在各个领域为人类疾病的研究做出巨大贡献。
参考文献(References)
[1] Dokainish H, Teo K, Zhu J, et al. Global mortality variations in patients with heart failure: results from the International Congestive Heart Failure (INTER-CHF) prospective cohort study[J]. The Lancet Global Health, 2017.
[2] 王华,李莹莹,柴坷,张嵬,李新立,董吁钢,周京敏,霍勇,杨杰孚.中国住院心力衰竭患者流行病学及治疗现状[J].中华心血管病杂志,2019(11):865-874.
[3] Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA Guideline for the Management of Heart Failure[J]. Circulation, 2013, 128(16):1810-1852.
[4] Briceno, Natalia, Perera, et al. To Revascularise or Not To Revascularise, That Is the Question: the Diagnostic and Management Conundrum of Ischaemic Cardiomyopathy[J]. Current cardiology reports, 2016.
[5] G.E. Burch, T.D. Giles, H.L. Colcolough. Ischemic cardiomyopathy[J]. American Heart Journal, 1970.
[6] Stainier D, Raz E, Lawson ND, et al. Guidelines for morpholino use in zebrafish[J]. Plos Genetics, 2017, 13(10).
[7] Gut P, Reischauer S, Stainier DYR, et al. LITTLE FISH, BIG DATA: ZEBRAFISH AS A MODEL FOR CARDIOVASCULAR AND METABOLIC DISEASE.[J]. Physiological Reviews, 2017, 97(3):889-938.
[8] Barbazuk WB, Korf I, Kadavi C, et al. The Syntenic Relationship of the Zebrafish and Human Genomes[J]. Genome Research, 2000, 10(9):1351-1358.
[9] R, Arnaout, T, et al. Zebrafish model for human long QT syndrome[J]. Proceedings of the National Academy of Sciences, 2007.
[10] Howe DG, Bradford YM, Tom C, et al. ZFIN, the Zebrafish Model Organism Database: increased support for mutants and transgenics[J]. Nucleic Acids Research, 2013(D1):854-60.
[11] Daniela G, Dietmar E, Heribert S, et al. Development of heart failure following isoproterenol administration in the rat: role of the renin-angiotensin system[J]. Cardiovascular Research, 1998(1):1.
[12] Heather LC, Catchpole AF, Stuckey DJ, et al. Isoproterenol induces in vivo functional and metabolic abnormalities: similar to those found in the infarcted rat heart.[J]. Journal of Physiology & Pharmacology, 2009, 60(3):31-39.
[13] Wang J, Huertas-Vazquez A, Wang Y, et al. Isoproterenol-Induced Cardiac Diastolic Dysfunction in Mice: A Systems Genetics Analysis[J]. Frontiers in Cardiovascular Medicine, 2019, 6.
[14] Kossack M, Hein S, Juergensen L, et al. Induction of cardiac dysfunction in developing and adult zebrafish by chronic isoproterenol stimulation[J]. Journal of Molecular & Cellular Cardiology, 2017, 108:95-105.
[15] Iaccarino G, Keys JR, Rapacciuolo A, et al. Regulation of myocardial betaARK1 expression in catecholamine-induced cardiac hypertrophy in transgenic mice overexpressing alpha1B-adrenergic receptors.[J]. Journal of the American College of Cardiology, 2001, 38(2):534-540.
[16] Romano N, Ceci M. Are microRNAs responsible for cardiac hypertrophy in fish and mammals? What we can learn in the activation process in a zebrafish ex vivo model[J]. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease, 2020, 1866(11):165896.
[17] Huang CC, Chen PC, Huang CW, et al. Aristolochic Acid Induces Heart Failure in Zebrafish Embryos That is Mediated by Inflammation[J]. Toxicological Sciences, 2007, 100(2):486.
[18] Huang L, Gao D, Zhang Y, et al. Exposure to low dose benzo[a]pyrene during early life stages causes symptoms similar to cardiac hypertrophy in adult zebrafish[J]. Journal of Hazardous Materials, 2014, 276(9):377-382.
[19] Huang CC, Monte A, Cook JM, et al. Zebrafish heart failure models for the evaluation of chemical probes and drugs[J]. Assay and drug development technologies, 11(9-10), 561–572.
[20] Shi X, Verma S, Yun J, et al. Effect of empagliflozin on cardiac biomarkers in a zebrafish model of heart failure: clues to the EMPA-REG OUTCOME trial?[J]. Molecular & Cellular Biochemistry, 2017.
[21] Marris CR, Kompella SN, Miller MR, et al. Polyaromatic hydrocarbons in pollution: a heart‐breaking matter[J]. Wiley-Blackwell Online Open, 598(2).
[22] Hicken CE, Linbo TL, Baldwin DH, et al. Sublethal exposure to crude oil during embryonic development alters cardiac morphology and reduces aerobic capacity in adult fish.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(17):7086-90.
[23] Incardona JP, Linbo TL, Scholz NL. Cardiac toxicity of 5-ring polycyclic aromatic hydrocarbons is differentially dependent on the aryl hydrocarbon receptor 2 isoform during zebrafish development[J]. Toxicology & Applied Pharmacology, 2011, 257(2):242-249.
[24] Norman TD, Mcbroom RD. Cardiac Hypertrophy in Rats with Phenylhydrazine Anemia[J]. Circulation Research, 1958, 6(6):765-770.
[25] Sun X, Hoage T, Bai P, et al. Cardiac Hypertrophy Involves Both Myocyte Hypertrophy and Hyperplasia in Anemic Zebrafish[J]. Plos One, 2009, 4(8):e6596.
[26] Isabelle E, Lumley AI, Yvan D. Restoration of cardiac function after anaemia-induced heart failure in zebrafish[J]. Journal of Molecular & Cellular Cardiology, 2018, 121:223-232.
[27] Zhu XY, Wu SQ, Guo SY, et al. A Zebrafish Heart Failure Model for Assessing Therapeutic Agents[J]. Zebrafish, 2018:zeb.2017.1546.
[28] Burczyk MS, Burkhalter MD, Tena TC, et al. Muscarinic receptors promote pacemaker fate at the expense of secondary conduction system tissue in zebrafish[J]. JCI Insight, 2019, 4(20).
[29] Gu G, Na Y, Hyewon C, et al. Zebrafish Larvae Model of Dilated Cardiomyopathy Induced by Terfenadine[J]. Korean Circulation Journal, 2017, 47(6):960-969.
[30] Han Y, Zhang JP, Qian JQ, et al. Cardiotoxicity evaluation of anthracyclines in zebrafish (Danio rerio)[J]. Journal of Applied Toxicology Jat, 2015, 35(3):241-252.
[31] Liu Y, Asnani A, Zou L, et al. Visnagin protects against doxorubicin-induced cardiomyopathy through modulation of mitochondrial malate dehydrogenase[J]. Science Translational Medicine, 2014, 6(266):266ra170.
[32] Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. European Journal of Heart Failure, 2016, 18(8):2129.
[33] Dunlay SM, Roger VL, Redfield MM, et al. Epidemiology of heart failure with preserved ejection fraction[J]. Nature Reviews Cardiology, 2017, 14(10).
[34] Lee J, Cao H, Kang BJ, et al. Hemodynamics and ventricular function in a zebrafish model of injury and repair. Zebrafish. 2014;11(5):447-454. doi:10.1089/zeb.2014.1016.
[35] Ernens I, Lumley AI, Devaux Y, et al. Use of Coronary Ultrasound Imaging to Evaluate Ventricular Function in Adult Zebrafish[J]. Zebrafish, 2016:zeb.2016.1274.
[36] Wang LW, Huttner IG, Santiago CF, et al. Standardized echocardiographic assessment of cardiac function in normal adult zebrafish and heart disease models[J]. Disease Models & Mechanisms, 2016, 10(1):63-76.
[37] Chen YH, Pai CW, Huang SW, et al. Inactivation of Myosin Binding Protein C Homolog in Zebrafish as a Model for Human Cardiac Hypertrophy and Diastolic Dysfunction[J]. Journal of the American Heart Association, 2013, 2(5):e000231-e000231.
[38] Mcmullen JR, Jennings GL. Differences between pathological and physiological cardiac hypertrophy: novel therapeutic strategies to treat heart failure.[J]. Clin Exp Pharmacol Physiol, 2010, 34(4):255-262.
[39] Tham YK, Bernardo BC, Ooi J, et al. Pathophysiology of cardiac hypertrophy and heart failure: signaling pathways and novel therapeutic targets[J]. Archives of Toxicology, 2015.
[40] Lou Q, Janardhan A, Efimov I R.Remodeling of calcium handling in human heart failure.[J]. Springer Netherlands, 2012.
[41] Carabello BA. Is Cardiac Hypertrophy Good or Bad?: The Answer, Of Course, Is Yes[J]. JACC: Cardiovascular Imaging, 2014.
[42] Ke?ler M, Rottbauer W, Just S. Recent progress in the use of zebrafish for novel cardiac drug discovery[J]. Expert Opin Drug Discov. 2015;10(11):1231-41.
[43] Zakaria ZZ, Benslimane FM, Nasrallah GK, et al. Using Zebrafish for Investigating the Molecular Mechanisms of Drug-Induced Cardiotoxicity[J]. BioMed Research International, 2018, 2018:1-10.
[44] Milan DJ, Jones IL, Ellinor PT, et al. In vivo recording of adult zebrafish electrocardiogram and assessment of drug-induced QT prolongation[J]. American Journal of Physiology, 2006, 291(1):269-273.
[45] Zhu XY, Wu SQ, Guo SY, et al. A Zebrafish Heart Failure Model for Assessing Therapeutic Agents[J]. Zebrafish, 2018:zeb.2017.1546.
作者简介:@任哲郯,男,中共预备党员,锦州医科大学第一临床医学院2019级临床医学专业8班班长。参与省部级科研项目7项,发表学术论文6篇。立志为祖国医学事业贡献青春力量。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57