小核酸药物是近年来新药研发关注度极高的一个领域,凭借其独特的技术特点,为满足尚未满足的临床需求提供了一个重要的研究方向,尤其是针对数量庞杂的罕见病领域。然而,由于其技术要求高,国内大部分药企尚不能对其进行常规程序的开题立项,本文就其技术特点进行总结,以期对行业同仁有所帮助。
小核酸药物概念
RNA干扰(RNA interference,RNAi)是指小RNA(small RNA,sRNA)分子通过抑制靶向mRNA的染色质修饰或降低其稳定性或翻译的潜力,在转录时或转录后以序列特异性方式沉默靶基因表达的一种生物学过程。
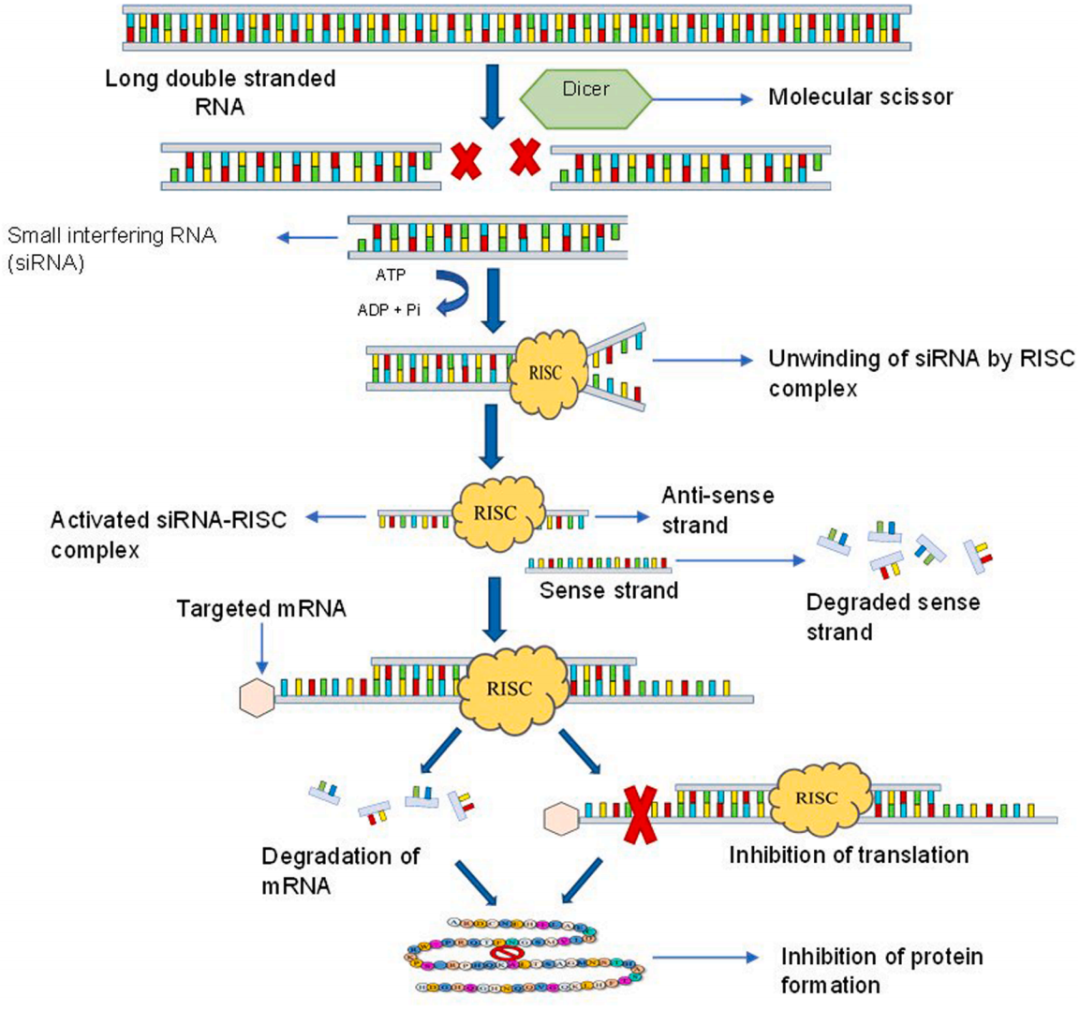
图1 SiRNA 干扰机制
图片来源:doi.org/10.1016/j.onano.2022.100063
小核酸药物狭义是指RNA小干扰药物(small interfering RNAs,SiRNA);广义是除了SiRNA外,还主要包括反义寡核苷酸药物(antisense oligonucleotides,ASOs)和靶向微小RNA(microRNA,miRNA)等。全球的药物开发重点主要为SiRNA和ASO。
表1 小核酸药物分类&具体解释

已上市的小核酸药物
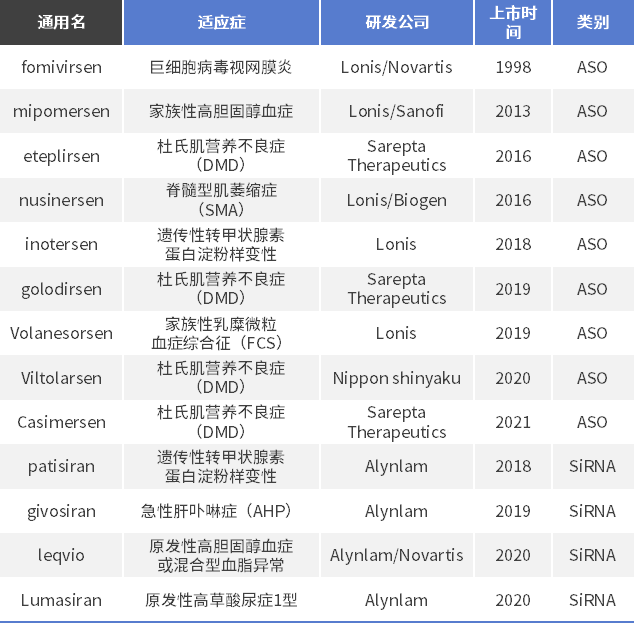
如上所述,小核酸药物开发相对较为成熟的领域当属SiRNA和ASO,截止目前,这两个领域已有合计超过13个品种获批上市,其中ASO品种数量约为SiRNA数量的2倍。

图2 RNA干扰发现&siRNA开发-时间表
图片来源:doi.org/10.1016/j.onano.2022.100063
适应症方面,由于这类药物是从基因的角度出发,更多的侧重于罕见病的治疗,如杜氏肌营养不良症(DMD)、脊髓型肌萎缩症(SMA)等等。
开发公司方面,2家公司获批的品种相对较多,即Ionis和Alynlam。部分药物具体信息如下表所示。
表2 全球上市的小核酸药物(SiRNA&ASO)
小核酸技术开发难点
小核酸药物从物质基础来看,更多的介于小分子化学药物和生物药物之间,略偏于小分子药物,一定程度上与多肽药物相近,且多为注射剂。在CDE发布的《新药I期临床试验申请技术指南》中,药学研究-制备工艺部分曾提到“对于采用发酵工艺、提取工艺制备以及多肽、小分子核酸药物等,需要提供更多的制备工艺信息。”
但不同于小分子化学药物特点的是,小核酸药物在人体循环系统中容易被血液核酸酶降解,稳定性较差,那么,如何修饰,如何给药,如何递送到具体靶标,是技术难点。基于此,主要可以从以下几个方面着手。
➣ 结构修饰
通过掺入非天然核酸分子的方法抵抗血液核酸酶的降解,增加其血液稳定性,延长药物的体内半衰期。但,非天然核酸分子本身显著的细胞毒 性也有可能引起毒副作用。这一点,与多肽药物的开发非常相近。
➣ 输送载体
体内输送载体主要分为病毒载体和非病毒载体。病毒载体虽输送效率高,但因自身难以克服的缺陷而限制了其用于核酸药物输送体系;非病毒载体具有联通靶细胞内外两个不同环境的生物学壁垒、同时又不影响正常组织细胞、且能定向寻找并到达病灶、及时释放药物的优点,目前研究较多。
小核酸药物的开发
药物开发,从药学、非临床、临床进行说明。
➣ 药学方面
由于小核酸药物的制备,通常使用固相合成技术,故工艺开发、工艺放大和质量控制上存在一定的壁垒,对技术、设备、环境有较高的要求,伴随着的也是高成本,国内对于这方面的硬件条件配套,还有很大的发展空间。早期的注册申报,如果按照《新药I期临床试验申请技术指南》进行工作开展,原料药和制剂需要按照以下内容进行。
表3:《新药I期临床试验申请技术指南》相关内容


➣ 非临床方面
国内有研究对已上市的部分小核酸药物进行了非临床相关内容的总结。药效方面,开展体外、体内两个方向,但药效试验数量相对于小分子化药开展的数量明显少了一些。药动方面,开展具体的吸收、分布、代谢、排泄,罗列了部分试验,但试验数量也是相对不多。毒理方面,开展了单次、多次、安全药理、遗传毒、生殖毒、致癌,以及一些特殊毒 性试验。举例举例如下。

图3 部分小核酸药物非临床试验项目总结
图片来源:CNKI-小核酸药物非临床特点和药理毒理评价策略
➣临床方面
大部分小核酸药物的临床开发,大都经历在10年以上,且真正意义上完成的临床试验数量,相对于当先传统的药物开发,数量不是很多。以leqvio已完成的临床试验举例,具体如下。
表4 leqvio已完成的临床试验信息

结 语
上文简述了小核酸药物全球开发背景及技术特点,进一步总结如下:1)全球药物开发正在增速,国内市场空间极大,尚未有自研品种获批上市;2)独特的作用机制,催生了特殊的技术特点,基础研究尚需积累;3)临床前开发会成为短期瓶颈,国内市场空间巨大;4)在多肽药物开发的基础上开展工作,理论上会有质的增速,是很好的产品线扩充方法;5)研发投入成本会相对高一些,故是否跨入到这个领域,须基于资本管理进行综合考量。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57