介绍
脂质体最早在1965年由Bangham等人首次发现并描述。其基本结构是:由磷脂双分子层膜所形成的囊泡,其内部包裹着水性核心。图1显示了一个单室脂质体的形成过程及其基本结构。
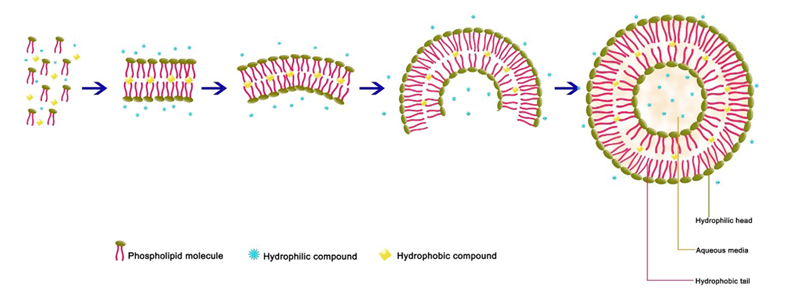
图1:脂质体的结构和形成
由于脂质体的两亲性,亲水和疏水的药物均能高效地载入到脂质体中。脂质体倾向于将水溶性药物包裹在中心水相中,而将脂溶性药物包裹在双分子膜间的区域。
同时,由于生物膜的基本结构也是磷脂双分子层膜,因此脂质体具有良好的生物相容性和生物可降解性。脂质体进入人体内部之后会作为一个“入侵者”而启动人体的免疫机制,被单核吞噬细胞系统(Mononeuclear Phagocyte System,MPS)吞噬,从而在肝、脾、肺和骨髓等组织中靶向性地富集,这是脂质体的被动靶向潜能。
另外,脂质体还能提供更好的药动学特性,延长药物在体内的循环时间,提高药物的疗效。综合以上特点,脂质体作为药物递送系统有广阔的发展空间。
脂质体的组成
用于药物递送的脂质体主要由磷脂(甘油磷脂和鞘磷脂)构成其基本骨架。图2是甘油磷脂和鞘磷脂的基本结构:
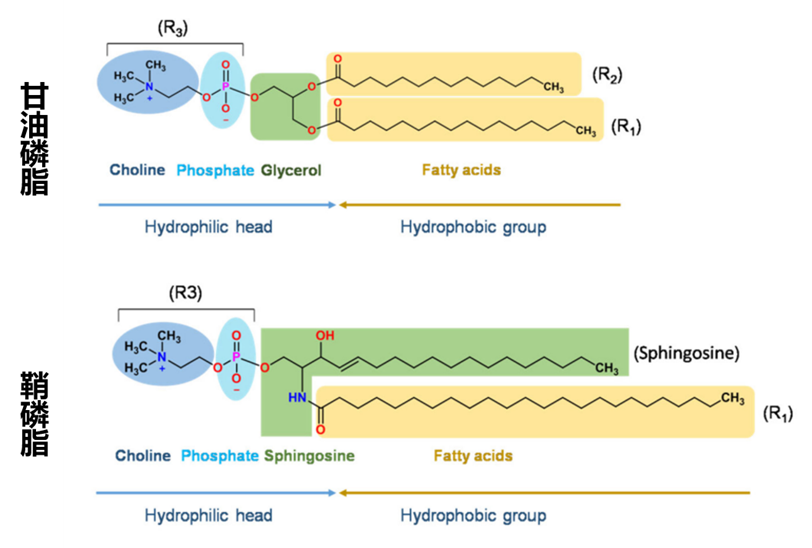
图2:甘油磷脂和鞘磷脂结构示意图
鞘磷脂和甘油磷脂结构相似,性质基本相同。这些脂质是两亲性分子,都拥有亲水的头部和疏水的尾部区域。在水性环境中,磷脂分子在疏水相互作用力和其他分子间相互作用力的驱动下,自发排列成脂质体。
除磷脂外,胆固醇几乎会被添加到所有脂质体中。其作用为:促进脂链的堆积和双分子层的形成、降低双分子层的流动性、减少水溶性药物的跨膜转运。不仅如此,胆固醇还能减少脂质体与体内蛋白的相互作用,减少磷脂的流失,从而提高脂质体的稳定性。另外,寡聚糖、壳聚糖、藻酸盐、乳清蛋白等也能作为膜材添加到脂质体中,提高其稳定性并调控药物的释放。
脂质体中还可能添加必要的抗氧剂(如维生素E)、金属离子螯合剂(如EDTA)等,防止脂质或药物的氧化。
在脂质体表面进行特殊的修饰能提高其功能性,最常见的是PEG修饰。PEG是一种亲水、柔韧的高分子,能阻止调理素吸附到脂质体表面,从而减弱调理作用,减少单核吞噬细胞系统(MPS)的吞噬,达到长循环的目的。
脂质体的分类
根据脂质体的膜层数和粒径大小,可以将脂质体分为以下几类,如图3所示。
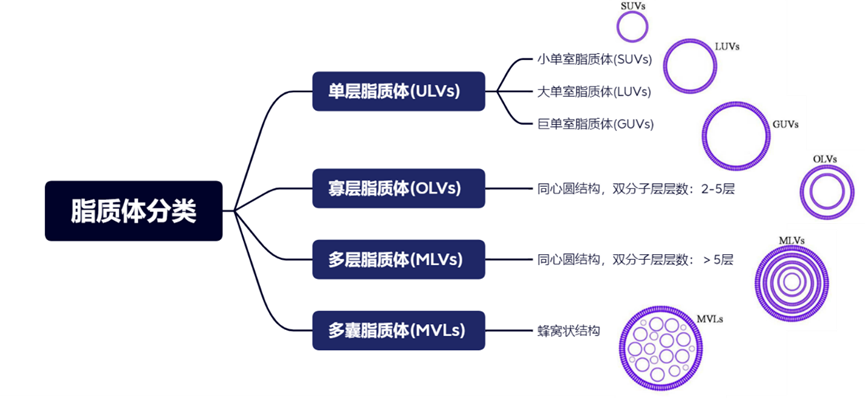
图3:脂质体的分类及其结构
目前已上市的脂质体产品包含上图中的多种结构,其中多数为小单室脂质体(small unilamellar vesicles, SUVs)。
脂质体常用制备方法
制备脂质体主要是利用两亲性磷脂在溶剂中的自发排列。脂质体形成的关键点是温度:必须在脂质的相转变温度Tg以上。而形成的脂质体的粒径和双分子膜层数、粒径、粒径分布则受制备方法、脂质类型、脂质组成、表面活性剂、有机溶剂以及分散介质的离子强度影响。目前,常见的脂质体制备技术有以下几种。
1 薄膜水化法
制备过程:将形成脂质体的膜材,如磷脂和胆固醇,溶解到有机溶剂中;利用旋蒸将有机溶剂除去,得到脂质薄膜;然后将薄膜与溶解有待包载药物的缓冲液充分振荡水化,从而形成脂质体。水化的温度应大于脂质的相转变温度(Tm)。
缓冲液体积、水化时间会影响形成脂质体的结构以及药物的包封率。由薄膜水化法制备的脂质体通常为多层脂质体(MLVs)。可通过施加机械力的方法将多层脂质体(MLVs)转化为大单室脂质体(LUVs)或小单室脂质体(SUVs),如挤出和超声。挤出法是将脂质体滤过特定孔径的薄膜,必要时应保证挤出温度大于Tm。挤出法能够得到更均一的脂质体,且整个过程相对温和,适用于不稳定的药物。且相比于超声法,挤出法得到的脂质体拥有更好的长期稳定性。而超声法虽然过程简单,但可能造成脂质体或药物的降解,且得到的脂质体均一度差。
2 反向蒸发法
制备过程:将溶有膜材的有机相(常用的为乙 醚和异丙醚,溶解度差时可加入适量氯仿或甲醇)和缓冲液混合并短暂超声2-5min,直至形成油包水型乳液;将乳液初步减压旋蒸得到胶状物;继续旋蒸即可得到脂质体;此时可加入缓冲液或水相继续旋蒸(非必要),除去痕量的有机溶剂。
反向蒸发法的特点是制备的脂质体具有更大的水相-脂质比,即其包裹的中心水相体积更大,适合包载蛋白质或DNA、RNA等大分子药物;此法的缺点是需要使用有机溶剂,且短暂超声可能造成脂质或药物降解。
3 注入法
制备过程:将膜材和药物溶解在有机溶剂中,然后将油相匀速注入到水相(可能含水溶性药物)中,持续搅拌,利用搅拌产生的涡流促使脂质排列形成脂质体。最后通过低压蒸发、透析或过滤除去有机溶剂。
注入法常用的有机溶剂包括乙 醚和乙醇。乙 醚沸点较低,当温度高于乙 醚沸点时,乙 醚易除去,主要形成大单室脂质体。而乙醇沸点较高,可用透析或过滤法除去。注入法适合制备大批量的脂质体,但所得脂质体的粒径分布较宽。
4 洗涤剂除去法
制备过程:将膜材(磷脂、胆固醇)和洗涤剂(如胆盐等,用量远高于临界胶束浓度)共同加入到有机溶剂中溶解并旋干;将旋干得到的脂膜加入到缓冲液中水化;水化过程中膜材和洗涤剂会形成混合胶束(此时,混合胶束、纯洗涤剂胶束、游离洗涤剂共存);通过透析、尺寸排除色谱或稀释法等方法除去洗涤剂,洗涤剂除去的过程中,混合胶束中的洗涤剂会不断释放,造成混合胶束融合变大,逐渐形成有曲率的混合双分子层,最后形成脂质体。其形成过程如图4所示。
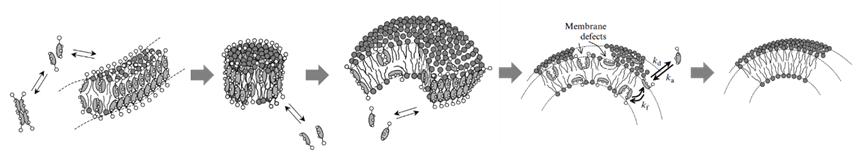
图4:洗涤剂除去法脂质体形成过程
该法优点为制备得到的单室脂质体具有极好的粒径均一性;缺点为使用大量洗涤剂会增加制备的成本,也可能引入额外的杂质。
5 冻融法
冻融法一般作为脂质体制备的一个补充。将冻融循环加入到脂质体合成过程中能改进脂质的堆积,形成单室脂质体。基本过程是将形成的脂质体放在液氮中冷冻,形成的冰晶将脂膜戳破,然后在冰晶融化的过程中,破碎的脂膜重新融合形成新的脂质体。
6 脂质体的放大生产
实验室制备不同性能的脂质体并不难,但工业化大量制备的技术却屈指可数,并且他们的使用受到工艺及待包封药物的限制。因此脂质体工业化生产线设备一般需要根据产品来定制。在生产过程中,药物会受到机械力或者化学压力的影响,不适用于对这些压力敏感的药物分子。工业生产的困难指数较高是制约脂质体应用的因素之一。
脂质体载药方法
脂质体的载药方法主要包括被动载药法和主动载药法。
被动载药法指在脂质体制备过程中,药物溶解在有机相或水相中,在脂质体形成的同时将药物载入到脂质体中。
主动载药法指调节调节脂质体内外水相的pH值,形成一定的pH梯度差,弱酸或弱碱药物则顺着pH梯度,以分子形式跨越磷脂膜而使以离子形式被包封在内水相中,也称pH梯度法。
其中,硫酸铵梯度法和醋酸钙梯度法是pH梯度法的两种发展形式,两种方法分别适合载弱碱性和弱酸性药物。
1 硫酸铵梯度法
首先利用硫酸铵溶液为水相制备空白脂质体,然后除去外水相中的硫酸铵,此时脂质体内水相和外水相形成硫酸铵浓度梯度。内水相中的NH4+易分解成NH3和H+,NH3易透过双分子层溢出,而H+被困在内水相中,因此内水相中的pH不断下降,形成酸性环境。分子态弱碱性药物进入内水相之后变成离子,并于硫酸根成盐,跨膜能力降低,药物便能在脂质体内部累积。
2 醋酸钙梯度法
原理与硫酸铵梯度法类似,利用醋酸的跨膜能力远大于钙离子,醋酸将质子带出脂质体,形成碱性的内水相,弱酸性药物进入脂质体后形成离子并累积。
脂质体的稳定性
脂质体的稳定性问题是制约其成为药物递送系统的一大因素。下面将从物理、化学、生物学三个角度介绍脂质体的稳定性。
1 物理稳定性
脂质体是一种球形小囊,为了维持其结构的完整性,必须保持脂质体内部和脂质体之间各种相互作用力的平衡,如:极性头部、溶剂系统、脂质体内所载成分之间静电相互作用必须与碳氢链之间的疏水相互作用和范德华力相平衡。
脂质体是一种热力学不稳定的胶体系统,纳米级的小囊有凝聚、絮凝的倾向,表面电荷会影响脂质体的聚集行为。一般来说,中性的脂质体更容易聚集甚至融合,而带电的脂质体在静电作用下能保持分散。载药量、磷脂的种类、甾醇的种类以及高分子的包合均会对脂质体的物理稳定性产生影响。
2 化学稳定性
脂质体主要面临的化学稳定性问题主要是氧化和水解。脂质体的骨架——磷脂中含有大量对氧化和水解敏感的官能团,如不饱和双键和酯基。
一般来说,磷脂中的不饱和部分比饱和部分更容易被氧化。因此与不饱和磷脂相比,饱和磷脂能提供更好的稳定性且有较高的玻璃化转变温度。如果所制备的脂质体中必须要有不饱和链,那么不饱和度越低越好,一般来说,像十八烯酸这样的单不饱和酸就能满足需求。脂肪酸的氧化是一种自由基链式反应,不需要特定的氧化剂,因此只要存在痕量的金属离子或存在的氧形成了过氧化氢便会引发这种氧化反应。为了避免氧化的发生,应避免原材料中含有金属离子或过氧化氢、低温贮藏、避免光照。加入抗氧剂如维生素E或BHT也能减慢脂质体的氧化。
脂质体中的酯键也容易发生水解,为了防止水解的发生,一般可以将液态脂质体通过冷冻干燥以固态的形式保存。加入胆固醇也能减慢脂质体的水解(主要是空间位阻效应)。另外温度、pH、离子强度、缓冲液种类、聚集状态、头部集团以及烷烃链的长度都会影响脂质体的水解,需特别考察。
3 生物学稳定性
脂质体的生物学稳定性受多种因素影响,包括给药途径、载体分子、制备方法、脂质组成、表面性质、形貌、载药方法及其他物理化学性质。有研究表面在脂质体中添加适量的鞘磷脂作为骨架能够明显提高脂质体的稳定性,延长循环时间。PEG化也是提高脂质体循环时间的方法:一般认为,吸附在纳米粒表面的PEG能够与水结合形成水化层,阻碍了PEG被MPS清除。
总结与展望
自1995年第一个脂质体产品Doxil?上市以来,经FDA和EMA批准上市的脂质体产品依然有限,其主要原因是脂质体尚存在一些缺点限制其使用。如有些药物载药量偏低、稳定性差、生产成本高、潜在的毒副作用等。
采用脂质体作为药物递送平台必须考虑支出和收益之间的平衡,能制成普通注射液的产品一定不会制备成脂质体,除非能明显提高药物的治疗指数。因此,这就讲究脂质体与药物之间的契合度。随着生物药的崛起,对于递送蛋白质、核酸分子的需要日益增多,这种“契合”的场景也会越来越多。由于这些大分子在体内尤其不稳定,很快会被降解、清除。而以脂质体为载体,能明显延长药物在体内的循环时间,提高药物向细胞内的递送,提高疗效。因此,我们有理由相信脂质体和生物药的结合,将给药物发展带来更多新的可能性。
参考文献:
1.Liu P, Chen G, Zhang J. A review of liposomes as a drug delivery system: current status of approved products, regulatory environments, and future perspectives[J]. Molecules, 2022, 27(4): 1372.
2.Large D E, Abdelmessih R G, Fink E A, et al. Liposome composition in drug delivery design, synthesis, characterization, and clinical application[J]. Advanced Drug Delivery Reviews, 2021, 176: 113851.
3.Maritim S, Boulas P, Lin Y. Comprehensive analysis of liposome formulation parameters and their influence on encapsulation, stability and drug release in glibenclamide liposomes[J]. International journal of pharmaceutics, 2021, 592: 120051.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57