1946年夏天,美国马纳斯宽河畔。
5岁的巴里·夏普莱斯,高兴地向大家展示自己人生中钓到的第一条大鱼。
那时候,他的梦想是可以拥有自己的渔船,出海钓上一条稀世罕见的腔棘鱼。
他一定没想到,日后虽然没有实现做渔夫的梦想,却从数十亿分子中,“钓出”了新药这条“大鱼”。
时间来到2022年10月,81岁的巴里·夏普莱斯,与其他两位科学家,获得了2022年诺贝尔化学奖,以表彰他们在发展点击化学和生物正交化学方面的贡献。
这已经是他第二次获得诺贝尔化学奖。
那么,点击化学和生物正交化学研究为何能获得诺奖?点击化学如何助力DNA编码化合库(DEL),改变药物研发?
DNA编码化合库起源
30年前,由Scripps研究所的化学家勒纳(Richard Lerner)和同事、2002年诺贝尔生理学或医学奖的获得者希布伦纳提出的DNA Encoded Library(DEL,DNA编码化合库)概念受到了高度关注。
勒纳回忆说,他和希布伦纳在讨论化学和生物学之间的区别时,提出了这个概念。
药物和天然产物等小分子与生物分子的不同之处,在于它们不以代码的形式携带信息。
“小分子不会告诉你他们是谁,其次,他们不会复制。”
小分子可以通过在化学合成的每个步骤后将一段DNA连在基团上,从而赋予每个分子可复制的身份。
直到20世纪90年代末,科学家还设想了一些替代的编码策略。
但DNA的选择性扩增能力,极大地促进了DNA编码化合库的筛选。
因此,在2000年代初,DNA组合化学经历了一次复兴,分叉出几个独立的平台。
比如能够进行分子进化的DEL平台,得益于使用商业可购买的试剂,能够直接生成大量化合库。
比如在2017年,丹麦生物制药公司Nuevolution宣布它已经创建了一个包含40万亿个独特分子的库——这很可能是世界上最大的合成化合物集合。
DNA编码库让研究人员可以在一个简单的实验中筛选数百万、数十亿甚至数万亿种化合物,这要归功于一个DNA标签,该标签对库中每个组件的制作方式进行了编码。
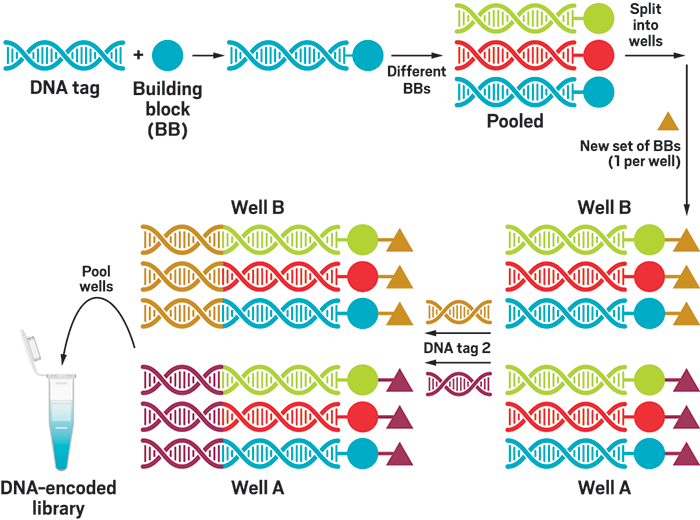
图1 在一个2毫升试管中建造含有40亿DNA编码化合物的示意图
图源:C&CN杂志
哈佛大学和Broad研究所刘如谦教授(David Liu)开发的DNA模板合成平台(DTS)可以编程有机小分子和聚合物的化学反应。
通过这个平台发现了几个具有生物活性的合成小分子家族,例如与癌症有关的激酶抑制剂和糖尿病相关的胰岛素降解酶(IDE)抑制剂。
顺便一提,刘教授最近还开发了一种全新的精准基因编辑工具:
先导编辑(Prime Editor,PE)自然杂志评论这一技术是“超精确的新型基因编辑工具”,科学杂志评论它是“超越CRISPR”的重大突破。有机会下次再聊。
言归正传,筛选DNA编码化合库涉及将药物靶标暴露于该化合物分子库。
不结合的分子被冲走,而那些结合的小分子被放大和测序。
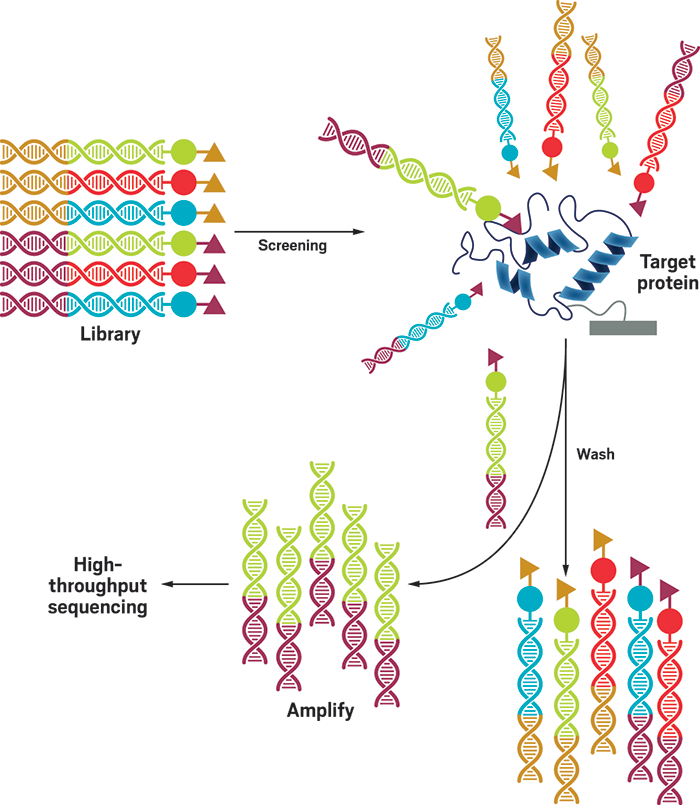
图2 使用DEL平台筛选药物的示意图
图源:改编自ChemMedChem论文
勒纳说:“天文数字的化合物一直是有机化学中识别身份的老大难问题。”
但通过DNA编码技术,科学家们可以获取大量分子,并为每个分子赋予一个携带信息的识别标记。
点击化学助力DNA
编码库突破技术痛点
点击化学,是夏普莱斯1999命名的一种非常强大的技术,可用于快速有效地进行分子实体的共价结合,通过简单高效的几个化学反应快速建立新的化学空间。
叠氮化物和炔烃基团可以很容易地引入生物相关的有机结构支架中。
这些基团对其他生物底物(如脂质、蛋白质和核酸)的大多数功能部分没有影响,因此可以认为是生物正交相容的。
然而,四十多年来,叠氮化物和炔烃反应的应用受到高温、耗时长和特异性差等限制发展缓慢。
两度获得诺奖的夏普莱斯教授通过引入铜作为催化剂解决了这些限制。
“点击化学”操作简单、易模块化并且生物相容性良好,迅速引起了大家对叠氮化物-炔烃环加成(AAC)在DNA编码库合成领域应用的兴趣。
因为叠氮化物和炔烃基团易于修饰和生物相容的优点,相对于以前使用的酶促技术,可以更高效地对DNA进行标记、连接和环化。
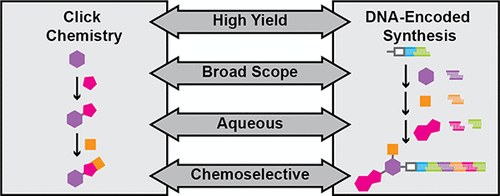
图3 点击反应满足了DNA编码库(DEL)所需的关键:容易制造但结构多样
图源:文献整理
成功案例
葛兰素史克公司将其化合物GSK2982772(源自DNA编码化合库)推进到银屑病、类风湿性关节炎和溃疡性结肠炎患者的二期临床试验。
GSK2982772抑制RIP1激酶,这是一种与炎症有关的酶。
为了开发RIP1激酶抑制剂,葛兰素史克的科学家们首先筛选了该公司的一组已知激酶抑制剂,但他们虽然找到了如图所示的许多II型(DFG-out)抑制剂。
由于高亲脂性、低溶解度和一系列脱靶活性,不适合继续研发。
接着,使用随机筛选的方法筛出GSK963,但不适合口服。
于是,GSK公司采用的最后一种方法是针对其内部的含有77亿化合物的DNA编码库筛选RIPK1抑制剂,结果找到了苗头化合物GSK481,接着通过传统药物化学方法,最终将GSK481的异恶唑换成了三唑,得到了临床候选药物GSK2982772。
GSK团队随后的研究发现优化的化合物GSK2982772,对所有339种测试激酶的选择性超过一万倍。
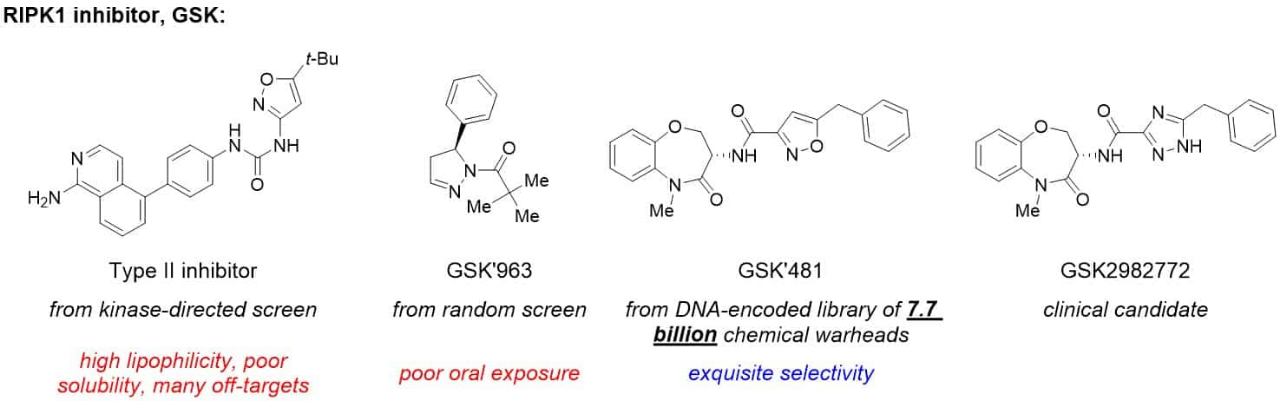
图4 GSK筛选出的化合物结构及简介
图源:文献整理
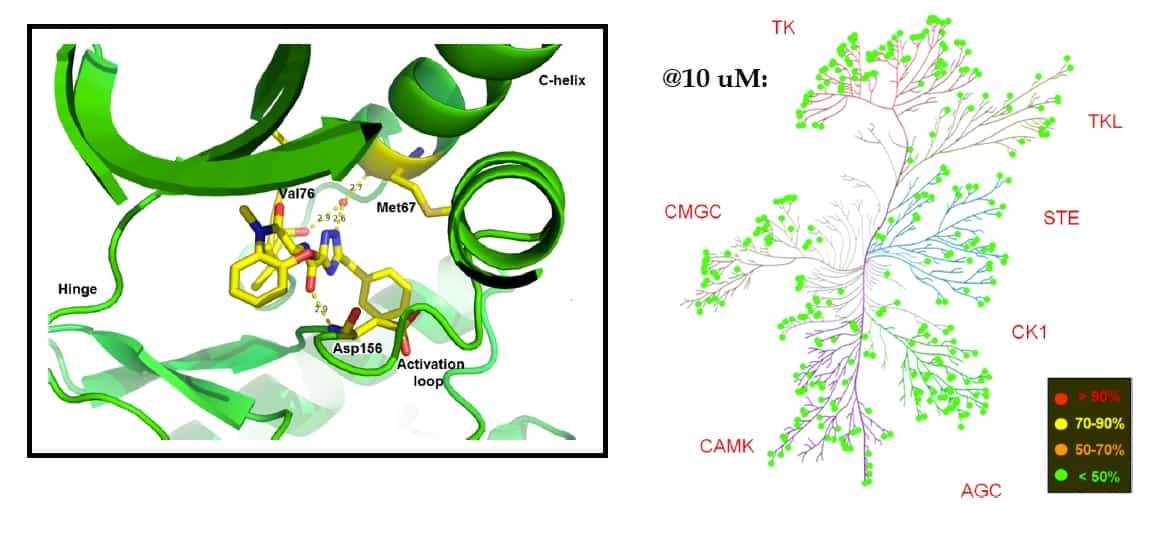
图5(左)GSK2982772以类似激酶抑制剂III型的方式与ATP结合位点结合,占据变构口袋,同时不与RIPK1的铰链区相互作用。
(右)GSK2982772对RIPK1具有极强的选择性,在10 uM浓度抑制剂测试中对任何其他激酶的抑制小于50%。
图源:论文整理
DEL面临的机遇和挑战
据估算传统合成100万个化合物的高通量筛选化合库的成本在24亿到180亿人民币之间,大约每个化合物6,600元。
另一方面,一个包含8亿种化合物的DNA编码化合库的成本约为70万人民币——每个化合物约0.0012元。
这使得DNA编码化合库成为小公司、初创药企或大学实验室的一个很好的起点,他们还没有大量的高通量筛选库可供使用。
但即使有成本节约和化学空间的大规模扩展,该技术并不是万金油。
该技术还是对现有方法的补充,它并不比高通量筛选好,只是一种不同的方式。
理想情况下,新药开发团队会想要两者都做。
尽管DNA编码化合库具有革命性的地位,但它们并非没有挑战。化学家经常想知道附着在化合物上的巨大的DNA条形码是否会干扰它与靶标的结合方式。
另一个限制是,任何用于构建DNA编码化合库的化学物质都必须能够耐受水,因为DNA需要水溶液。
反应条件还必须保持DNA完整,受损的DNA无法扩增或测序。DEL发展也不是一帆风顺,当古利耶夫(Alex Haahr Gouliev)2000年刚创办Nuevolution公司时,制药公司和风险投资家会告诉他,合成这么大的库没有意义。
投资人问:“你不知道组合化学已经失败了吗?而且小分子连接着DNA会极大地限制你的化学反应,以至于你无法制造出我们感兴趣的分子。”
的确,由于90年代组合化学的失败,许多人对DNA编码化合库持怀疑态度。
而克服怀疑的最好方法是用事实,过去十年的成果再加上相关技术的突破,DEL平台有了也迎来飞速发展。
下面就简单介绍一下企业布局的情况。
国内外企业布局
2017年,安进和丹麦Nuevolution签署了一项合作协议,前者使用后者的DNA编码库来搜索针对肿瘤学和神经科学中多个靶点的候选药物。
GlaxoSmithKline是DNA编码文库技术的全球领导者,与Warp Drive Bio建立了合作伙伴关系,以创建一个针对以前被认为是“无药可救”的目标的文库(听上去很像PROTAC)。
专注于DNA编码文库的成都先导已与强生公司、默克公司、辉瑞公司建立合作伙伴关系,就在最近成都先导与丹麦和韩国背景的国际药企Contera宣布达成针针对罕见神经系统疾病的新药研发(CP-301)战略合作。
成都先导是DNA编码化合库(DEL)技术领域的佼佼者之一,据官网报道目前已有4个项目获得临床试验批件并进入临床试验。
另一家专门研究DNA编码文库的公司X-Chem Pharmaceuticals宣布将与Vertex Pharmaceuticals合作。
诺华宣布使用DEL技术将其化合物收集量从300万个增加到3亿个。2018年药明就推出了WuXi DEL和技术平台,用来筛选小分子苗头化合物。
随后药明联合哈佛大学、麻省理工学院、斯坦福大学、牛津大学、Scripps研究所、Salk研究所等顶 尖学术研究机构共同发起DELopen平台,面向学术界免费提供一定数量的DEL化合库,而学术界将寻找潜在的成药靶点,共同快速有效地找到有成药潜力的化合物。
小结
尽管存在这些挑战,DNA编码化合库在药物发现方面正在取得进展,工业界和学术界的科学家们认为它们在未来的研究工作中变得更加不可或缺。
一切才刚刚开始。
参考文献:
1、核酸点击化学的搭便车指南
2、DNA编码化学:从几个好的反应中发现药物
3、DNA编码库如何彻底改变药物发现
4、RIPK1选择性抑制剂GSK2982772的故事
5、药时代:黎健博士|分子海洋钓鲸鲲一一记诺贝尔化学奖得主夏普莱斯(K.Barry Sharpless)教授



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57