桑尼赛尔生物医药(Sunnycell Therapeutics LTD)12月11日公布其候选细胞药物SC-gtCAR19治疗复发/难治B细胞急性淋巴白血病(r/r B-ALL)的安全性和有效性长期随访结果,该结果于美国中部时间2022年12月10日第64届美国血液学会年会(ASH)上正式公布。本次临床结果以壁报形式展出,该临床试验是一项于2020年初开展的研究者发起的临床研究,旨在评估桑尼赛尔基于“非病毒定点整合平台技术(Non-viral genome targeting chimeric antigen receptor, gtCAR®)”开发的首 个候选药物的临床表现。
该临床研究招募22位复发、难治的B细胞急性淋巴白血病患者,利用gtCAR®技术100%制备成功anti-CD19 gtCAR-T细胞制品,所有患者回输了SC-gtCAR19,并符合安全性和有效性的评估。患者50%为男性,中位年龄为29岁(范围:13-61),4例患者(18%)为费城染色体阳性。预处理后骨髓原始幼稚B淋巴细胞(Bone Marrow Blast, BM blast)中位比例为44.1%(范围:0.3-99%),其中73%的患者为高肿瘤负荷(BM blast>25%)。患者既往接受的化疗中位数为5(范围:2-16),5例患者(23%)为自体或异体移植后复发,1例患者乳腺处髓外病变。14例患者(64%)有B-ALL相关预后不良基因。所有患者均接受了标准环磷酰胺和氟达拉滨的化疗预处理。回输剂量中位为3.89x106 CAR+ cells/kg(范围:0.58-8.31x106 CAR+ cell/kg)。不良事件根据常见不良事件评价标准CTCAE V5.0分级;细胞因子释放综合征(CRS)和神经毒 性(NE)根据美国移植与细胞治疗学会ASTCT共识分级。复发定义为骨髓中检见原幼淋细胞或B-ALL相关基因突变检测为阳性,以及患者发生髓外病变(Extramedullary disease,EMD)。
表1: 患者基线特征
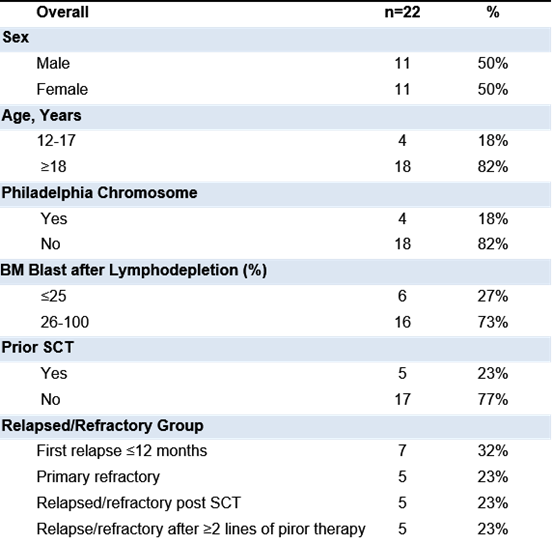
安全性方面,30天治疗期期间,最常见的不良事件为贫血(100%),发热(91%),中性粒细胞计数减少(91%)和白细胞计数减少(86%)。20例患者(91%)出现了细胞因子释放综合征,其中4例(18%)为3级CRS。任意等级的CRS发生中位为第7天(IQR 7-10),中位持续时间为3天(IQR 2-5)。3例患者(14%)出现神经毒 性,其中2例(9%)为3级NE(患者出现短暂癫痫,与患者入组前出现的感染和脑梗塞相关,与试验药物SC-gtCAR19不相关)。任意NE发生中位时间为第8天(范围:3-12天),持续时间为1天。无患者使用托珠单抗,无威胁生命的不良事件发生,无患者死亡。
表2:不良事件无论与试验药物是否相关
表3:细胞因子释放综合征

表4:神经毒 性

截至2022年10月1日,中位随访时间为25个月(范围: 4.5-31.7个月)。回输后30天,客观缓解率(Objective response rate, ORR)为100%,其中19例患者(86%)达到完全缓解或完全缓解或完全缓解伴血象不完全恢复(Complete remission/Complete remission with incomplete hematologic recovery, CR/CRi),3例患者(14%)未见原始细胞但骨髓增生功能低下(Blast-free hypoplastic or aplastic bone marrow, BFBM),该3名患者在第60天随访时达到CR/CRi。所有患者中,20例患者(91%)达到微小残留病变阴性(Minimal residual disease, MRD),其余2例患者在第90天达到MRD阴性CR。1例髓外病变的患者其乳腺病灶在第60天完全消失。
表5:患者回输后30天疗效

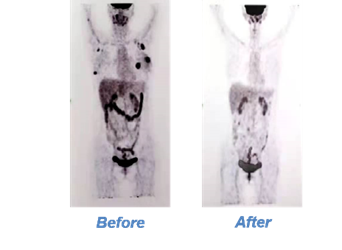
图1:髓外病变患者乳腺病灶治疗前后PET/CT对比
在无桥接移植的情况下,19例CR/CRi患者的中位无复发生存期(Relapse-free survival, RFS)为8.9个月(范围:2.9-NE);所有患者与CR/CRi患者的中位总生存期(Overall survival, OS)分别为24.2个月(范围: 3.7-NE)与未达到(范围:6.5-NE)。
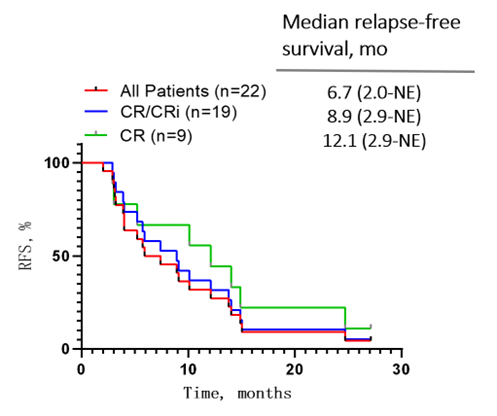
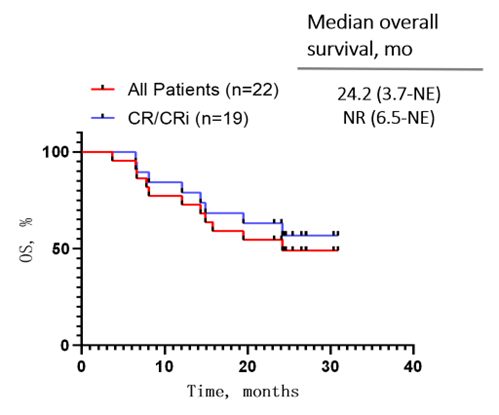
图2:患者长期随访
SC-gtCAR19 CAR阳性细胞占外周血单核细胞(PBMC)的占比拷贝中位数为53%(IQR 26.5-72.1%),细胞拷贝数达到峰值中位天数为第12天(IQR 10-13)。
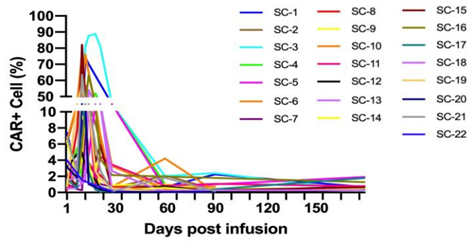
图3:SC-gtCAR19细胞在外周血扩增情况
小结
● 100% CR,91% MRD- CR
● 在使用更为严格的复发定义*下,中位8.9个月RFS,无桥接移植
● 所有患者中位总生存24.2个月,CR/CRi 患者中位总生存未达到
● 3/22(14%)患者3级CRS,2/22(9%)患者3级NE且与试验药物不相关
*复发:定义为骨髓中检见原幼淋细胞或B-ALL相关基因突变检测为阳性,以及患者发生髓外病变。
桑尼赛尔首席执行官彭作翰博士表示:“该临床研究为CAR-T细胞疗法基于“非病毒定点整合技术”的一次大胆尝试,桑尼赛尔证明该新路径是可行的。与传统的病毒生产工艺制备的CAR-T细胞相比,SC-gtCAR19在高负荷患者人群中使用中高剂量治疗后,拥有更高的风险-获益比。因此,非病毒定点整合技术(gtCAR®)平台展示了其潜力,下一步我们将继续优化生产工艺并且继续探索该平台在治疗实体瘤中的可能性。”
关于SC- gtCAR19
SC-gtCAR19是桑尼赛尔利用其独特的gtCAR®技术平台开发的候选药物,针对复发难治的B系血液肿瘤。其CD19 CAR 基因利用CRISPR-CAS9基因编辑技术结合非病毒载体递送进入患者T细胞,精确插入T细胞TRAC位点,使制备出的CAR- T细胞具有智能调控、更安全、无病毒残留、同质化及无成瘤风险等优势。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57