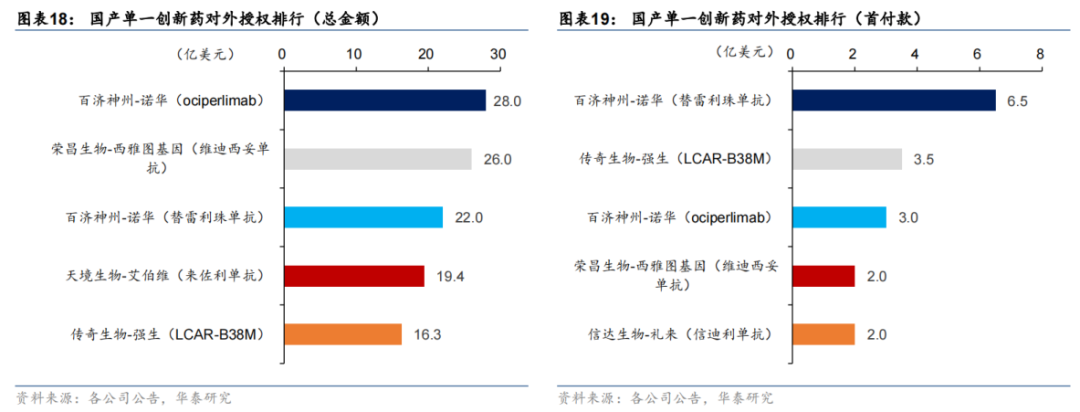
近段时间,康方生物的PD-1/VEGF双抗达成50亿美元交易并打破国产创新药海外授权纪录的消息一再刷屏。
12月6日,康方生物发布公告称,将PD-1/VEGF双特异性抗体依沃西(研发代号:AK112)的美国、加拿大、欧洲和日本权益授权给Summit Therapeutics公司,后者将支付5亿美元预付款,以及最高50亿美元的总交易金额,包括开发、注册、商业化里程碑金额;康方生物保留依沃西除以上地区之外的开发和商业化权利,包括中国。
消息一出,瞬间引起热议:为何PD-1/VEGF双抗能打破国产创新药出海纪录?全球还有哪些在研的PD-1/VEGF双抗,以及基于PD-(L)1设计的双抗药物值得关注?
01 AK112临床研究数据优异,头对头打败K药潜力大
康方生物的依沃西(PD-1/VEGF双抗,AK112)之所以能成功出海,原因主要体现在临床研究数据优异、市场优势显著等方面。
依沃西可同时阻断PD-1和VEGF通路,可“一药双靶”同时发挥免疫效应和抗血管生成效应,在已开展的研究中展现出良好的安全性和联合抗肿瘤的有效性。
目前,AK112正在开展单药对比帕博利珠单药(Keytruda,K药)一线治疗PD-L1表达阳性的非小细胞肺癌(NSCLC)的III期头对头研究,以及联合化疗对比化疗在EGFR-TKI耐药的EGFR突变的晚期NSCLC的III期研究。
从临床研究数据看,康方生物在2022 ASCO年会中公布了AK112单药治疗晚期NSCLC的Ib/II期临床研究结果,显示出良好的安全性和耐受性(共入组96例患者),3-4级治疗相关不良反应(TRAE)发生率为13.5%,未发生导致永 久停药的TRAE。
在至少有一次治疗后肿瘤评估的54例PD-L1阳性(PD-L1 TPS≥1%)的初治晚期NSCLC患者中,AK112单药治疗客观缓解率(ORR)为50%,疾病控制率(DCR)为96.3%;在接受AK112>10mg/kg Q3W剂量治疗的50例初治患者中,不同PD-L1表达水平患者均有良好的抗肿瘤疗效:PD-L1 TPS≥1%时,ORR为60%,DCR为97.1%。
而在同样适应症的K药上,KEYNOTE-042显示ORR仅为27%(PD-L1 TPS≥1%,N=413)。这意味着,AK112有较大的潜力在头对头试验中打败K药。
如果能像百济神州的泽布替尼头对头打败强生和艾伯维共同研发的伊布替尼,无疑能大大提振国产创新药的信心。
AK112单药治疗晚期NSCLC的Ib/II期临床研究结果

来源:康方生物公告
除此以外,康方生物还在2022 ASCO年会中公布了AK112联合化疗治疗晚期NSCLC II期临床研究结果。
其中,针对EGFR-TKI治疗失败的EGFR突变的晚期非鳞状NSCLC患者,AK112联合化疗ORR为 68.4%,DCR为94.7%,中位无进展生存期(PFS)为8.2个月,6个月PFS率为69.3%;针对既往PD-1/PD-L1单抗联合含铂双药化疗失败的晚期NSCLC,AK112联合化疗ORR为40%,DCR为80%;中位PFS为6.6个月,6个月PFS率为51.1%。
值得一提的是,目前全球范围内尚无免疫治疗方案获批用于EGFR突变耐药的NSCLC患者和针对PD-1/PD-L1单抗联合含铂双药化疗治疗失败的NSCLC患者。
基于优异的临床研究数据,国家药监局药品审评中心(CDE)授予了依沃西三项突破性疗法认定。其中,联合多西他赛治疗既往PD-(L)1抑制剂和含铂化疗治疗失败的局部晚期或转移性NSCLC,是国内目前唯一在PD-(L)1耐药的肺癌治疗领域获得突破性疗法认定的药物品种。
CDE授予依沃西三项突破性疗法认定

来源:康方生物公告
02 AK112适应症布局广泛,市场优势显著
除了临床研究数据优异以外,市场优势显著也是依沃西(AK112)能成功出海的重要原因之一。
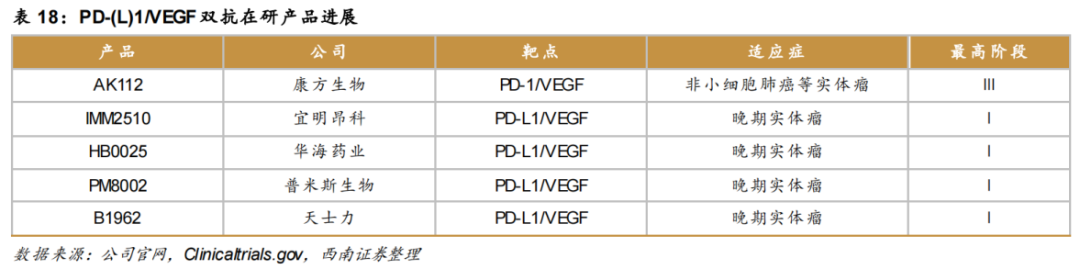
在PD-(L)1/VEGF双抗领域,除了康方生物的AK112以外,目前国内还有包括宜明昂科的IMM2510、华海药业的HB0025、普米斯生物的PM8002、天士力的B1962等PD-L1/VEGF双抗均已处于临床阶段。其中,AK112是全球行业内首 个进入III期临床研究的PD-1/VEGF双抗,具有明显的市场先发优势。
此外,目前AK112已针对非小细胞肺癌(NSCLC)开展两项III期临床研究,预计未来2-3年获批上市,而且适应症布局广泛。
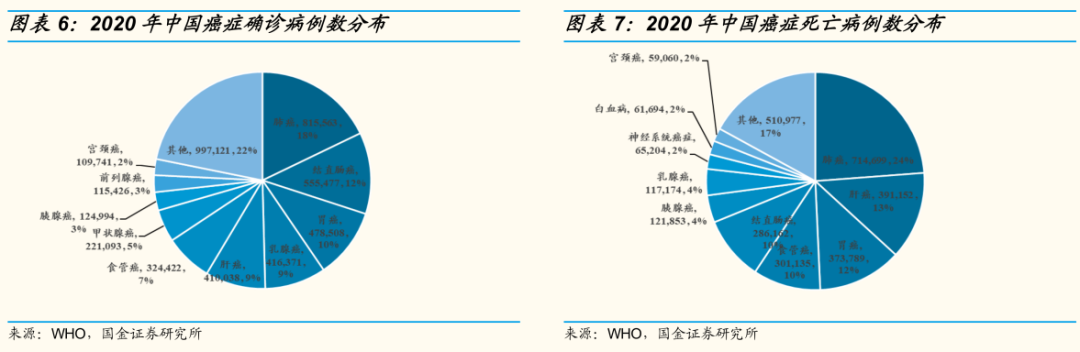
据统计,2020年中国新发癌症病例457万例,其中排名前十的癌种包括肺癌(82万,占比18%)、乳腺癌(42万,9%)、宫颈癌(11万,2%)等,而在所有肺癌患者中NSCLC患者约占85%。
除了肺癌以外,AK112还在抢占其他大适应症市场,包括三阴乳腺癌、小细胞肺癌、肝细胞癌、宫颈癌、卵巢癌等,未来市场空间广阔。
显然,除了AK112自身产品优势优异以外,康方生物作为国内双抗龙头,不仅拥有自研的双抗开发技术Tetrabody,而且商业化能力领先同行,也是获得外资药企青睐的原因之一。
首 个获批上市的国产双抗正是来自康方生物的卡度尼利单抗(AK104,cadonilimab),这也是全球首 款获批的PD-1/CTLA-4双抗,于2022年6月获国家药监局批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者。
另外,从管线数量看,截至2022年6月30日,康方生物拥有30多个创新项目,涵盖肿瘤、自身免疫及代谢性疾病领域;有关产品包括6个潜在同类首 创(first-in-class)双特异性抗体,其中15个处于临床试验阶段(包括3个对外授权的产品)。
正是基于上述种种因素,使得依沃西能够成功出海并打破国产创新药海外授权纪录。
03 “天价”License out掀起热潮,二代PD-1双抗药物再引关注
康方生物依沃西的“天价”License out,一方面提振了国内创新药行业走出寒冬的信心,另一方面也让第二代PD-1抑制剂“双抗”药物引发关注。
众所周知,PD-1抑制剂单药疗效不高,单抗联合疗法又存在副作用显著的问题,而双抗疗法具有更高的肿瘤特异性分布,能降低毒 性并提高疗效。例如,基于PD-1设计的PD1/CTLA4双抗药物就是当下的研发热门。
康方生物的AK104(PD-1/CTLA-4双抗)是全球首 款商业化的基于PD-1的肿瘤双免疫检查点双抗,可以说属于第二代PD-1双抗体免疫治疗新药,简称为“二代PD1”双抗药物。
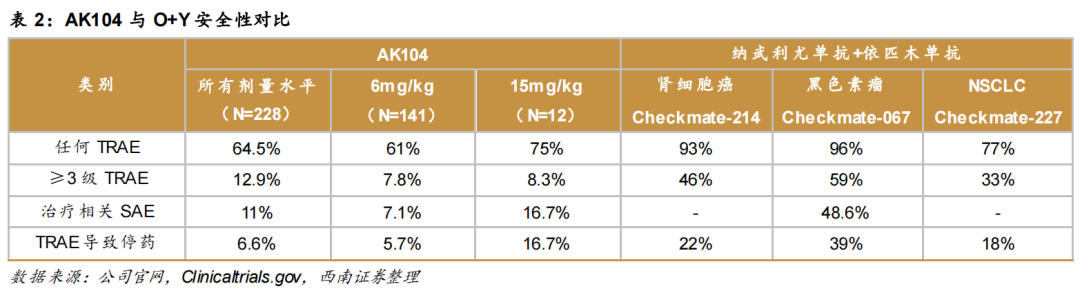
从结构设计看,AK104可同时靶向PD-1和CTLA-4双免疫检查点,仅凭一款药物就能达到一药双靶的升级免疫效果,而且由于具有高度肿瘤组织特异性(优于正常组织的肿瘤组织富集),显著增强了疗效和安全性。
根据相关肿瘤的研究阶段性数据显示,AK104与PD-1+CTLA-4的联合疗法相比,毒 性显著降低,具有明显的安全性和疗效优势。
正因如此,基于PD-1/PD-L1设计的第二代PD-1抑制剂“双抗”药物,成为了各大药企竞相角逐的重要研发方向。
除了AK104以外,目前全球进入临床阶段的PD-(L)1/CTLA-4双抗,还包括康宁杰瑞的 KN046(PD-L1/CTLA-4靶点)、百利药业的SI-B003、MedImmune的MEDI-5752、Xencor的XmAb-20717、MacroGenics的MGD-019。
此外,目前还有不少其他类型的“二代PD-1”双抗药物在研发当中。
例如,翰思生物的HX009(PD-1/CD47)、再鼎医药/Macro Genics的特泊利单抗(PD-1/LAG3)、Gensun Biopharma的ZG005(PD-1/TIGIT)和信达生物/Eli Lilly/Adimab的IBI318(PD-1/PD-L1)等已进入I/II期或II期阶段。

其中,IBI318是信达生物和礼来合作开发的重组全人源IgG1抗PD-1/PD-L1双特异性抗体,通过阻断PD-1与PD-L1/PD-L2信号通路,及阻断PD-L1结合CD80信号通路,恢复T细胞激活及抗肿瘤功能。
在2020年6月的ASCO会议上,研究人员公布了IBI318治疗晚期恶性肿瘤的1a期临床试验初步研究结果显示,IBI318有很好的耐受性:在0.3mg—300mg的治疗组在没有发现剂量限制性毒 性(DLT);在9个接受≥10mg用药量患者中,有3个患者具有部分响应。
除此以外,靶向PD-L1的双抗药物类型更加多样,包括PD-L1xCD40、PD-L1xCD47、PD-L1xCTLA-4、PD-L1xLAG-3、PD-L1xTGF-β、PD-L1xTIGIT和PD-L1xVEGF等。
例如,天境生物正是通过以PD-L1抗体作为第一信号,与特定免疫特性的第二信号(如IL-7、CD47、TIGIT)组合为双抗,从而布局研发靶向PD-L1的双抗药物。
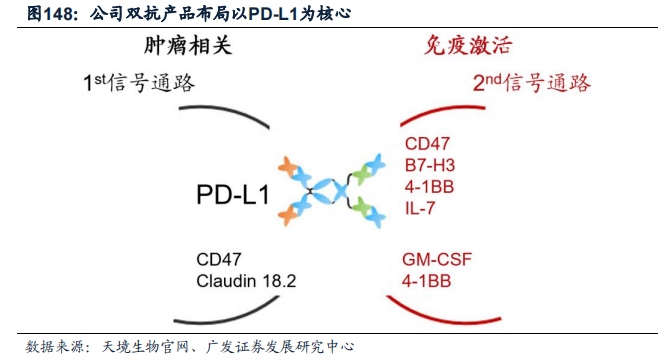
从整体研发情况看,目前康宁杰瑞的KN046(PD-L1/CTLA4)、恒瑞医药的SHR-1701(PD-L1/TGF-β抗体融合蛋白)、迈威生物的6MW3211(PD-L1/CD47)和普米斯的PM8002(PD-L1/VEGF)等已处于II期或III期阶段。
其中,康宁杰瑞的KN046目前已在中国、美国及澳大利亚开展约20项涵盖10多类肿瘤(包括NSCLC、TNBC、ESCC、HCC、PDAC及胸腺癌)处于不同阶段的临床试验,并计划于2023年在中国提交治疗sq NSCLC及PDAC的两项NDA;恒瑞医药的SHR-1701目前已开展针对晚期结直肠癌、非小细胞肺癌、胃癌等多种实体瘤的III期临床研究。
04 尾声
总结来看,康方生物的依沃西(PD-1/VEGF双抗,AK112)以50亿美元的“天价”打破了国产创新药海外授权纪录,无疑给当下亟需走出寒冬的国内创新药行业带来了新的希望。
另外,随着这笔天价License out的落地,第二代PD-1抑制剂“双抗”药物也有望再次引发关注,诸如康宁杰瑞、恒瑞医药、信达生物等正在加快研发进程。
参考来源
1.各公司财报、公告、招股书
2.《康方生物-B-9926.HK-双抗龙头,卡度尼利商业化启程》,西南证券
3.《二代PD1疯狂崛起!开创免疫2.0升级时代!》,找药宝典,2020-08-14



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57