2022年12月14日,CDE官网显示,合源生物首 个核心产品赫基仑赛注射液(HY001,CNCT19细胞注射液,抗CD19嵌合抗原受体T细胞注射液)被CDE纳入“拟优先审评品种”公示,拟定适应症为:成人复发或难治性B细胞型急性淋巴细胞白血病 (r/r B-ALL)。2020年12月11日,赫基仑赛的该适应症被CDE纳入“突破性治疗品种”名单。2022年1月13日,赫基仑赛的该适应症获得美国FDA孤儿药资格认定。
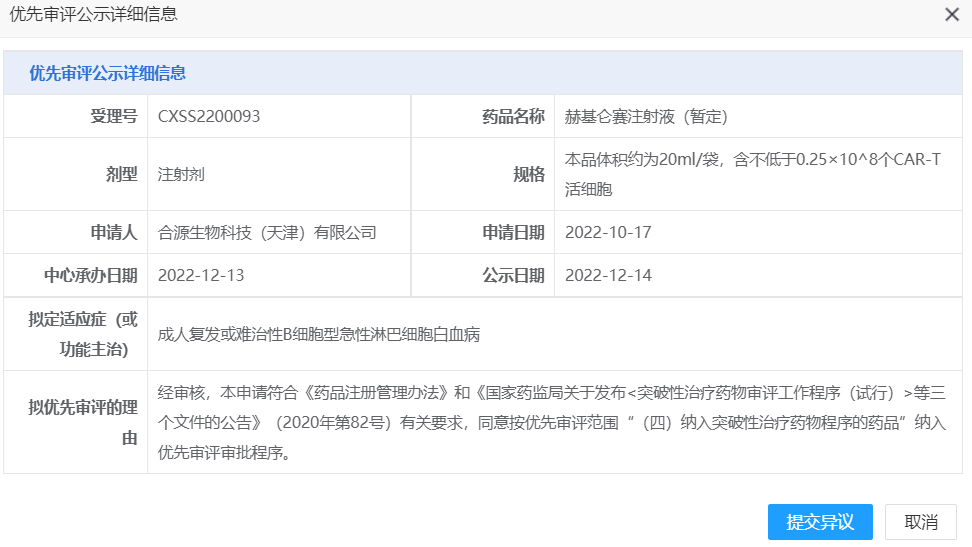

来源:CDE官网
急性淋巴细胞白血病(ALL)
白血病是我国儿童最常见的恶性肿瘤,其中72.6%为ALL。尽管目前初诊儿童ALL患者的5年总生存(OS)率达到80%以上,但仍有20%的儿童ALL患者经初始治疗后仍会复发或难治,复发或难治的患儿预后差,临床缺乏有效的治疗手段,再次化疗有效的比例不足20%,且反复化疗对儿童患者的毒 性大大增加。尽管部分患者后续可能会接受造血干细胞移植(HSCT),但对于儿童ALL患者,由于移植相关的毒副作用,其长期临床获益仍需进一步确认。
CAR-T细胞治疗基于显著的临床疗效和可控的安全性,为儿童r/r B-ALL提供了治愈的希望。沙利文发布的数据显示, 国内CAR-T细胞疗法市场规模复合年增长率达45%,预计到2030年或将增至289亿元。但由于CAR-T药物制造过程复杂、个性化定制等制约因素,治疗费用始终居高不下,导致产品推广瓶颈。
白血病是最常见的血液肿瘤之一,中国白血病发病率约为每年6.21/10万,美国白血病年发病率约为12.9/10万。急性淋巴细胞白血病(ALL)约占所有白血病的15%,其中B淋巴细胞型-ALL(B-ALL)约占ALL的75%。成人B-ALL患者较儿童B-ALL患者整体生存更差。成人B-ALL初治后复发率高,约60%的患者最终会进展到r/r B-ALL。
成人r/r B-ALL患者预后极差,严重危及生命,临床缺乏有效治疗手段,生存期仅2-6个月,5年总生存率小于10%,临床需求迫切。一组来自上海多家中心1989—2010年1452例原发ALL患者的数据显示,在新诊断B-ALL患者中,成人患者的生存情况显著差于儿童患者,且成人患者的复发率是儿童患者的2倍以上;与此同时,由于中国ALL领域新药可及性欠佳,中国成人r/r B-ALL患者的生存情况近30年来仍无明显改善。
赫基仑赛(CNCT19)
赫基仑赛是首 个具有中国自主知识产权、抗体+T细胞激活序列4-1BB分子的独特结构的CAR-T细胞产品,源自中国医学科学院血液病医院(中国医学科学院血液学研究所)长期技术创新积累,临床前的体内外试验均证实其可有效地靶向性杀伤B-ALL肿瘤细胞的靶向CD19的CAR-T细胞治疗产品,于2019年11月29日获得国家药品监督管理局两项新药临床试验许可,分别为治疗复发或难治性急性淋巴细胞白血病的临床试验(受理号:CXSL1800106)和治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤的临床试验(受理号:CXSL1800107)。
两项临床试验均率先进入注册临床2期阶段,并获得国家药品监督管理局药品审评中心“突破性治疗药物”认定和美国FDA孤儿药资格认定,有望成为首 个上市的自主知识产权靶向CD19 CAR-T产品。赫基仑赛注射液的第三个拓展适应症已于2022年8月19日获得国家药品监督管理局药品审评中心的临床试验默示许可,用于治疗儿童及青少年(3-18周岁)r/r B-ALL患者。
研发历程
20世纪80年代,中国医学科学院血液学研究所(简称天津血研所)自主制备HI19a单克隆抗体,HI正是当时血液学研究所(Hematology Institute)英文翻译的缩写。
1993年,HI19a单体被正式命名为CD19单克隆抗体。
2002-2003年,天津血研所的王建祥等构建了CD19 scFv,获抗CD19单链抗体国家发明专利(专利公开号CN1775808A),并开展了CD19 scFv-B7抗白血病作用的研究。HI19a (CD19)等是中国 第一个被国家批准的有自主知识产权的CAR-T治疗技术作为靶点单抗。
2014年,天津血研所构建了二代CD19 CAR,开启CD19 CAR-T免疫细胞治疗研究。
2016年9月,开启CD19 CAR-T治疗r/r ALL/NHL的临床研究。
2018年6月,吕璐璐博士创立合源生物,并围绕CD19单克隆抗体赫基仑赛进行研发。同年10月,赫基仑赛2项IND申请获得CDE受理。
2019年11月29日,赫基仑赛获得2项国家药品监督管理局新药临床试验许可(CXSL1800106,CXSL1800107)。
2020年1月15日,赫基仑赛注册临床研究1期试验 (CTR20192705,CTR20192701)首例受试者成功入组。
2020年3月4日,赫基仑赛注册临床研究1期试验 (CTR20192705,CTR20192701)首例受试者成功实现细胞回输。
2020年9月17日,赫基仑赛NHL注册临床研究完成1期 (CTR20192705)主要终点独立数据安全监查委员会监查。
2020年9月24日,赫基仑赛NHL注册临床研究2期试验 (CTR20201986)研究者会议在杭州召开。
2020年11月18日,赫基仑赛NHL注册临床研究2期试验(CTR20201986)首例病人成功入组。
2020年12月18日,赫基仑赛纳入国家药品监督管理局“突破性治疗药物”品种。
2021年3月5日,药明康德子公司生基医药宣布与合源生物达成战略合作协议,为其首 个CAR-T新药赫基仑赛提供覆盖质粒和病毒载体GMP条件下的生产工艺及分析方法验证、质量研究和生物制品上市申请(BLA)相关文件交付等服务。
2021年3月21日,赫基仑赛2期临床试验 (CTR20201986,CTR20202493)中期研究者会议在天津举行。
2021年6月29日,合源生物获得天津首张细胞药物生产基地《药品生产许可证》。
2021年12月12日,合源生物/血研所在ASH年会上联合公布赫基仑赛治疗复发难治急性B淋巴细胞白血病的前期临床 (CTR20192701,CTR20202493)研究结果。
2022年1月13日,赫基仑赛获得美国FDA孤儿药资格认定(Orphan Drug Designation, ODD),用于治疗急性淋巴细胞白血病(ALL)。
2022年8月19日,赫基仑赛儿童白血病适应症IND获默示许可(CXSL2200231)。
2022年10月11日,赫基仑赛治疗成人r/r B-ALL关键临床研究(NCT04684147)达到主要终点。
临床结果
2021年12月12日,在第63届美国血液学会(ASH)年会上,合源生物与中国医学科学院血液病医院(中国医学科学院血液学研究所)以海报展示(ASH摘要号2811)的方式,联合公布了赫基仑赛治疗复发难治急性B淋巴细胞白血病(r/r B-ALL)的前期临床研究 (CTR20192701)结果。
本次公布的研究为一项在国内开展的开放标签的前期临床研究,主要研究目的为确定赫基仑赛的安全性及有效性,研究终点包括3个月客观缓解率(ORR)、无复发生存率(RFS)和总生存率(OS)。
截至2020年10月,共有63例既往≥2线治疗失败的r/r B-ALL患者接受赫基仑赛治疗并随访至少1年,其中,成人患者32例,儿童患者31例。入组患者根据医院标准操作程序进行细胞单采获取T细胞,并于清淋预处理2-14天后回输赫基仑赛。所有患者回输后住院观察2周。
研究表明,无论对于成人还是儿童r/r B-ALL患者,赫基仑赛均表现出良好的有效性及安全性。数据显示,59例(ORR 59/63= 93.6%)患者达完全缓解(CR)或血液学恢复不完全的完全缓解(CRi)。59例缓解患者中,56例(56/59 = 94.9%)患者达微小残留病(MRD)阴性,23例(38.9%)患者接受了异基因造血干细胞移植。全部患者的6个月和12个月OS率分别达到91.4%和74.1%。特别在成人患者(N=32)中,ORR达到93.8%(30/32),缓解患者中MRD阴性的比例达96.7%(29/30),6个月和12个月OS率分别达到89.6%和62.3%。总体安全性可控,54例患者发生任意级别不良反应(54/63 = 85.7%),其中12例(12/63 = 19%)患者发生≥3级CRS,13例(13/63 = 20.6%)患者发生≥3级NEs。
2022年1月14日,第二届中国血液学科发展大会上,徐州医科大学血液研究所所长徐开林教授做了成人复发难治B-ALL治疗(CAR-T)进展的专题报告,介绍了赫基仑赛在成人r/r B-ALL 2期临床试验中的最新进展。他表示,根据前期临床试验数据,赫基仑赛治疗成人r/r B-ALL患者的CR/CRi达93.8%,并可能在一定程度上转化为长期生存。
2022年12月12日,在第64届美国血液学年会(2022 ASH)上,合源生物以大会口头报告的形式向全球发布了一项赫基仑赛注射液用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(r/r B-ALL)的单臂、开放、多中心关键性临床研究(NCT04684147)结果(Oral Presentation, #0660)。
结果显示赫基仑赛针对成人r/r B-ALL患者显示了持久的高缓解率和显著降低的CAR-T治疗相关毒 性严重性,总体缓解率(ORR)达82.1%,中位随访9.3个月时,中位缓解持续时间(DOR)尚未达到。在3个月时仍缓解的患者中,1年时预计有80%患者在持续缓解中。无论是否后续接受造血干细胞移植,均能表现出持续缓解和长期生存获益。
权益合作
2019年6月,英创远达(CASI Pharma)与合源生物正式签署许可协议,获得其CNCT19项目全球独家商业权益。CNCT19 是自体抗CD19 T细胞治疗产品,由合源生物开发。此后,合源生物将继续开展CNCT19项目的研发工作,CASI将加入项目指导委员会。在未来,CASI将根据协议,在项目研发进展到重大里程碑阶段后,向合源生物支付相关费用;进入商业化阶段后根据约定向合源生物支付销售分红。与此协议相关联的凯信远达医药(无锡)有限公司是一家CASI占股80%的合资公司将通过旗下一家全资子公司向合源生物投资人民币八千万元(约合一千一百六十万美元)作为预付款。
2019年7月9日,合源生物获得1亿人民币的A+轮融资,投资方为道彤投资、英创远达、瑞伏医疗创投基金。与合源生物的合作是CASI“创业伙伴模式”的一个缩影,该模式基于两个重要的组成部分,即共同开发和股权投资。
2022年9月23日,CASI制药旗下的CASI生物制药(无锡)有限公司(凯信远达)与深圳嘉道功程股权投资基金有限公司签订股权转让协议,根据该协议,CASI无锡同意转让其在合源生物的股权。公司以人民币2.4087亿元(折合3403万美元)向嘉道功程提供了12.0098%的合源股份。《股权转让协议》规定,嘉道功程将分两期等额付款;第一笔款项将在股权转让协议签署后支付,第二笔款项将在股权交易完成后支付。此次股权转让合源生物估值约20亿。
竞争格局
2017年8月30日,由诺华研发的靶向CD19的CAR-T细胞疗法Kymirah被美国FDA批准上市,这是全球首 个获批的CAR-T细胞疗法,适用于复发或难治性B细胞急性淋巴细 胞白血病(ALL)(3-25岁)成人复发、难治性大B细胞淋巴瘤(LBCL)。至此之后,先后有6款靶向CD19的CAR-T药物上市,其中4个产品(Yescarta,Tecartus,Abecma,Breyanzi)由FDA批准上市,2个产品(奕凯达,倍诺达)由NMPA批准上市。治疗范围主要在于血液系统肿瘤,涵盖包括B细胞急性淋巴细胞白血病、复发或难治性滤泡瘤、复发或多发性骨髓瘤。
2021年6月23日,国家药品监督管理局通过优先审评审批程序批准复星凯特申报的阿基仑赛注射液 (商品名:奕凯达)上市。该药品为我国首 个批准上市的细胞治疗类产品,用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤(LBCL)成人患者(包括弥漫性大B细胞淋巴瘤非特指型、原发纵隔大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤)。
据药渡数据库的不完全统计,目前处于临床2期的靶向CD19的CAR-T药物有3款,处于临床1期的靶向CD19的CAR-T药物有14款。国内研发进展较快的是合源生物的赫基仑赛、科济生物的CT032和先声药业的CD19 CAR-T细胞治疗。期待赫基仑赛在竞争中先拔头筹,早日为患者谋福利。
数据来源:CDE官网;各公司官网。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57