2022年12月14日,根据国家药品监督管理局药品审评中心(CDE)最新数据显示,今日新增十余款1类新药的默示许可信息(不含补充申请)。经过梳理,这些1类新药适应症涉及肿瘤、荨麻疹、高钾血症、糖尿病等,靶点涉及MDM2-p53、Bcl-2、CEA、TROP2等。
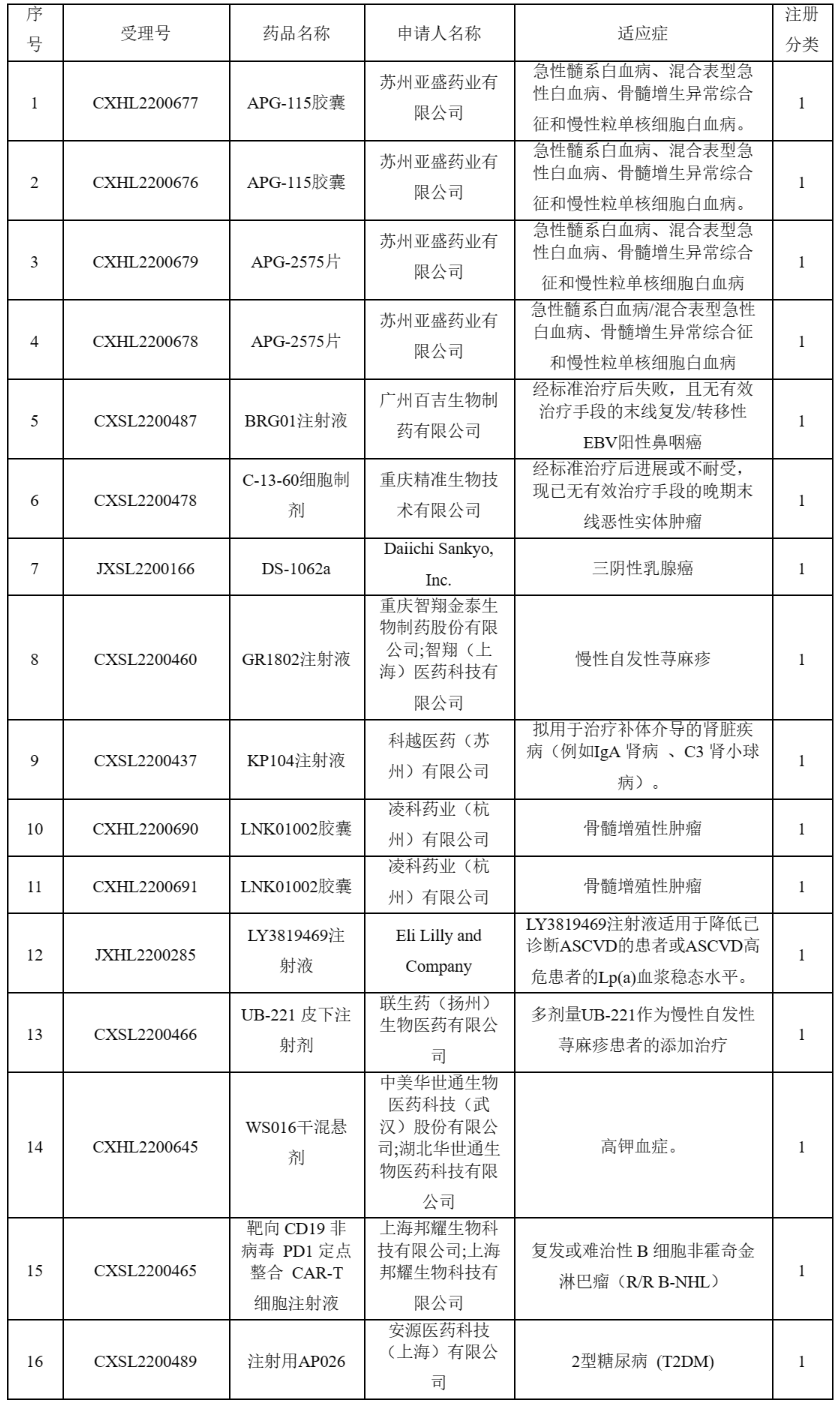
MDM2-p53抑制剂:APG-115胶囊
APG-115胶囊是苏州亚盛药业开发的一款口服有效、高度选择性靶向MDM2-p53蛋白相互作用的小分子抑制剂,此次临床默示许可适应症为急性髓系白血病、混合表型急性白血病、骨髓增生异常综合征和慢性粒单核细胞白血病。p53基因是最广泛研究的肿瘤抑制基因,p53基因的失活对肿瘤形成起重要作用,而MDM2是p53的一个最重要的抑制因子,当两者结合的时候,会使p53蛋白降解, 活性降低,抑癌作用减弱。以MDM2-p53为靶点设计开发全新机制的抗肿瘤药物,是当下全球肿瘤药物研发领域热点与重点之一。然而由于MDM2-p53蛋白相互作用的特殊性给小分子抑制剂的开发带来相当大的困难,导致全球该领域的在研药物屈指可数,全球针对该靶点尚未有上市药物。APG-115是第二代MDM2-p53抑制剂,目前在国内已经开展了4项临床试验,最高研发阶段为临床II期。
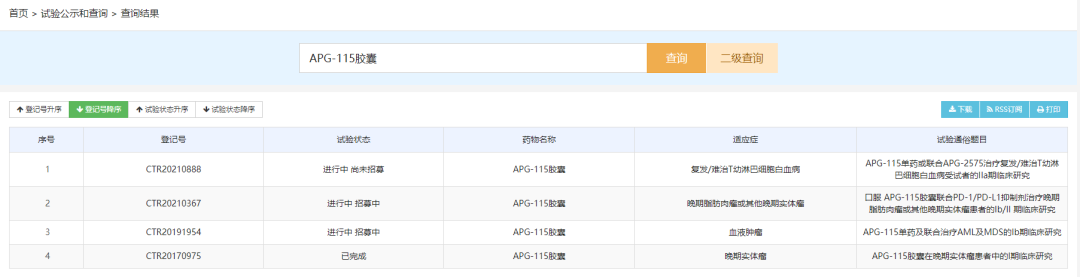
Bcl-2抑制剂:APG-2575片
APG-2575片是苏州亚盛药业开发的新型口服Bcl-2选择性小分子抑制剂,此次临床默示许可适应症为急性髓系白血病、混合表型急性白血病、骨髓增生异常综合征和慢性粒单核细胞白血病。APG-2575可通过选择性抑制Bcl-2蛋白来恢复肿瘤细胞程序性死亡机制(细胞凋亡),从而诱导肿瘤细胞凋亡。该产品正在美国、中国、澳大利亚、欧洲等全球多地开展多种血液肿瘤和实体瘤的临床研究,并已有适应症相继获得FDA授予的孤儿药资格,目前全球最高研发进度为临床II期。
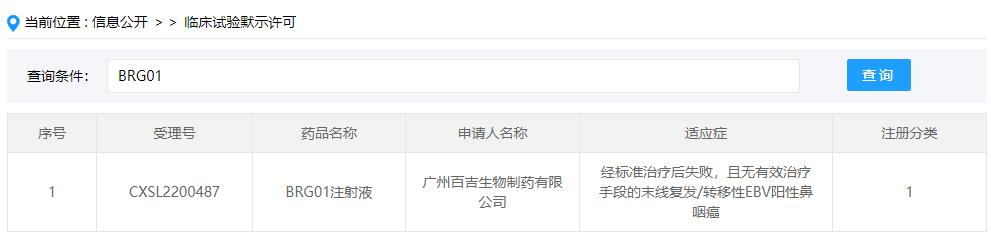
自体免疫T细胞疗法:BRG01注射液
BRG01注射液是广州百吉生物开发的一款通过基因修饰技术将以EBV抗原为靶点的受体表达在T细胞表面而制成的自体T细胞免疫治疗产品,此次临床默示许可适应症为经标准治疗后失败,且无有效治疗手段的末线复发/转移性EBV阳性鼻咽癌,这是该药首次在国内获批临床。鼻咽癌是发生在鼻咽粘膜上皮的恶性肿瘤,是常见的头颈部恶性肿瘤之一,其发生和发展与EBV感染密切相关。数据显示,2020年全球确诊的鼻咽癌发病数为13.3万人,中国鼻咽癌发病数占全球约50%,特别是广东和广西是高发地区,占全中国约60%,BRG01市场潜力巨大。
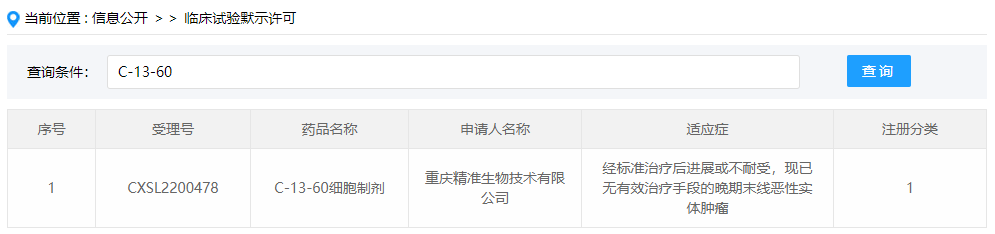
靶向CEA的CAR-T细胞疗法:C-13-60细胞制剂
12月14日, CDE官网公示,重庆精准生物申报的C-13-60细胞制剂获得临床试验默示许可,拟开发用于经标准治疗后进展或不耐受,现已无有效治疗手段的晚期末线恶性实体肿瘤,这也是该药首次在国内获批临床。公开资料显示,C-13-60细胞制剂是一款靶向CEA的CAR-T细胞注射液。C-13-60来源于该公司研发的RESCAR和PHICAR技术平台,该平台可以促进CAR细胞向肿瘤部位聚集,克服肿瘤抑制免疫微环境以提高疗效,同时增强了在肿瘤环境中存活。临床前小鼠体内研究结果显示,C-13-60具有明显的有效性,有望帮助更多的直肠癌、胃癌和食管癌患者成功摆脱病痛。
TROP2 ADC抗体:DS-1062a
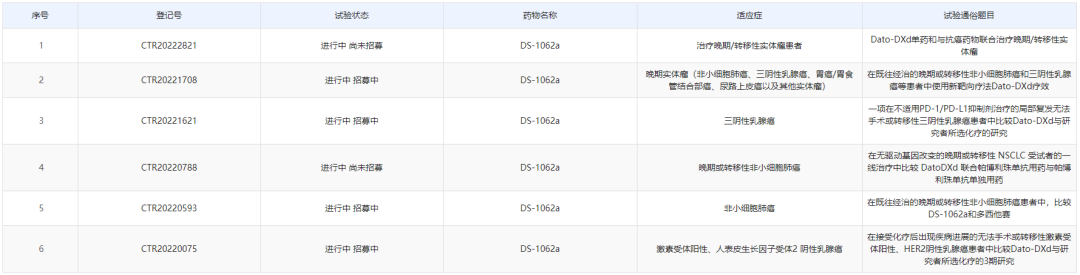
DS-1062a(Datopotamab deruxtecan,DS-1062)是第一三共研发的一种以滋养细胞表面糖蛋白抗原2 (TROP2)为靶点的抗体-药物偶联药物(ADC),此次临床默示许可适应症为三阴性乳腺癌。该药由人源化的抗TROP2单克隆抗体、酶切多肽连接剂和一种新型拓扑异构酶I抑制剂DXd——Exatecan (DX-8951)的衍生物组成,目前已在全球包括中国开展多项III期临床试验,适应症包含非小细胞肺癌、乳腺癌等。
(数据来源:CDE临床试验登记平台)
2020年7月,第一三共与阿斯利康达成60亿美元的重磅协议,共同开发和商业化DS-1062a。2021年6月ASCO大会上,第一三共与阿斯利康公布了DS-1062a治疗晚期或转移性NSCLL更新数据和转移性三阴性乳腺癌(TNBC)的I期试验TROPION-PanTumor01数据。总体数据非常优秀,市场潜力不俗。
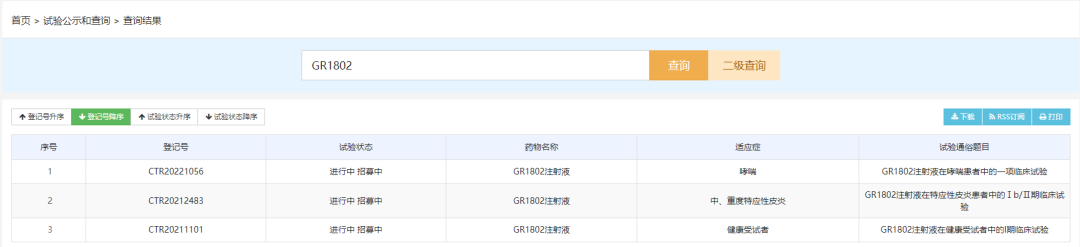
IL-4Rα单克隆抗体:GR1802注射液
GR1802注射液是重庆智翔金泰生物开发的一款抗IL-4Rα单克隆抗体,此次临床默示许可适应症为慢性自发性荨麻疹。目前GR1802在国内开展了三项临床试验,涉及哮喘和特应性皮炎两项适应症,两项适应症最高研发进度均为临床II期。
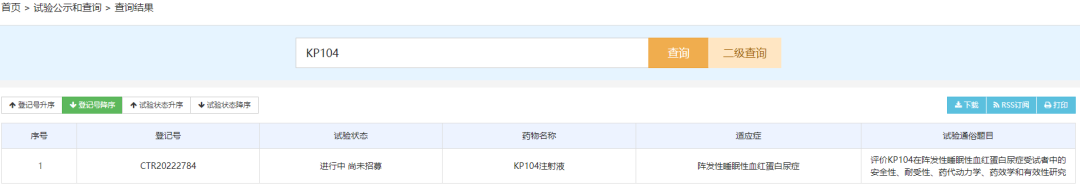
双功能补体生物制剂:KP104注射液
KP104注射液是科越医药开发的一款双功能生物制剂,旨在通过选择性靶向作用于旁路和终末补体途径中的关键靶点来调节补体活性,此次临床默示许可适应症为拟用于治疗补体介导的肾 脏疾病(例如IgA 肾病 、C3 肾小球病)。KP104旨在同时选择性抑制补体旁路和终端途径,提供一种强大的协同机制且可能更加有选择性的精准治疗补体介导的疾病。KP104还被设计成具有延长的半衰期和效力,其配方可用于静脉注射和皮下给药。KP104正进入多个适应症的II期临床试验,包括IgA肾病(IgAN)、C3肾小球病(C3G)、继发于系统性红斑狼疮的血栓性微血管病(SLE-TMA)和PNH。II期临床试验将在全球范围内进行,包括美国、中国、澳大利亚和韩国。
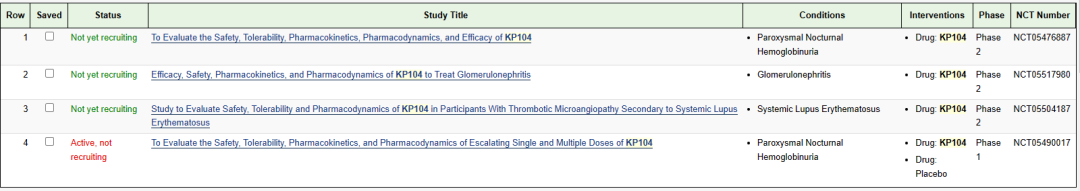
国内目前开展了一项适应症为阵发性睡眠性血红蛋白尿症的II期临床试验。阵发性睡眠性血红蛋白尿症(PNH)是一种罕见的危及生命的血液疾病,其特征是红细胞破坏、血栓形成和骨髓功能受损。KP104有望能够给该种疾病患者带来新的治疗选择。
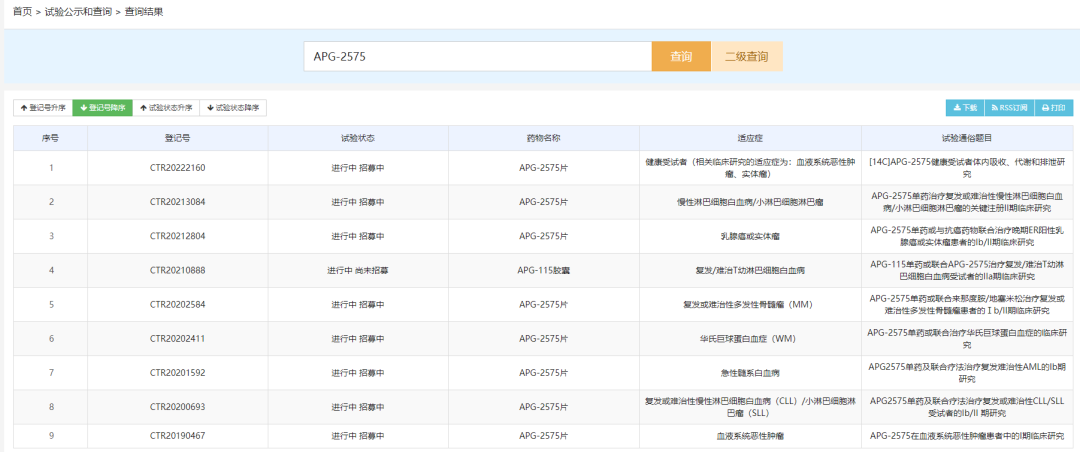
三靶点JAK1/JAK2/FLT3激酶抑制剂:LNK01002胶囊
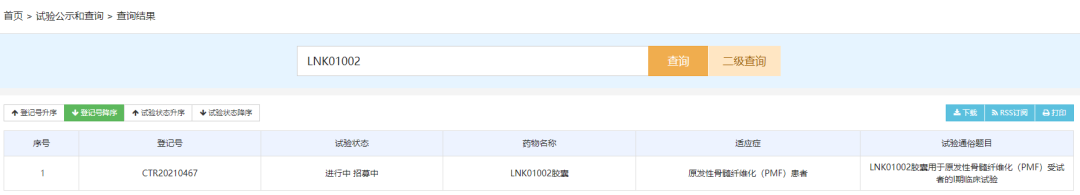
LNK01002胶囊是凌科药业自主研发的一款创新三靶点JAK1/JAK2/FLT3激酶抑制剂,此次临床默示许可适应症为骨髓增殖性肿瘤。LNK01002 的优势是可以同时有效地靶向三个驱动激酶靶点,可潜在地用于治疗对于传统治疗方案无效,或者耐药的病人群体,因此极大地满足了未被满足的临床需求,具有全球首 创的潜力。目前LNK01002在国内开展了一项I期临床试验,适应症为原发性骨髓纤维化。
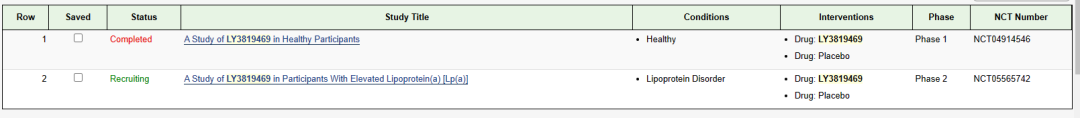
RNAi基因疗法:LY3819469注射液
LY3819469注射液是礼来开发的一款RNAi基因疗法药物,此次临床试验默示许可适应症为适用于降低已诊断ASCVD(动脉粥样硬化性心血管疾病)的患者或ASCVD高危患者的Lp(a)(脂蛋白)血浆稳态水平,这是该药首次在国内获批临床。RNA干扰(RNAi)是一种进化过程中高度保守的转录后基因沉默现象。它由双链RNA(dsRNA)诱发,导致同源mRNA高度特异性降解,阻断mRNA翻译出致病蛋白质的过程,从而发挥治疗作用。目前LY3819469已经开展了两项临床试验,其中脂蛋白紊乱适应症临床试验处于临床II期。
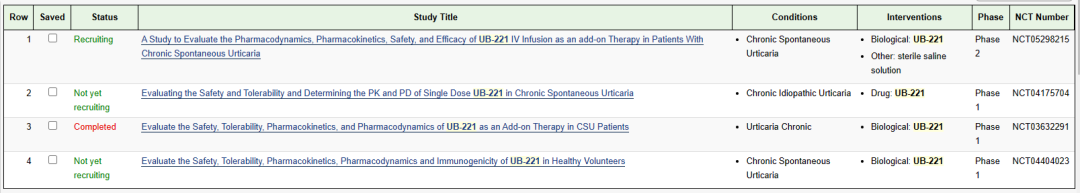
UB-221 皮下注射剂
UB-221 皮下注射剂是联生药(联亚生技的分割子公司)一款靶向 IgE 的单克隆抗体,此次临床试验默示许可适应症为多剂量UB-221作为慢性自发性荨麻疹患者的添加治疗。UB-221可通过与B 细胞表面的 FcεRII (CD23) 受体结合来中和可溶性 IgE 并抑制 IgE 合成。临床前研究表明,UB-221 的药理作用优于目前针对 IgE 的治疗性抗体(Xolair )8倍;体外数据中显示出 2 至 5 倍的 IgE 合成抑制作用,需要 1/10 剂量才能在 huIGHE 敲入小鼠模型中达到相同的效果。1 期临床试验显示,慢性自发性荨麻疹患者对 UB-221 单次给药后反应迅速,并将其血清游离 IgE 抑制数周至数月,表明 UB-221 可以比 Xolair(奥马珠单抗)更有效地缓解慢性自发性荨麻疹症状。UB-221已经在多个国家或地区开展临床试验,最高研发阶段为临床II期。
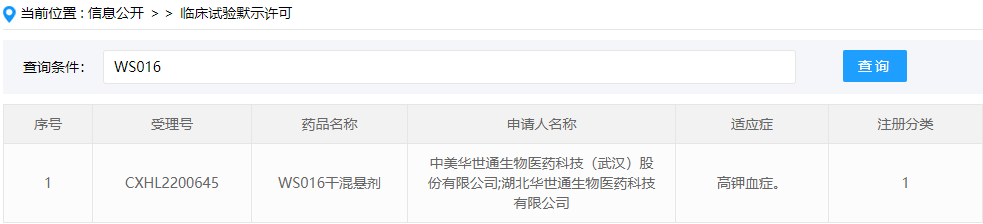
钾离子结合剂:WS016干混悬剂
WS016干混悬剂是华世通生物开发的一款高分子聚合药物,此次临床试验默示许可适应症为高钾血症,这是该药在国内首次获批临床。该药是一种新型的钾离子结合剂,2022年09月05日,由中美华世通生物医药科技(武汉)股份有限公司向中国国家药品监督管理局NMPA提交IND申请,用于治疗高钾血症,为化药一类(CXHL2200645)。
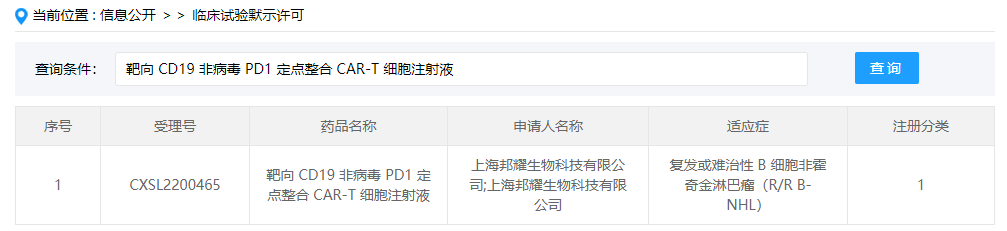
靶向 CD19 非病毒 PD1 定点整合 CAR-T 细胞注射液
靶向CD19非病毒PD1定点整合CAR-T细胞注射液(研发代码:BRL-201)是上海邦耀生物开发的首 个可在不使用病毒载体的情况下实现基因组定点整合的自体CAR-T细胞产品。此次临床默示许可适应症为复发/难治性B细胞非霍奇金淋巴瘤(R/R B-NHL),也是该药首次在国内获批临床。BRL-201是利用Quikin CART?平台开发的靶向CD19的CAR-T产品,具有成本低、制备时间短、工艺简单、安全性和有效性高等优点。目前其在治疗复发/难治性非霍奇金淋巴瘤的研究者发起的临床试验中(IIT)已取得良好的效果,有8例患者接受治疗后,未观察到CAR-T相关的神经毒 性和2级以上细胞因子风暴,完全缓解率超87%,证明了BRL-201具有出色的临床安全性。BRL-201作为世界首 个非病毒PD1定点整合CAR-T产品,邦耀生物将继续推进该产品的临床转化,希望能造福更多的肿瘤患者。
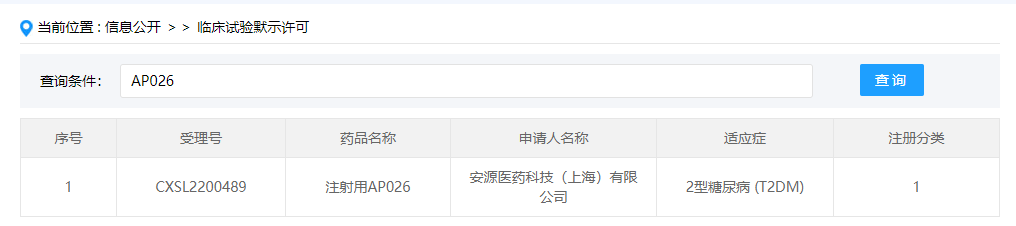
FGF21/GLP-1双功能蛋白:注射用AP026
注射用AP026是安源医药开发的FGF21/GLP-1双功能蛋白药物,此次临床默示许可适应症为2型糖尿病,这是该药首次在国内获批临床。AP026是一种FGF21/GLP-1双功能蛋白,利用安源特有的连接肽平台技术与抗体Fc端融合,能够有效增加分子在血液中的稳定性。基于GLP-1代谢领域中已经展示出的良好效果以及FGF21的强大潜力,该药物有望应用于非酒精性脂肪性肝炎(NASH)、2型糖尿病(T2DM)等代谢领域。2022年4月,安源医药与正大天晴达成合作,将AP025和AP026在NASH和2型糖尿病治疗领域的大中华区开发和商业化权益授予正大天晴。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57