12月16日,安斯泰来宣布Claudin18.2靶向单抗Zolbetuximab联合CAPOX(卡培他滨和奥沙利铂)一线治疗Claudin18.2阳性、HER2阴性局部晚期不可切除或转移性胃或胃食管结合部 (GEJ) 腺癌的一项III期研究GLOW达到主要终点。
就在上个月16日,Zolbetuximab 联合mFOLFOX6(奥沙利铂、亚叶酸 + 氟尿嘧啶联合方案)一线治疗Claudin18.2阳性、HER2阴性局部晚期不可切除或转移性胃或胃食管交界处腺癌的III期临床研究SPOTLIGHT达到PFS主要终点和OS次要终点。
Zolbetuximab是Ganymed(安斯泰来子公司)自主研发的一种Claudin18.2(CLDN18.2)靶向单抗。而SPOTLIGHT研究是Claudin18.2靶点成功的首 个III期临床研究,若顺利Zolbetuximab有望成为首 个获批的Claudin18.2靶向药。
关于Claudin18.2
Claudin(CLDN)是一类存在于上皮和内皮紧密连接中的整合素膜蛋白,最早由Shoichiro Tsukita等于1998年发现。Claudin家族广泛分布于各种上皮组织,至少有27个家族成员,结构包括4个跨膜区和2个胞外环,其中NH2端和COOH端位于胞内,具有两个胞外环。这种结构使CLDN紧密蛋白家族能够有效维持上皮细胞和内皮细胞的极性,从而有效调控细胞旁通透性和电导。
Claudin18(CLDN 18)属于Claudins蛋白家族,具有两个异构体,即Claudin18.1和Claudin18.2。其中Claudin18.1主要表达于肺组织,Claudin18.2最初被发现能持续、稳定地高表达于多种胃癌组织,但随后研究发现Claudin18.2还能在乳腺癌、结肠癌、肝癌、头颈癌、支气管癌以及非小细胞肺癌等多种原发恶性肿瘤中异常激活和过度表达,尤其好发于消化系统恶性肿瘤,包括胃癌(70%)、胰 腺癌(50%)和食管癌(30%)等。
目前,Claudin18.2表达的调节机制仍未完全清楚,认为其表达主要受Claudin18.2基因编码序列中的低甲基化基因序列CpG岛启动子和转录因子环磷腺苷效应元件结合蛋白(CREB)调节。Claudin18.2的激活取决于转录因子CREB与CpG岛内的低甲基化位点的结合,CREB结合的位点为高度保守的TGACGTG序列,是位于CREB结合起始点至转录起始位点之间高度重复的核苷酸序列。
肿瘤细胞的cAMP激活蛋白激酶A(PKA)后,活化的PKA进入细胞核,通过氨基端激酶诱导域(KID)磷酸化来活化CREB,在被PKA磷酸化后,CREB的转录活性会增加10~20倍,结合CpG岛启动子引起Claudin18.2的异常激活和过表达。同时,DNA基因序列的去甲基化亦被证实能显著增加Claudin18.2的表达。
Claudin18.2靶点竞争激烈,在研新药数量破百
Claudin18.2是目前炙手可热的一个实体瘤新药研发靶点,据不完全统计其在研新药数量超过100个,其中超50款获批临床或进入临床试验阶段。值得一提的是,在研Claudin18.2靶向药药物类型多样,涉及单抗、双抗、抗体偶联物(ADC)、放 射性核素偶联药物(RDC)、CAR-T和mRNA疗法,其中单抗、双抗、ADC和CAR-T疗法居多。
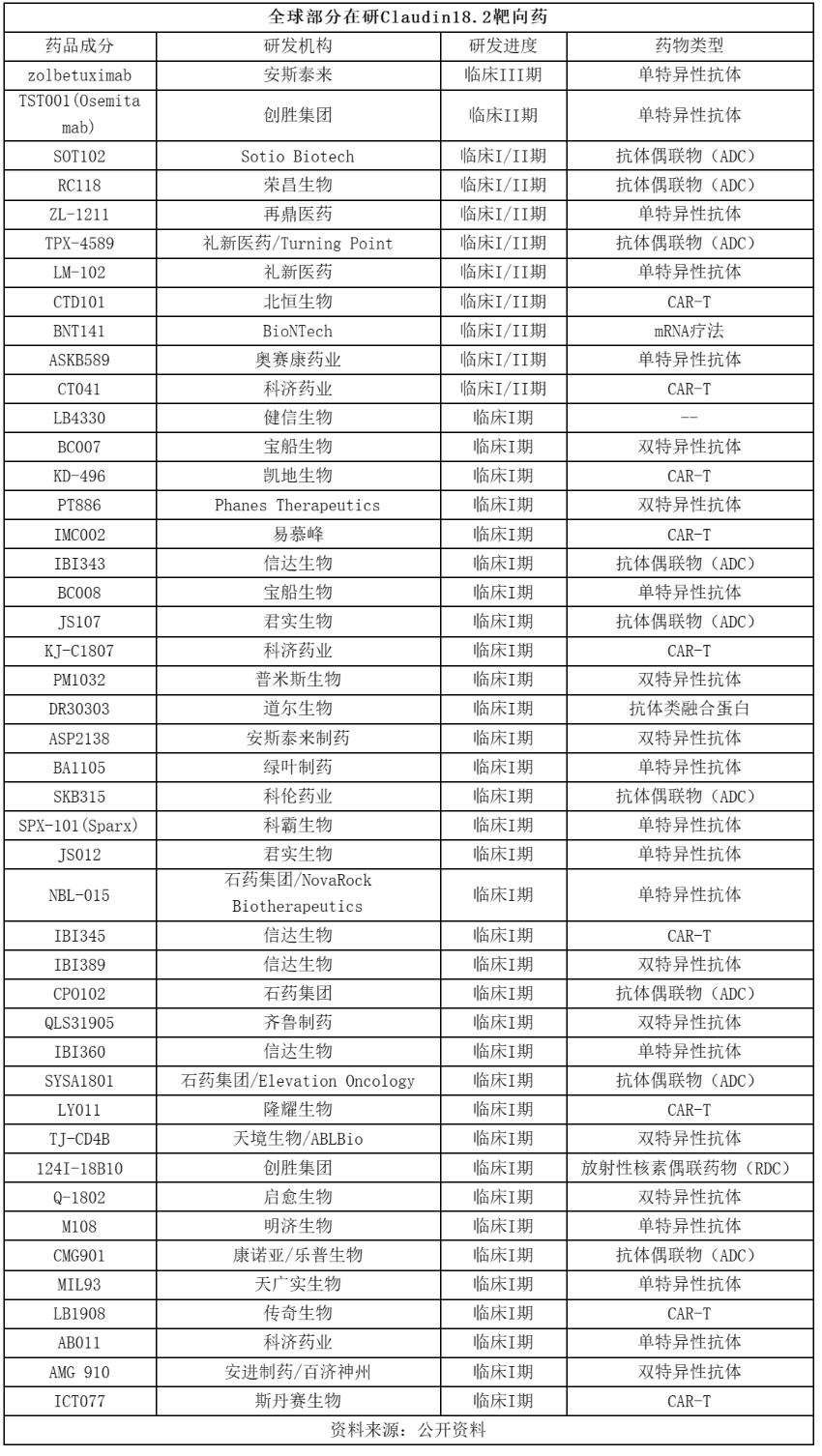
研发进度上看,安斯泰来开发的Zolbetuximab进展最快,目前已进入III期临床,且其一线治疗Claudin18.2阳性、HER2阴性局部晚期不可切除或转移性胃或胃腺癌的两项III期临床均已取得成功。
Zolbetuximab由安斯泰来子公司Ganymed自主研发,可特异性识别并结合Claudin18.2。临床前研究表明,Zolbetuximab通过激活两种不同的免疫系统途径(抗体依赖性细胞毒 性和补体依赖性细胞毒 性)诱导癌细胞死亡。
最新公布的Zolbetuximab联合CAPOX(卡培他滨和奥沙利铂)一线治疗Claudin18.2阳性、HER2阴性局部晚期不可切除或转移性胃或胃食管结合部 (GEJ) 腺癌的一项III期研究结果显示:与安慰剂联用CAPOX组相比,Zolbetuximab联用CAPOX组患者的PFS在统计学意义上改善,达到主要终点。而且,与安慰剂联用CAPOX组相比,Zolbetuximab联用CAPOX组患者的OS显著延长,达到OS的关键次要终点。
创胜集团开发的第二代Claudin18.2靶向抗体TST001(Osemitamab)进展居全球第二,在国内居第一。TST001基于公司免疫耐受突破(IMTB)技术平台开发,利用先进的生物加工技术,TST001 (Osemitamab) 的岩藻糖含量在生产过程中大大降低,进一步增强了TST001 (Osemitamab) 的NK细胞介导的ADCC活性。
2022 ESMO年会上公布的TST001联合卡培他滨和奥沙利铂(CAPOX)一线治疗局部晚期或转移性胃癌及胃食管连接部癌的I/II期临床研究结果显示:根据RECIST1.1标准,73.3%的患者肿瘤呈现部分缓解,疾病控制率高达100%。
其他在研Claudin18.2靶向药大多处于I期临床和I/II期临床。不过今年以来,多款Claudin18.2靶向药取得新进展。
奥赛康药业于今年4月宣布其Claudin18.2靶向单抗ASKB589在I/II期单药剂量爬坡和扩展研究中取得积极结果:2名晚期胃癌患者在使用ASKB589治疗6周后进行疗效评估,根据RECIST1.1标准,总体疗效评价结果均达到部分缓解,其中靶病灶明显缩小,部分非靶病灶消失,肿瘤标志物显著下降。
● Claudin18.2/CD47靶向双抗PT886于今年6月在美国获批临床,用于治疗胃癌、胃食管交界处(GEJ)腺癌和胰 腺癌。
● 康诺亚的Claudin18.2靶向ADC药物CMG901于今年5月被FDA授予治疗复发/难治性胃癌及GEJ的快速通道资格,9月被CDE纳入突破性治疗品种。
● 易慕峰的Claudin18.2靶向CAR-T疗法于今年7月被FDA授予治疗胃癌的孤儿药资格认定。
● 荣昌生物的RC118于今年12月被FDA授予两项孤儿药资格认定,分别针对胃癌(包括胃食管交界癌)和胰 腺癌。
我国药企积极布局Claudin18.2靶点,多款产品出海
我国药企也积极布局Claudin18.2靶点,如信达生物、科济药业、君实生物、石药集团、宝船生物、绿叶制药、齐鲁制药、礼新医药。其中信达生物在该领域布局广泛,开发了Claudin18.2靶向单抗IBI360、双抗IBI389、CAR-T疗法IBI345和ADC药物IBI343。
值得一提的是,我国药企大多自主研发Claudin18.2靶向药,且多款药物顺利出海:
● 2021年8月,石药集团宣布其附属公司NovaRock将Claudin 18.2靶向单抗NBL-015在中国大陆、港澳台以外地区的开发、制造、商业化等多项权利独家授权给Flame Biosciences,交易金额达6.4亿美元;
● 2022年4月,和铂医药将其Claudin 18.2/CD3靶向双抗HBM7022的全球权益授权给阿斯利康,交易金额超3.5亿美元;
● 2022年5月,礼新医药将ADC药物LM-302在全球除大中华区与韩国以外国家及地区的开发和商业化权益独家授权给Turning Point,预期总交易金额超10亿美元;
● 2022年7月,石药集团将其Claudin 18.2靶向ADC药物SYSA1801在大中华地区(包括中国大陆、香港、澳门及台湾)以外地区的开发及商业化权利授权给Elevation Oncology,潜在交易总金额高达11.95亿美元。
而且,今年7月科伦药业与默沙东就其治疗实体瘤的ADC药物达成了一项合作及独家许可协议,业界推测交易项目就是Claudin 18.2靶向的SKB315,据悉该项交易金额超9亿美元。
总结
Claudin 18.2因其高度选择、稳定地表达于胃癌等恶性实体瘤,已成为实体瘤新药开发的热门靶点。照目前进度,安斯泰来有望率先在Claudin 18.2领域突围,我国药企在该领域的实力也不容小觑,开发出了多款新药。期待Claudin 18.2靶向药可以早日获批上市,造福广大实体瘤患者。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57