2022年12月20日,第一三共/阿斯利康共同宣布,Enhertu (通用名:德曲妥珠单抗) 已在欧盟 (EU) 获批作为单药疗法用于治疗既往接受过基于曲妥珠单抗方案的晚期HER2阳性胃癌或胃食管交界处 (GEJ) 腺癌成人患者。
此次批准是欧盟委员会在2022年11月欧盟人用医药产品委员会(CHMP)的积极意见之后以及基于DESTINY-Gastric02和DESTINY-Gastric01 II期试验的结果。
关于DESTINY-Gastric02
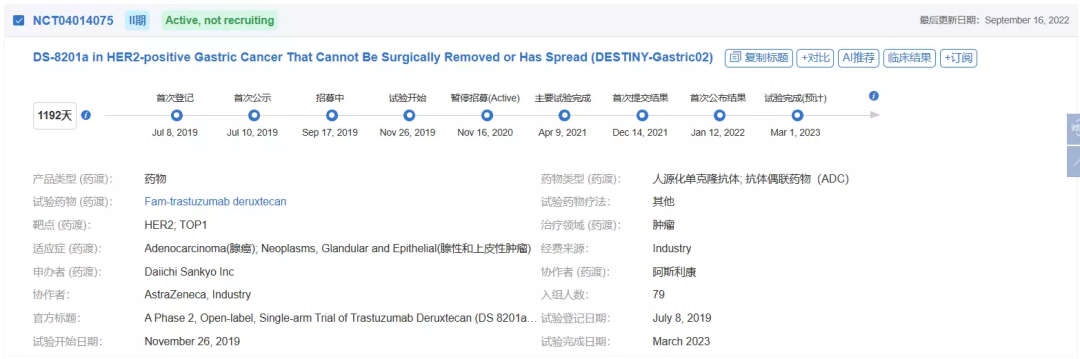
DESTINY-Gastric02是一项开放标签、单臂II期试验,评估Enhertu(6.4 mg/kg)在含曲妥珠单抗的方案中或之后疾病进展的HER2阳性转移性和/或不可切除的胃或胃食管交界处(GEJ)腺癌患者中的疗效和安全性。
DESTINY-Gastric02的主要终点是基于ICR确认的ORR。次要终点包括无进展生存期(PFS)、OS、DoR和安全性。
来源:药渡数据库
在有北美洲和欧洲共79名患者入组的DESTINY-Gastric02试验中,经独立中心审查(ICR)评估,德曲妥珠单抗治疗组的确认客观缓解率(ORR)为41.8%。中位缓解持续时间 (DoR) 为8.1个月。
关于DESTINY-Gastric01
DESTINY-Gastric01是一项随机、开放标签的II期试验,评估Enhertu(6.4mg/kg)在主要 HER2阳性(定义为免疫组织化学 [IHC]3+或 IHC 2+/原位杂交+)晚期胃癌或胃食管交界处(GEJ)腺癌,经两种或多种既往治疗方案(包括氟嘧啶、铂类化疗和曲妥珠单抗)后出现疾病进展人群中的疗效和安全性。
本项研究共招募187名患者,患者以2:1的比例随机接受Enhertu或医生选择的化疗(紫杉醇或伊立替康单一疗法)。
DESTINY-Gastric01的主要终点是ORR。次要终点包括OS、PFS、DoR、疾病控制率和治疗失败时间,以及药代动力学和安全性终点。

来源:药渡数据库
研究结果显示,根据ICR评估,Enhertu治疗组的确认ORR为40.5%,而化疗组(伊立替康或紫杉醇)为11.3%。Enhertu治疗组的中位DoR为11.3个月,而化疗组为3.9个月。与接受化疗的患者相比,接受Enhertu治疗的患者死亡风险降低了41%(基于0.59的风险比;95%置信区间:0.39-0.88;p=0.0097),中位总生存期 (OS) 为12.5个月对8.4个月。
关于Enhertu
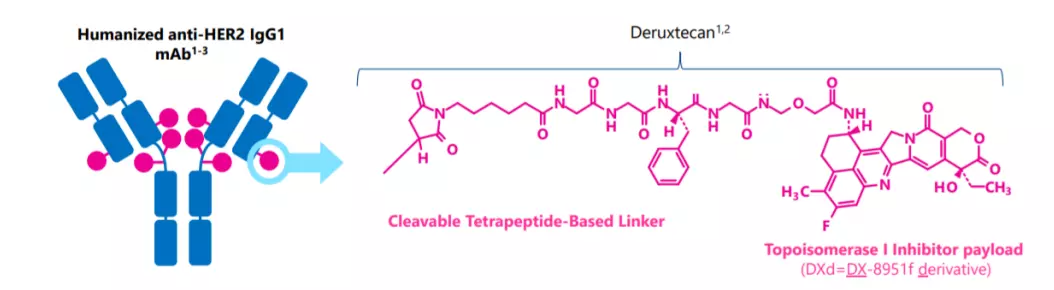
Enhertu是由阿斯利康和日本第一三共联合开发和商业化的一款独特设计靶向HER2的抗体偶联药物 (ADC)。Enhertu采用第一三共专有的DXd ADC技术设计,由人源化抗HER2单克隆抗体通过稳定的可裂解四肽连接子与拓扑异构酶-I抑制剂(喜树碱类衍生物DXd)连接组成。
来源:第一三共官网
获批里程碑
01 基于DESTINY-Breast03试验结果 Enhertu(5.4mg/kg)在超过40个国家被批准用于治疗不可切除或转移性HER2阳性乳腺癌成人患者,这些患者之前接受过一种(或一种或多种)抗HER2的治疗方案,并且在新辅助或辅助疗法期间以及之后六个月内疾病复发。
02 基于DESTINY-Breast01试验结果 Enhertu(5.4 mg/kg)在多个国家被批准用于治疗接受过两种或两种以上抗HER2治疗方案后的不可切除或转移性HER2阳性乳腺癌成年患者。
03 基于DESTINY-Breast04试验结果 Enhertu(5.4mg/kg)在巴西和美国被批准用于治疗不可切除或转移性HER2低表达(IHC 1+ 或 IHC 2+/ISH 阴性)乳腺癌的成人患者,这些患者在转移阶段接受过化疗,或在完成辅助化疗期间或六个月内出现疾病复发。
04 基于DESTINY-Lung02试验的结果 Enhertu(5.4mg/kg)在美国被以加速审批方式获准用于治疗肿瘤有激活的HER2(ERBB2)突变,且既往接受过系统治疗的不可切除或转移性NSCLC成年患者,HER2突变是通过FDA批准的测试方法检测。该适应症的继续批准可能取决于确认性试验中对临床获益的验证和描述。
05 基于DESTINY-Gastric01及/或DESTINY-Gastric02试验的结果 Enhertu(6.4mg/kg)在多个国家被批准用于治疗接受过以曲妥珠单抗为基础治疗后进展的HER2阳性局部晚期或转移性胃癌或胃食管交界处腺癌成人患者。
临床研发进展
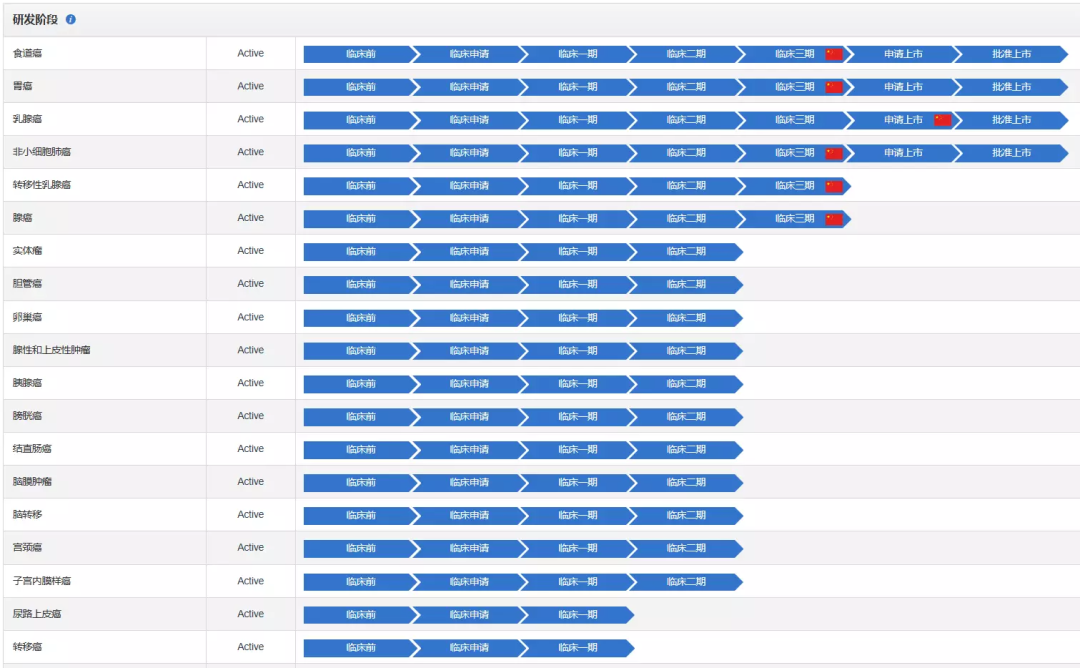
根据药渡数据调研,Enhertu单药在多种HER2为靶点癌症(包括乳腺癌、胃癌、肺癌和结直肠癌)中的疗效和安全性的全面研发计划正在全球范围内进行。联合免疫治疗等其他抗肿瘤治疗的试验也在进行中。
Enhertu用于乳腺癌、非小细胞肺癌和胃癌的申请目前正在不同国家和地区处于审评中。
来源:药渡数据库
参考来源
阿斯利康、第一三共官网
药渡数据库



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57