2023年1月9日,CDE官网显示,礼来公司(Eli Lilly and Company)申报1类抗体新药Donanemab注射液被CDE纳入“拟突破性治疗品种”公示,拟定适应症为:早期症状性阿尔茨海默病,包括阿尔茨海默病所致的轻度认知障碍以及轻度阿尔茨海默病。Donanemab是靶向被称为N3pG修饰的Aβ蛋白(β淀粉样蛋白)的抗体药物,具有不错的治疗阿尔茨海默病的潜力。
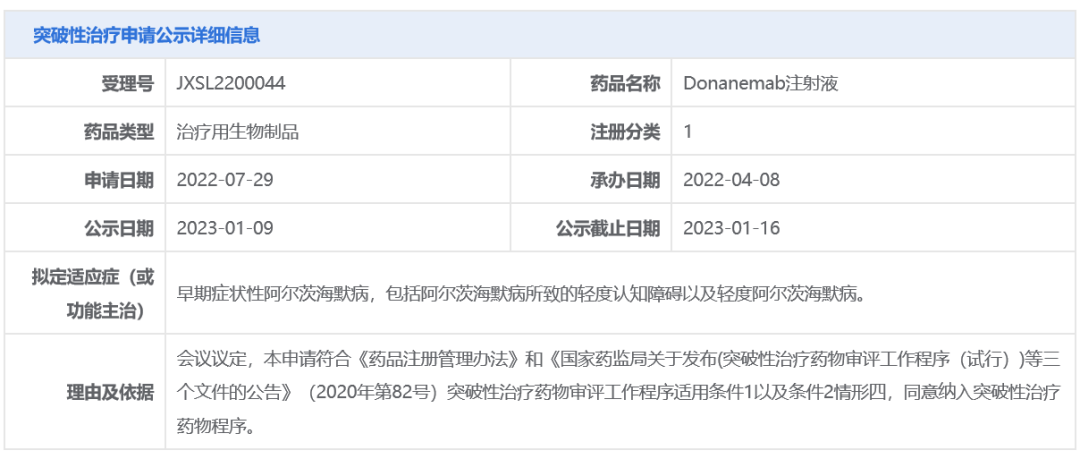
来源:CDE官网
关于阿尔茨海默病和Aβ假说
阿尔茨海默病(AD)是一种进行性神经退行性疾病,是老年痴呆症最常见的形式,其特征是认知能力下降,慢慢破坏人的记忆和思考能力。据估计,目前全球超5000万人患有老年痴呆,预计到2050年,这一数字将增加到近1.52亿。而在中国,老年痴呆患病人数已破千万,居全球首位,随着人口老龄化的到来,这一数字预计2050年将达2800万。庞大的患病人群,潜在的超级巨大市场,引得各大制药巨头投入天量资金研发抗阿尔茨海默病新药,但收获甚微。迄今为止,仅有为数不多的几款饱受争议的新药上市。
目前,阿尔茨海默病的具体病因尚不完全清楚。大家比较公认的假设是:毒 性β类淀粉蛋白斑块的异常沉积(Aβ假说)和tau蛋白质缠结的积累。Aβ假说是阿尔茨海默病领域研发最深入的方向之一,研究人员试图通过减少这些蛋白的沉积来延缓病情进展。在针对Aβ方向,有几十款新药曾进入过临床研发阶段,但大都研发失败或者终止试验。截止目前,全球范围内已经上市的两款Aβ新药均为卫材(Eisai)和渤健(Biogen)合作开发,分别为Aducanumab(Aduhelm)和Lecanemab(Leqembi)。这两款新药的获批,也给饱受争议的Aβ假说增加了足够的官方认可,给相关新药研发企业吃了定心丸。
关于Donanemab
Donanemab是一款靶向被称为N3pG修饰的Aβ蛋白(β淀粉样蛋白)的单克隆抗体,它能够与阿尔茨海默病患者大脑中淀粉样蛋白沉积中的β淀粉样蛋白结合,从而促进患者大脑中淀粉样蛋白沉积的清除。早在2021年10月,礼来向美国食品和药物管理局(FDA)滚动提交生物制品许可申请(BLA),寻求加速批准单抗药物Donanemab,用于治疗早期阿尔茨海默氏症(AD)。此前,该药获得美国FDA授予的突破性疗法认定。Donanemab已经取得多项临床试验的积极结果,非常大的概率获得美国FDA批准上市。
临床研究结果
2022年11月30日,礼来在CTAD会议上首次公布了其Aβ单抗Donanemab头对头渤健已获批药物Aducanumab的III期临床TRAILBLAZER-ALZ 4研究数据。结果显示,在头对头临床试验中,相比于与Aduhelm,礼来的Donanemab拥有更强的清除患者大脑中淀粉样蛋白的能力。在临床试验中,经过6个月的治疗后Donanemab和Aduhelm组患者达到淀粉样蛋白斑块完全清除的比例分别为37.9%和1.6%,淀粉样蛋白斑块水平分别比基线水平降低了65.2%和17%。安全性方面,两者的 ARIA 发生率为 25.4% vs. 26.1%,其中包括 2.8% vs. 4.3% 有症状。

此前,2021年3月13日,Donanemab治疗阿尔茨海默症的二期临床数据发表在新英格兰医学(NEJM)期刊上。这项试验共纳入了257例患者,其中131例接受了Donanemab治疗。治疗76周后,Donanemab组患者的iADRS评分(综合阿尔茨海默病评定量表)从基线降低了6.86,而安慰剂降低了10.06(95% CI, 0.12-6.27, p=0.04);淀粉样蛋白斑块水平和tau蛋白负荷则分别降低了85.06和0.01。不过,大多数次要终点指标无显著差异。此外治疗组有淀粉样蛋白相关的脑水肿事件发生,但大多无症状。
结果显示,在早期阿尔茨海默病患者中,与安慰剂相比,在76周时,Donanemab在认知和日常生活活动能力方面的综合评分更高。尽管四项次要终点CDR-SB、ADAS0Cog13、ADCS-iADL和MMSE也有一定程度的改善,但均未达到统计学显著,意味着错失所有次要终点。

国内临床试验进展
截止目前,Donanemab在全球已经开展了多项临床试验,在国内开展了分别开展了一项I期和III期临床。其中2022年09月05日公示的临床试验,是一项多中心、随机、双盲、安慰剂对照、III期研究,旨在评估Donanemab在存在脑tau蛋白病理的早期症状性AD受试者中的安全性和有效性。该研究中国部分由首都医科大学宣武医院贾建平主任医师担任主要研究者,目标入组人数为中国400人。
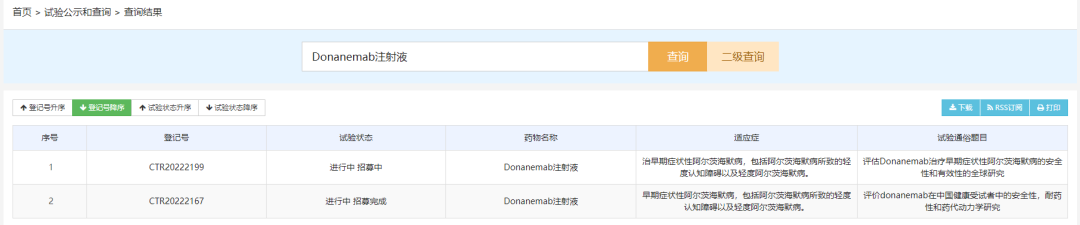
数据来源:CDE药物临床试验登记与信息公示平台
Aβ药物竞争格局
目前,根据药渡数据不完全统计,国内外已有3款阿尔茨海默病新药上市,分别为渤健/卫材开发的Aduhelm(美国上市)和Leqembi(美国上市)以及绿谷制药的甘露特钠胶囊(代号:GV-971,国内上市),其中Aduhelm和Leqembi均为Aβ药物。其余在研的Aβ药物有礼来的Donanemab、礼来的Birtamimab、恒瑞医药的SHR-1707等,具体信息见下表,期待阿尔茨海默病能够有更多安全有效的新药成功上市,为庞大的患者带来新的治疗选择。
靶向Aβ的新药研发部分信息
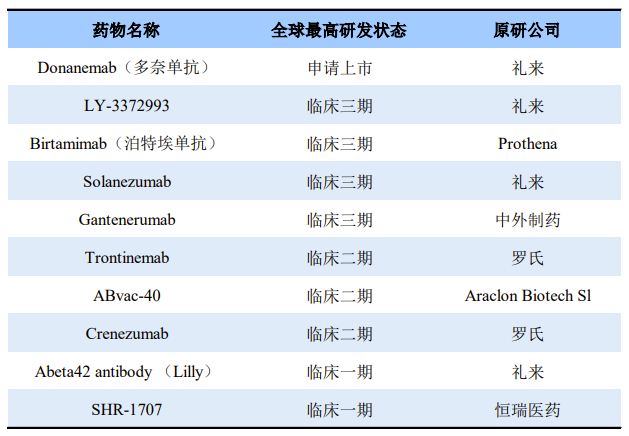
来源:药渡数据库



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57