2023年1月6日,卫材/渤健宣布Lecanemab获得FDA加速批准上市,用于治疗阿尔茨海默症(AD)。
根据确证性临床试验结果,卫材预期将于2022年财年结束之前,在美国申请完全批准,在日本和欧洲申请上市许可。此外,在2022年12月,卫材也向我国国家药品监督管理局(NMPA)提交了Lecanemab的上市申请。
此次美国获批,无疑为该药物通过我国审批审评提供了其他监管部门的参考,相信在不远的将来,这款药物也可以惠及我国AD患者。
获批新闻

来源:渤健官网
关于阿尔茨海默症(AD)
AD是常见痴呆症类型,表现为记忆力减退和认知损害(MCI)。作为一种进行性神经退行性疾病,病程随着时间恶化,严重时,患者可能会需要全天候护理。
根据世界卫生组织(WTO)数据,2022年全球约有3600万AD患者,预计将于2050年增长至9000万患者,为个人以及社会带来沉重的负担。根据卫材相关调研结果显示,如果没有治疗方式来延缓疾病,美国所有的支付者的护理总成本将由2020年的2670亿美元增加至2030年的4510亿美元。市场迅速增长的另一面,则是治疗药物的乏善可陈,存在巨大未满足的临床需求。
关于AD发病机制,目前主要有4大假说:基于β-淀粉样蛋白(Aβ)的淀粉样斑块假说;基于神经元元纤维缠结的tau蛋白假说;基于长期炎症反应造成脑损伤的炎症假说;基于神经突触功能失调及神经元死亡的神经保护假说。
其中,Aβ的沉积及神经元纤维缠结(磷酸化Tau蛋白)是关键治病因素。两者共同作用于神经突触,导致线粒体功能异常,最后致使神经元功能丧失、死亡。
关于Lecanemab
Lecanemab结构信息
来源:药渡数据库
Lecanemab是继Aducanumab后,全球第2款获批上市的Aβ单抗。
该药物可选择性结合并消除可溶性、毒 性Aβ聚集体(原纤维),这些聚集体被认为是导致AD的神经变性过程。因此,Lecanemab将会对疾病病理学产生影响,并减缓疾病的进展。
Lecanemab的全球开发和监管提交由卫材主导,产品则由卫材和渤健共同商业化和推广,卫材拥有最终决策权。
Lecanemab研发里程碑
2020年3月:卫材在中国大陆开展临床III期试验,用于治疗AD和轻度MCI。(CTR20200005)
2021年6月和12月:分别被FDA授予突破性疗法和快速通道的称号。
2021年9月:卫材和渤健向FDA提交上市申请,用于治疗AD。
2022年7月:FDA接受Lecanemab的BLA申请,并授予优先审查权。
2022年12月22日:卫材向NMPA提交上市申请,用于治疗AD。(JXSS2200039; JXSS2200040)
临床进展
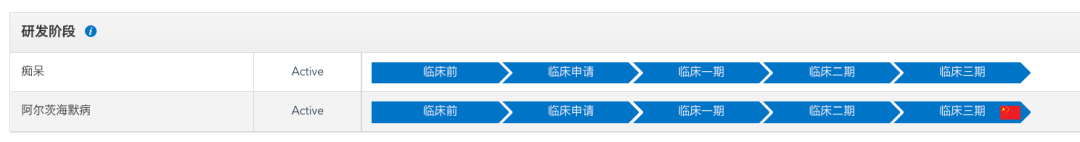
根据药渡数据调研,Lecanemab在研的三项适应症均处于临床后期,其中在AD方面,目前已在美国上市,在中国处于申请上市阶段。
Lecanemab临床进展

来源:药渡数据库
2022年9月,卫材和渤健共同宣布,Lecanemab在全球大型确认性III期临床试验Clarity AD中达到主要临床终点。
Clarity AD是一项全球验证性安慰剂对照、双盲、平行组、随机试验,在北美、欧洲和亚洲的235个研究中心纳入了1795例早期AD患者,试验中患者以1:1比例(Lecanemab组:898例;安慰剂组:897例)随机接受Lecanemab(10mg/kg静脉注射,每两周一次)或安慰剂治疗。主要终点为CDR-SB评分较基线变化,次要终点为PET检测的淀粉样蛋白负荷变化和ADAS-cog14、ADCOMS、ADCS-MCI-ADL量表评分变化。
结果显示:
接受治疗18个月后,Lecanemab组CDR-SB评分为1.21,安慰剂组为1.66,绝 对差值-0.45,评分下降延缓了27%。其他三项认知/行为评估结果也显示,Lecanemab带来了显著的改善。
安全性方面,最常报告的严重不良事件是输注相关反应、ARIA-E、房颤、晕厥及心绞痛。不过仑卡奈单抗的安全性令人担忧,试验中仑卡奈单抗治疗组出现了6例死亡,安慰剂组出现了7例死亡。不过调查人员认为死亡与Lecanemab及ARIA现象(淀粉样蛋白相关成像异常,可能是大脑水肿(ARIA-E)或微出血(ARIA-H)的迹象)均无关。
此次批准是基于II期临床试验Study 201的数据。数据显示,Lecanemab减少了Aβ斑块在大脑中的积累。同时,根据III期临床试验Clarity AD的结果数据,卫材将迅速向FDA提交补充生物制剂许可申请(sBLA),以便获得传统批准。
竞争格局
Aducanumb失败之后,角逐AD新药的有力候选人除了Lecanemab之外,还有礼来的Donanemab。
Donanemab是一种靶向N3pG(一种修饰类型的β淀粉样蛋白)的单抗,其PDUFA日期紧随Lecanemab之后,在2023年初将迎来结果。
2021年3月公布的II期临床试验TRAILBLAZER-ALZ结果显示:对比安慰剂,Donanemab达到了AD综合评分量表(iADRS)的主要终点,显著减缓了早期AD患者的认知和日常功能综合指标的下降。
2022年12月,礼来宣布III期临床试验TRAILBLAZER-ALZ 4的6个月主要结果分析显示达到所有主要和次要终点:
(1)6个月的治疗后,37.9%的Donanemab受试者实现了脑淀粉样蛋白斑块完全清除(定义为淀粉样蛋白水平<24.1 CL),而Aducanumb受试者比例为1.6%;
(2)6个月的治疗后,与基线相比,使用Donanemab治疗的受试者脑淀粉样斑块水平降低65.2%,而Aducanumb受试者降低了17.0%。
Donanemab临床进度

来源:药渡数据库
先前备受关注的罗氏的Gantenerumab,在这场竞赛中已经率先出局。
2022年11月,罗氏宣布Gantenerumab在两项早期ADIII期试验中均宣告失败,不仅没有达到减缓临床衰退的主要终点——与安慰剂相比Gantenerumab分别减缓了8%和6%的认知和功能下降,此外,β-淀粉样蛋白的去除水平也低于预期。
罗氏发言人表示,将停止所有Gantenerumab关于早期AD的研究,并暂停二级预防性研究 SKYLINE中的入组活动和给药。
Gantenerumab临床进度
来源:药渡数据库
其他处于临床末期的小分子类AD药物有ACADIA Pharmaceuticals的Nuplazid、Cassava Sciences的Simufilam、Axsome Therapeutic的Auvelity等。
更多在研AD药物竞争格局,可参考:从仑卡奈单抗在国内报产,浅谈阿尔茨海默病新药研究进展。
小结
根据卫材新闻稿,Lecanemab在美国市场的定价为2.65万美元/年。不足Aducanumb原先5.6万/年定价的一半,后者曾因高价以及疗效不确定引起广泛争议,因商业化失败最终退市。
尽管AD是研发坟场,但近年来能看到不少的突破。如果Donanemab也能顺利获批,将会进一步补充AD治疗手段,惠及全球患者。
参考资料
1. 药渡数据库
2. 卫材中国公众号
3. 卫材官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57