2023又是新的一年,根据CDE官网最新数据显示,截至1~11日,已经有多款备受关注的药物在国内首次提交了上市申请,涉及信达生物、齐鲁制药、迪哲医药等药企。
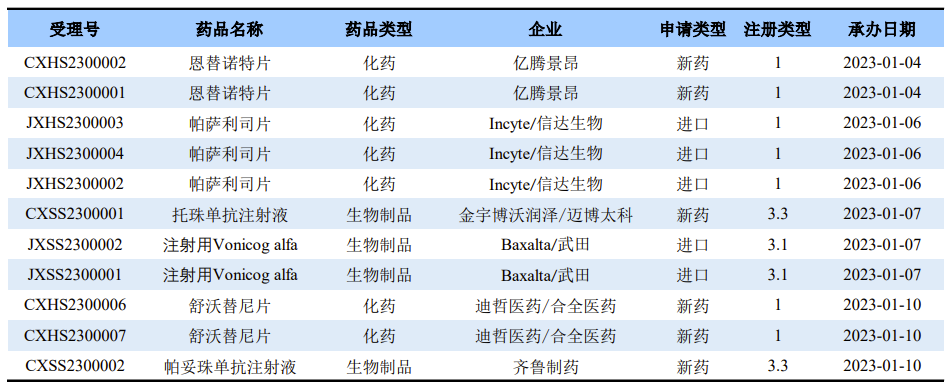
来源:药渡药物审评数据库
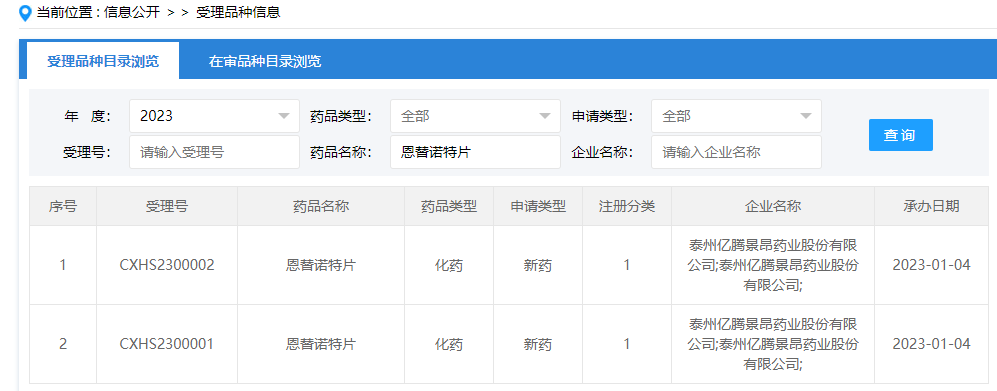
01 HDAC抑制剂:恩替诺特片

2023年1月4日,CDE官网显示,亿腾景昂药业首 款1类新药恩替诺特片(EOC103)的上市申请获国家药监局受理,用于治疗联合芳香化酶抑制剂用于治疗激素受体(HR)阳性、人类表皮生长因子受体2(HER-2)阴性,经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者。
恩替诺特是一种新型、口服的选择性组蛋白去乙酰化酶(HDAC)抑制剂,也是亿腾景昂创立以来首 款申请新药上市的I类创新药。恩替诺特可通过选择性抑制I类HDAC,特别是针对有代表性的HDAC 1、2、3亚型,从而改善和调节组蛋白的超乙酰化并促进特定基因的转录活化,最终抑制细胞增殖、加快终末分化和/或诱导凋亡。
此次NDA的递交是基于在中国开展的恩替诺特联合依西美坦治疗激素受体(HR)阳性、人类表皮生长因子受体2(HER-2)阴性晚期乳腺癌患者的III期临床研究结果。结果显示,恩替诺特联合依西美坦对比安慰剂组可显著改善患者的无进展生存期(PFS),差异具有统计学显著性,且安全性数据良好。
我国乳腺癌每年新发病例41.7万,死亡病例11.7万,是我国女性癌症发病率第一、死亡率第四的肿瘤。恩替诺特作为亿腾景昂的首 款创新药品,希望可以早日惠及更多乳腺癌患者,为他们带来更多健康生活的希望和帮助。
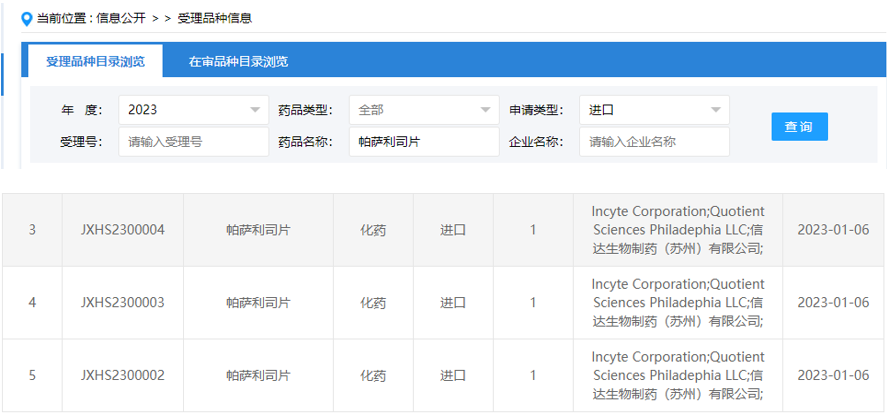
02 PI3Kδ抑制剂:帕萨利司片

2023年1月6日,CDE官网显示,Incyte公司与信达生物共同申报了1类新药帕萨利司片的新药上市申请,并获得受理。2022年10月25日,帕萨利司片(parsaclisib)被CDE纳入优先审评通道,用于治疗既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)的成人患者。
帕萨利司片是由Incyte公司开发的一种高选择性、新一代磷脂酰肌醇3-激酶δ(PI3Kδ)口服抑制剂,2018年12月信达生物与Incyte达成战略合作,得到该药物在中国大陆、中国香港、中国澳门和中国台湾地区的开发和商业化权利。
此次NDA受理及纳入优先审评是基于一项在中国开展的多中心、单臂、开放性2期临床(NCT04298879)研究结果。截至2021年12月12日,帕萨利司单药在既往接受过至少两种系统性治疗的FL患者(n=61)中的客观缓解率(ORR)为86.9%,其中19例患者(31.1%)达到完全缓解,34例患者(55.7%)达到部分缓解。中位缓解持续时间和中位无进展生存期尚未达到,绝大部分患者仍然处于持续疾病缓解。研究结果显示,帕萨利司普遍耐受良好,安全性可控。
中国新发非霍奇金淋巴瘤(NHL)患者人数达92,834例。滤泡性淋巴瘤(FL)是第二常见的NHL,在西方国家占NHL患者的22%~35%,在中国占NHL患者的8.1%~23.5%。期待帕萨利司片能够给国内滤泡性淋巴瘤患者带来新的治疗选择。
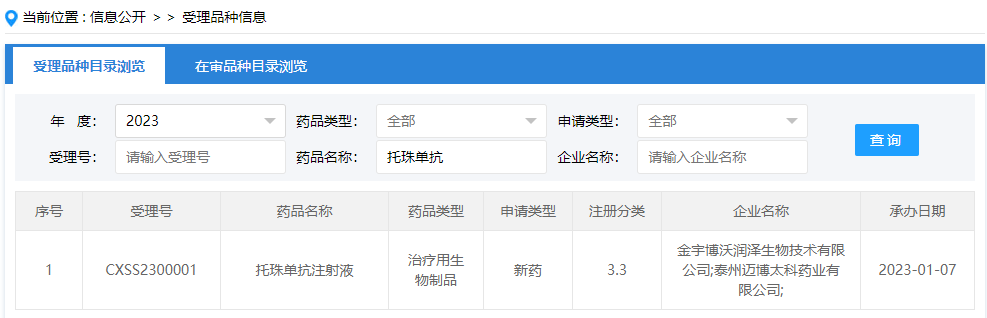
03 靶向IL-6受体单抗:托珠单抗注射液

2023年1月7日,CDE官网显示,金宇博沃润泽生物(金宇生物子公司)的治疗用生物制品托珠单抗注射液申报上市,成为继百奥泰、丽珠集团之后第3个在国内申报上市的托珠单抗生物类似药。
托珠单抗(Tocilizumab)是采用哺乳动物细胞表达的一种重组人源化抗人白介素6(IL-6)受体单克隆抗体,通过抑制IL-6受体的活性来发挥作用。该药最早由日本中外制药株式会社联合开发,商品名雅美罗(Actemra)。该药先后于2005、2009、2010、2013年在日本、欧洲、美国和中国获批上市,适应症涉及类风湿性关节炎、幼年特发性关节炎等自身免疫性疾病。2022年12月22日,罗氏宣布,FDA已批准托珠单抗(Actemra)静脉注射用于治疗住院成年患者的新型冠状病毒肺炎(COVID-19),这些患者正在接受全身性皮质类固醇并需要补充氧气、无创或有创机械通气或体外膜肺氧合(ECMO)。托珠单抗在新冠重症患者上的有效表现,引起了众多药企和患者的关注,市场潜力巨大。
2021年,托珠单抗在全球的的销售额高达41.23亿美元,市场前景广阔。目前国内布局托珠单抗生物类似药的企业有百奥泰、丽珠集团、金宇博沃润泽、海正药业等企业。2021年11月8日,百奥泰提交了托珠单抗生物类似药的上市申请。2021年12月22日,丽珠集团也紧跟步伐,提交了该药上市申请。值得一提的是,2022年12月9日,百奥泰发布公告,公司向美国FDA递交了BAT1806(托珠单抗)注射液的生物制品上市申请,并于近期收到了美国FDA受理的通知,有望登陆美国市场。金宇博沃润泽此次提交托珠单抗上市申请,成功跻身该药国内研发进度第一梯队,市场潜力值得期待。
04 血管性血友病因子(VWF)新药:注射用Vonicog alfa

2023年1月7日,CDE官网显示,武田制药提交的注射用Vonicog alfa上市申请已获得受理。这是一款重组血管性血友病因子,本次申请拟用于血管性血友病成人患者(18岁及以上)的按需治疗和出血事件控制,以及围手术期出血管理。Vonicog alfa是截至目前全球首 个也是唯一一个重组血管性血友病因子产品,将有望为中国血管性血友病成人患者带来全新治疗选择。

注射用Vonicog alfa包含完整的VWF多聚体,含有超大多聚体,半衰期长,可有效实现血管性血友病的替代治疗,并为患者提供个性化的出血控制方法。
在3期按需治疗临床试验中,评估了注射用Vonicog alfa针对血管性血友病成人患者(18岁及以上)的止血疗效,研究了联合或不联合重组凝血因子FVIII的不同给药策略按需治疗和出血事件控制。结果显示所有注射用Vonicog alfa联用或不联用重组凝血因子FVIII的受试者出血事件均得到控制,疗效评分为极好(96.9%)或良好(3.1%),且所有严重程度的出血事件均得到控制。此外,在另一项前瞻性、开放性、多中心试验中,评估了重度血管性血友病成人患者(18岁及以上)择期外科手术中注射用Vonicog alfa联用或不联用重组凝血因子FVIII的止血效果和安全性,研究结果显示,受试者在大手术和小手术的总体止血疗效为100%(15/15),其中,60%手术总体止血疗效为极好,40%手术总体止血疗效为良好。目前,该药已在美国、加拿大、英国、瑞士、澳大利亚和日本获批上市,期待该药在国内早日获批。
05 EGFR Exon20ins新药:舒沃替尼片

2023年1月10日,CDE官网显示,迪哲医药提交的1类新药舒沃替尼的上市申请获得受理。其适应症为:用于既往接受过铂类化疗、携带EGFR 20外显子插入(EGFR Exon 20ins)突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。值得一提的是,舒沃替尼是肺癌领域首 个且目前唯一获中、美双“突破性疗法认定”的1类新药。
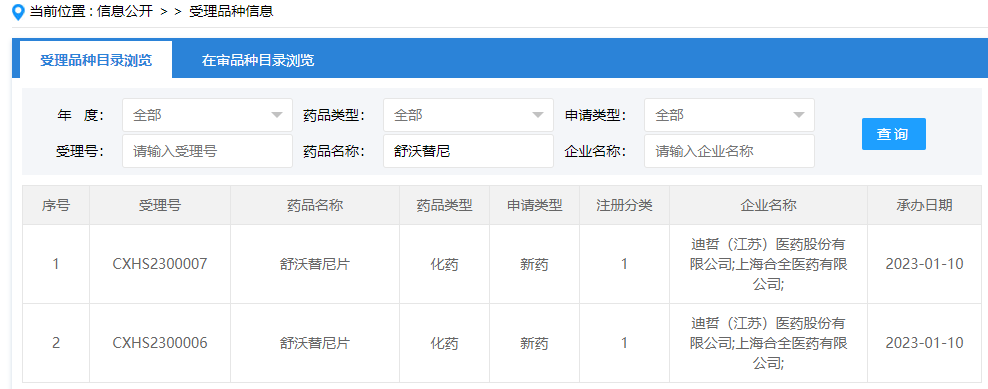
舒沃替尼是一款口服、不可逆、针对多种EGFR突变亚型的高选择性EGFR-TKI,其首选适应症为治疗EGFR 20号外显子(EGFR exon20ins)插入突变NSCLC。目前,该药正在中国、美国、欧洲、韩国、澳大利亚等国家和地区开展关键性注册临床试验。
递交此项NDA是基于一项中国注册临床试验WU-KONG6的结果,主要终点为盲态独立中心评估委员会(BICR)确认的肿瘤缓解率(cORR)。
WU-KONG6是一项在中国进行的开放、单臂、多中心II期注册研究,主要终点为盲态独立中心评估委员会(BICR)确认的客观缓解率(ORR)。截至2022年7月31日,接受舒沃替尼(300mg QD)治疗的97例经化疗失败的、EGFR exon 20ins晚期NSCLC患者,纳入疗效分析集。经BICR判定临床研究达到预设主要终点,经确认的ORR高达59.8%,比同类产品更优。研究提示,31例基线伴有脑转移的患者占比32%,经确认的ORR高达48.4%,比同类产品更优。研究共纳入30种EGFR exon20ins突变亚型,不论插入突变发生位置,均观察到抗肿瘤活性。
06 HER2单抗:帕妥珠单抗注射液

2023年1月10日,CDE官网显示,齐鲁制药帕妥珠单抗注射液的上市申请获受理,用于治疗HER2阳性乳腺癌。这是国内首 个申报上市的帕妥珠单抗生物类似药。
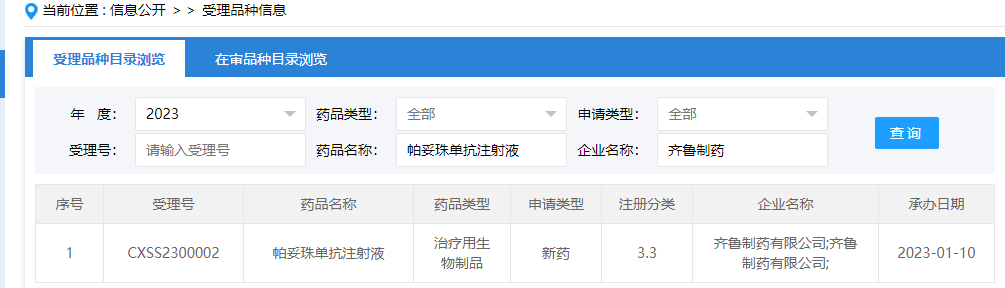
帕妥珠单抗(商品名为:Perjeta,帕捷特)原由基因泰克研发,后因罗氏收购基因泰克而将其收入囊中。这是一种重组人源化单抗,其靶向细胞为人表皮生长因子受体2蛋白(HER2)的二聚化结构区,通过抑制配体-启动细胞内信号的两条主要信号通路,丝裂原-激活的蛋白(MAP)激酶和磷酸肌醇3-激酶(PI3K),从而导致细胞生长停止和凋亡。单独使用帕妥珠单抗抑制人肿瘤细胞增殖,而帕妥珠单抗和曲妥单抗的联用显著增强抗肿瘤活性。
2018年12月,帕捷特在中国获批,用于联合曲妥珠单抗和化疗对高复发风险的HER2阳性早期乳腺癌患者开展辅助治疗。2021年,帕捷特全球范围内销售业绩为42.8亿美元,属于超级重磅药物。巨大的市场潜力,吸引了国内不少药企的关注。根据药渡数据库查询显示,目前国内布局帕妥珠单抗生物类似药接近10家企业,其中正大天晴、复宏汉霖、海正药业和石药集团的帕妥珠单抗生物类似药已处于临床III期阶段。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57