CCR8是CC基序趋化因子受体8(hemokine (C-C motif) receptor 8),作为一种在肿瘤浸润的调节性T细胞(Treg)上特异性高表达的趋化因子受体,其属于G蛋白偶联受体。CCR8有四种已知配体:CCL1、CCL8、CCL16和CCL18。大量研究表明:CCR8高表达与多种肿瘤,如结直肠癌、乳腺癌、胃癌等有关。因此CCR8被认为是一个极具潜力的肿瘤免疫靶点。
CCR8作用机制·引领未来
在了解CCR8作用机制之前,我们先了解一下什么是趋化因子和趋化因子受体。人体在防御和清除入侵病原体等异物时,有一种使免疫细胞定向趋化的功能,引起这种功能的物质称之为趋化因子。它是一类由细胞分泌的小细胞因子或信号蛋白,对癌细胞的迁移、侵袭和转移至关重要。趋化因子根据其氨基端(N端)半胱氨酸的排列方式,可分为CXC、CC、C(或XC)和CX3C四个亚族。
趋化因子受体是一种表达在一些特定细胞表面的跨膜G蛋白偶联受体(GPCRs)。趋化因子受体与细胞外的配体趋化因子结合,引发钙离子内流而产生细胞趋化反应,从而诱导细胞到生物体的特定部位。根据它们结合的趋化因子的类型,趋化因子受体被相应地分为四个亚族:CXCR、CCR、CR、CX3CR。
CCR8是唯一已知的CCL1受体。CCL1是由T淋巴细胞,单核细胞以及肥大细胞分泌的小分子糖蛋白。它分泌到肿瘤微环境中后,通过激活癌细胞上的CCR8受体,引起癌细胞的增殖、迁移和凋亡抵抗。
CCL1还可通过激活内皮细胞上的CCR8受体导致血管生成,促进肿瘤转移。另外,CCL1的另一个重要功能是募集Treg到肿瘤生态位,并导致CD4+T细胞转化为Treg。在药物研发方面,靶向CCR8的药物可以通过耗竭肿瘤浸润的FOXp3+CCR8+Treg细胞,或阻断CCL1/CCR8途径,来增强抗肿瘤免疫。
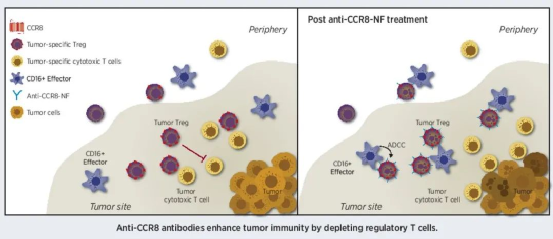
CCR8作用机制(来源:CancerRes 2021;81:2983–94)
CCR8药物研究进展·引领未来
CCR8作为极具潜力的肿瘤免疫靶点,研究尚处于早期阶段,但国内外已有多家药企布局,其中以靶向CCR8的单克隆抗体为主,也有少部分针对该靶点的小分子拮抗剂。

根据公开资料整理
BMS-986340是全球第一款开展临床试验的CCR8靶向性单克隆抗体,通过去岩藻糖基化增强抗体依赖的细胞介导的细胞毒 性作用(ADCC)。2021年5月,百时美施贵宝启动了一项I/II期临床研究,旨在评估其与O药联用对多种实体瘤的治疗效果。
LM-108是礼新医药自主研发的靶向CCR8的单抗,能够通过ADCC特异性清除肿瘤Treg细胞来调节肿瘤微环境,同时不影响外周Treg。目前LM-108正在进行两项临床试验,一项为2022年3月开始的临床II期试验,旨在评估LM-108作为单药或与抗PD-1抗体联合使用的安全性、耐受性、药代动力学和初步疗效,预计将在2024年6月完成试验。另一项为2022年4月在美国开展的一项II期临床试验,旨在评估LM-108作为单药或与Pembrolizumab联合治疗晚期实体瘤的安全性、耐受性、药代动力学和初步疗效。
S-531011是Shionogi开发的新型抗人IgG1抗体,在肿瘤浸润Tregs中选择性表达,对表达CCR8的细胞具有体外抗体依赖性细胞毒 性,并对CCL1-CCR8信号通路具有中和活性。动物和体外实验显示,小鼠静脉注射S-531011可显著减少肿瘤浸润性CCR8+ Tregs,并显著抑制肿瘤生长。此外,S-531011与抗小鼠PD-1抗体的联合治疗显示出比单药治疗更强的抗肿瘤作用,且没有任何明显的副作用。
JTX-1811是由Jounce Therapeutics开发的一款靶向CCR8的潜在FIC免疫疗法,其作用机理为靶向在肿瘤浸润性调节性T(TITR)细胞上富集的趋化因子受体CCR8,通过增强的ADCC机制,选择性清除肿瘤微环境中的TITR。
2020年9月,吉利德向Jounce支付8500万美元的预付款,并进行3500万美元的股权投资,获得JTX-1811项目的独家研发许可。目前JTX-1811已在美国获批临床。
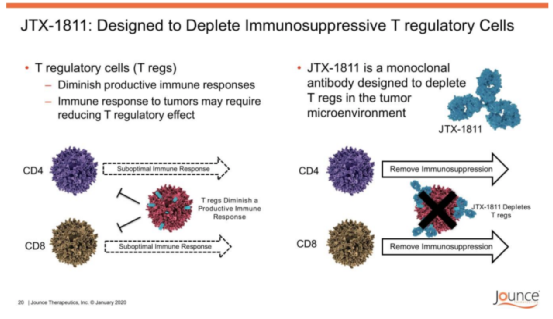
JTX-1811作用机制(来源:Jounce Therapeutics网站)
IPG7236是艾美斐生物自主研发的靶向CCR8的小分子抑制剂,它不仅能够抑制肿瘤细胞转移,也可以抑制肿瘤相关Treg细胞向肿瘤组织浸润,从而逆转肿瘤免疫抑制性微环境,增强抗肿瘤免疫反应。临床前研究显示,IPG7236能高效阻断肿瘤微环境中Treg浸润、扩增、降低其免疫抑制性,具有广谱抗肿瘤作用。目前IPG7236已获得FDA和CDE的IND批准,同时在中国和美国开展I期临床试验。
BAY-3375968是拜耳研发的一款依赖于ADCC和ADCP的靶向CCR8的人源化单抗。使用小鼠替代抗体进行的体内疗效研究表明,在多种小鼠肿瘤模型中,单一疗法具有很强的疗效,与肿瘤内CCR8+Treg缺失和CD8+T细胞增加明显相关。目前正在进行I期临床试验。
SRF114是一款完全人类IgG1抗CCR8的单抗,能特异性地与人CCR8结合,并通过抗体依赖的细胞毒 性效应(ADCC)诱导Treg破坏,同时保留外周Tregs。2021年2月,Surface Oncology从Vaccinex获得SRF114权益。目前,该项目处于I期阶段。
综上,CCR8靶点作用机制独特,有望成为肿瘤免疫治疗的下一代重磅药物靶点,因此CCR8靶向药开发前景较好。目前全球尚无CCR8靶向药获批上市,随着相关研究不断深入,有业内人士表示,CCR8靶向药有望于2026年左右进入市场,届时将为肿瘤患者提供更多的治疗方案。CCR8作为肿瘤免疫领域的新宠,未来谁将在这一片蓝海中率先突围,我们拭目以待。
参考:
1.Katritch V, Cherezov V, Stevens RC. Diversity and modularity of G protein-coupled receptor structures. Trends Pharmacol Sci. 2012 Jan;33(1):17-27.
2.Korbecki J , Grochans S , Gutowska I , et al. Cc chemokines in a tumor: A review of pro-cancer and anti-cancer properties of receptors ccr5, ccr6, ccr7, ccr8, ccr9, and ccr10 ligands[J]. International Journal of Molecular Sciences, 2020, 21(20):1-34.
3.Ming W, Zhongyu Q, et al. Tumor-derived exosomes drive pre-metastatic niche formation in lung via modulating CCL1+ fibroblast and CCR8+ Treg cell interactions. Cancer Immunol Immunother.2022 Nov;71(11):2717-2730.
4.F Dépis, Hu C , Weaver J , et al. Abstract 4532: Preclinical evaluation of JTX-1811, an anti-CCR8 antibody with enhanced ADCC activity, for preferential depletion of tumor-infiltrating regulatory T cells[C]// Proceedings: AACR Annual Meeting 2020; April 27-28, 2020 and June 22-24, 2020; Philadelphia, PA. 2020.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57