FDA 药物评估和研究中心 (CDER) 在过去的2022年只批准了 37 个新药,创造了5年内的新低<46(2017年)、59(2018年)、48(2019年)、53(2020年)、50(2021年)>,其中5款为孤儿药。2023年或将有17款孤儿药获批上市。
罕见病与孤儿药
相对于常发癌症、糖尿病等商业利润较大的适应症来说,无丙种球蛋白血症(Agammaglobulinemia)、古巴斯捷氏症候群(Goodpasture Syndrome)、肉芽肿性多血管炎(Granulomatosis with Polyangiitis,GPA)、施尼茨勒综合征(Schnitzler Syndrome)、小儿严重联合免疫缺陷(Pediatric Severe Combined Immunodeficiency)、非典型畸胎样/横纹肌样瘤 (AT/RT)等针对罕见病的药物的开发与上市,就显得弥足珍贵,也时常令患者和他们的家属心急如焚。
罕见病是影响一小部分人口的疾病。针对罕见病的药物被称为孤儿药(Orphan Drugs)。罕见性意味着缺乏足够大的市场来获得支持,也缺少资源来开发相应的孤儿药,除非政府提供经济扶持。
对于罕见病的定义,不同的国家地区采取不同的标准:
在美国,2002 年的《罕见病法案》严格根据患病率定义罕见病,特指那些“在美国影响不到 20万人的任何疾病或病症”, 相当于每 1500 人中约有 1 人患病。
在日本,罕见病的法律定义是在日本影响不到 5万名患者,即每 2500 人中约有 1 人患病。
欧洲公共卫生委员会将罕见病定义为“威胁生命或慢性衰弱的疾病,这些疾病的流行率很低,需要采取特别的联合努力来解决这些疾病”。 低流行率一词后来被定义为通常意味着每 2000 人中少于 1 人。 统计上罕见但不危及生命、长期使人衰弱或治疗不当的疾病被排除在其定义之外。
大多数罕见疾病起源于遗传,因此即使症状不会立即出现,也会贯穿人的一生。许多罕见病出现在生命早期,约有 30% 的罕见病患儿会在 5 岁之前死亡。
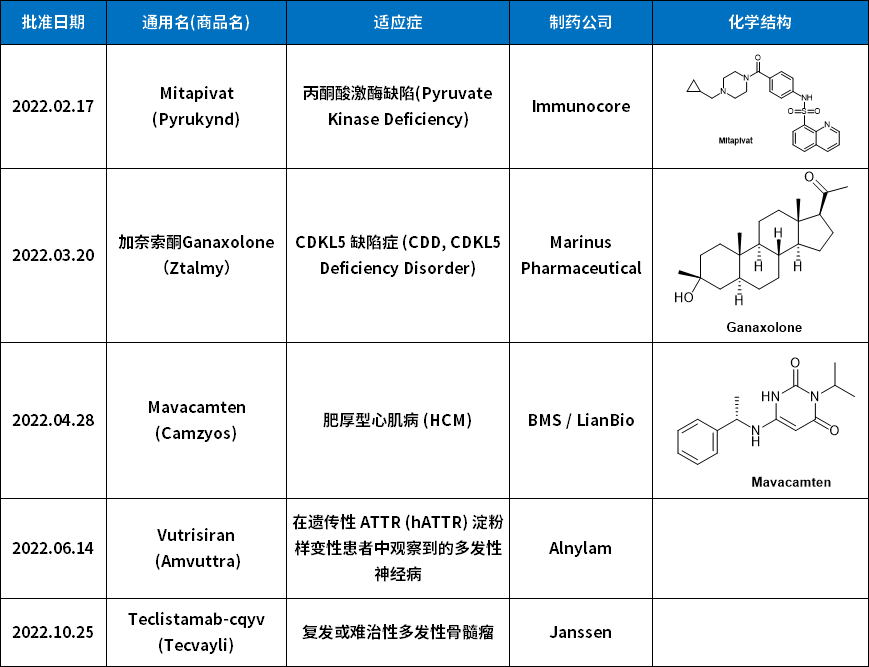
2022年FDA批准的5款孤儿药新药
2022年FDA 的药物评估和研究中心 (CDER) 批准的37款新药中,有5款孤儿药(表1)。
值得注意的是,表1仅仅总结了FDA在2022年批准的新药中的孤儿药。实际上,有很多药物再利用 (drug repurposing) 的开发都针对罕见病,他们获批的孤儿药并不在表1中体现。
例如 Eton Pharmaceuticals/Azurity Pharmaceuticals公司2022年获批的治疗癫痫的唑尼沙胺口服混悬液Zonisamide oral suspension。唑尼沙胺在2000年就经FDA批准上市,但唑尼沙胺 100 mg/5 mL 口服液体制剂于2022年7月18日获得FDA批准,用于治疗成人和 16 岁及以上患者。通过添加市售的液体制剂来帮助更好地控制患者的癫痫状态,可以满足更多的个人需求(癫痫从整体来说并不属于罕见病,然而有几种罕见的癫痫类型的发作难以控制,并且可能对家庭造成毁灭性的打击,这些类型的癫痫病被视为罕见病)。
根据统计,FDA每年批准的药物中,几乎半壁江山都属于孤儿药的行列。
表1 2022年FDA批准的孤儿药新药
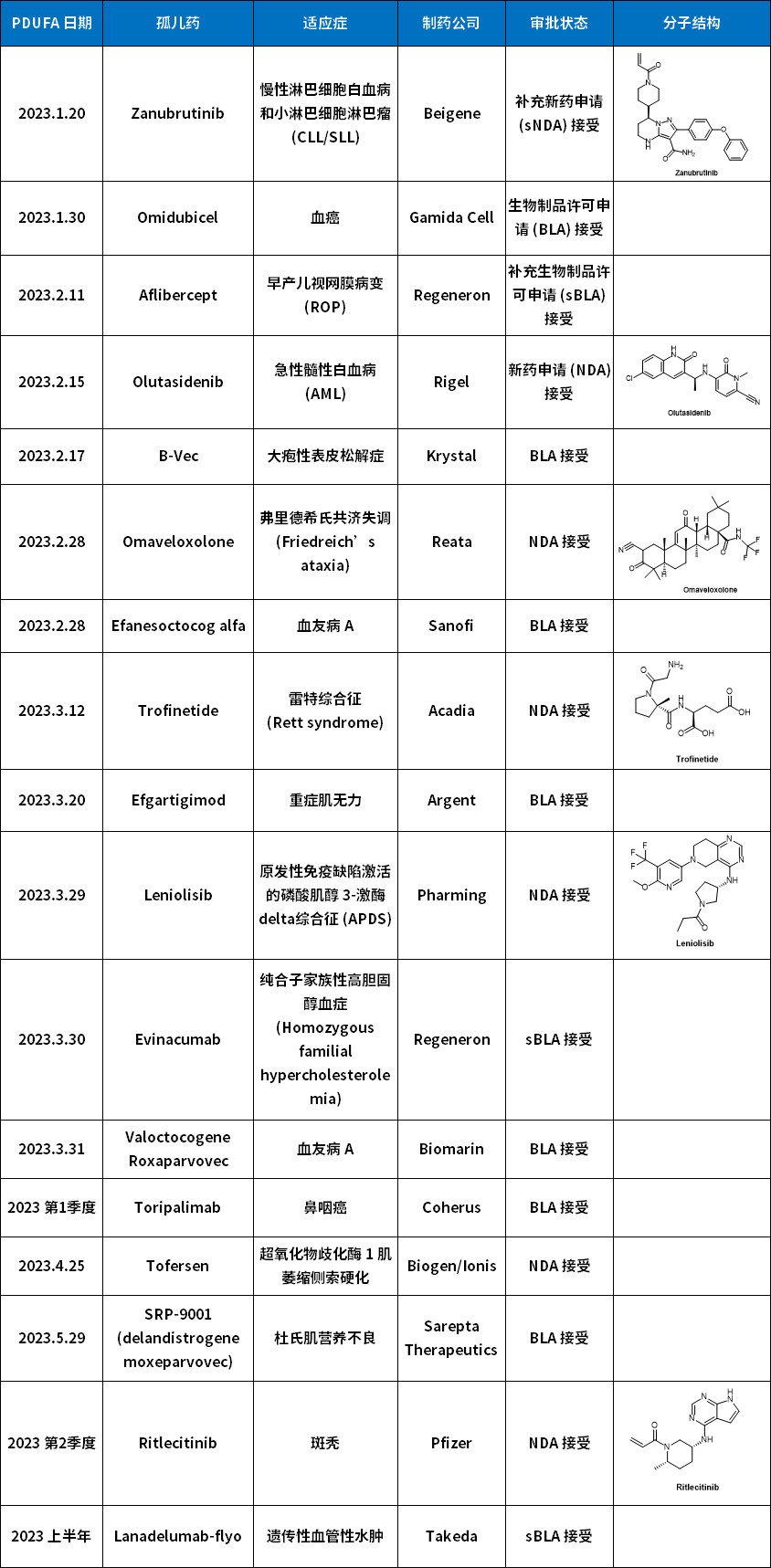
2023年孤儿药展望
17款或将获批
在美国药品监管实践中,PDUFA (处方药用户费用法案,Prescription Drug User Fee Act) 日期是指FDA必须对新药申请 (New Drug Application, NDA) 或生物制品许可申请 (Biologics License Application, BLA) 做出回应的日期的通俗名称。
PDUFA 日期是药物申请被 FDA 接受后 10 个月,如果药物被指定为优先审评,则为 6 个月。表2总结了FDA 2023 年所有孤儿药的重要监管日期及药物背景。
表2 FDA 2023年审批孤儿药NDA和BLA总结



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57