2023年2月3日,复宏汉霖自主研发的抗PD-1单抗H药汉斯状®(斯鲁利单抗,项目代号HLX10)联合化疗一线治疗食管鳞状细胞癌(ESCC)的3期临床研究(ASTRUM-007)结果在国际权威期刊Nature Medicine(影响因子:87.241)正式发表,该研究由国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院黄镜教授牵头开展。
图片来源:Nature Medicine官网
ASTRUM-007研究结果已于2022年11月在中国临床肿瘤学会(CSCO)年会上以口头报告亮相,并于同年12月在欧洲肿瘤内科学会亚洲年会(ESMO Asia)上进行了口头报道。此次正式发表于Nature Medicine,再次在国际学术舞台展现了中国医药企业自主研制PD-1单抗的创新水平和研发实力。
2022年9月,H药联合化疗一线治疗ES-SCLC的3期临床研究ASTRUM-005结果在全球四大顶级医学期刊之一的《美国医学会杂志》(JAMA,影响因子:157.3)在线发表,成为全球首 个登上JAMA主刊的小细胞肺癌免疫治疗临床研究,再度验证了国际学术界对该研究的高度认可。该研究结果在2022年美国临床肿瘤学会(ASCO)年会和2022 ESMO Asia年会发布。

适应症简介
01关于微卫星高度不稳定(MSI-H)成人晚期实体瘤
MSI-H肿瘤是指一类具有微卫星高度不稳定(MSI-H)表型的肿瘤,而微卫星不稳定性(MSI)是由DNA错配修复(MMR)蛋白功能缺陷导致的,这一分子特征在结直肠癌和子宫内膜癌等相关实体瘤中具有重要的临床意义。MSI-H在不同癌种中的发生率存在较大差异,目前已知MSI-H发生率较高的实体瘤包括子宫内膜癌(20%~30%)、胃癌(15%~20%)和结直肠癌(12%~15%,其中Ⅳ期结直肠癌4%~5%)等。据统计,中国每年新发MSI-H肿瘤患者逾30万,此类患者通常对于免疫检查点抑制剂有较高的应答率,PD-1/PD-L1作为重要的免疫抑制分子对于MSI-H特征型实体瘤患者具有较好的治疗效果。
02关于小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)
据GLOBOCAN数据显示,肺癌是全球发病率第二大高发癌种,2020年全球肺癌新发病例220万例,新发肺癌死亡病例180万例,位居癌症死亡人数第一。SCLC占肺癌总数的15%-20%,是肺癌中侵袭性最强的亚型,分为局限期小细胞肺癌(LS-SCLC)和广泛期小细胞肺癌(ES-SCLC),其中约30%-40%的患者确诊时处于局限期,其余处于广泛期,二者共同点是恶性程度高、转移早、疾病进展迅速,总体预后不良。对于ES-SCLC而言,免疫检查点抑制剂的出现为临床提供了新的治疗选择,目前抗PD-L1单抗联合化疗已陆续被最新版NCCN指南和CSCO指南推荐为ES-SCLC一线治疗方案,但近年来多款PD-1产品在ES-SCLC领域接连折戟,未使ES-SCLC患者真正获益。另一方面,手术、化疗同步放疗仍是治疗LS-SCLC的标准治疗手段,但大多数患者容易出现对药物产生耐药性或疾病迅速复发,传统化疗药物在LS-SCLC中无明显进展。
NSCLC约占所有肺癌的80%-85%,约50%的NSCLC患者在诊断时已处于不适合手术切除的局部晚期或已发生转移。而晚期鳞状非小细胞肺癌(sqNSCLC)约占晚期NSCLC的30%,治疗模式多以含铂双药化疗为主,疗效不甚理想,患者的中位生存期较短,很多不超过1年,因此,该领域存在着巨大的未满足的医疗需求。近年来,免疫检查点抑制剂在临床治疗中取得了诸多突破,在NSCLC方面也获得了长足的发展,尤其是抗PD-1单抗联合卡铂+白蛋白紫杉醇治疗晚期或转移性sqNSCLC已获得NCCN、CSCO等国内外权威指南推荐,并推动晚期NSCLC进入免疫治疗时代。
03关于食管鳞状细胞癌(ESCC)
食管癌是全球范围内十分常见的恶性肿瘤,主要分型为鳞状细胞癌和腺癌,90%以上属于食管鳞状细胞癌。我国是食管癌高发地区,根据2016年中国恶性肿瘤发病率及死亡率估计,我国食管癌新发病例25.3万,死亡病例19.4万,发病率及死亡率分别位列恶性肿瘤的第6位和第5位。由于早期食管癌症状往往不明显,大多数患者确诊时已处于临床中晚期,失去了手术治疗机会。目前临床对晚期患者主要采用系统治疗(化疗或靶向治疗),但治疗效果有限,复发率和转移率偏高。近年来,肿瘤免疫治疗已经成为国内外研究热点之一,多项研究表明抗PD-1单抗联合化疗可为食管癌患者带来生存获益,免疫检查点抑制剂联合化疗已成为我国食管癌的一线治疗标准。
关于H药 汉斯状®
H药汉斯状®为重组人源化抗PD-1单抗注射液(通用名:斯鲁利单抗注射液,Serplulimab),是复宏汉霖首 个自主研发的创新型单抗,同时为全球首 个获批一线治疗ES-SCLC的抗PD-1单抗。目前H药有3项适应症(MSI-H实体瘤、sqNSCLC和ES-SCLC)获批上市,1项适应症上市申请获受理(ESCC),10余项以H药为核心的联合疗法在全球多个国家和地区同步开展临床试验。以临床需求为导向,复宏汉霖就H药在消化道肿瘤和肺癌领域进行了差异化、多维度布局,适应症广泛覆盖肺癌、肝细胞癌、食管鳞癌、头颈鳞癌和胃癌等高发大癌种,在全球范围内累计入组逾3100名受试者。此外,H药分别被《2022 CSCO小细胞肺癌诊疗指南》、《中国食管癌放射治疗指南(2022年版)》纳入ES-SCLC和ESCC的一线治疗推荐。
01H药产品/联合疗法
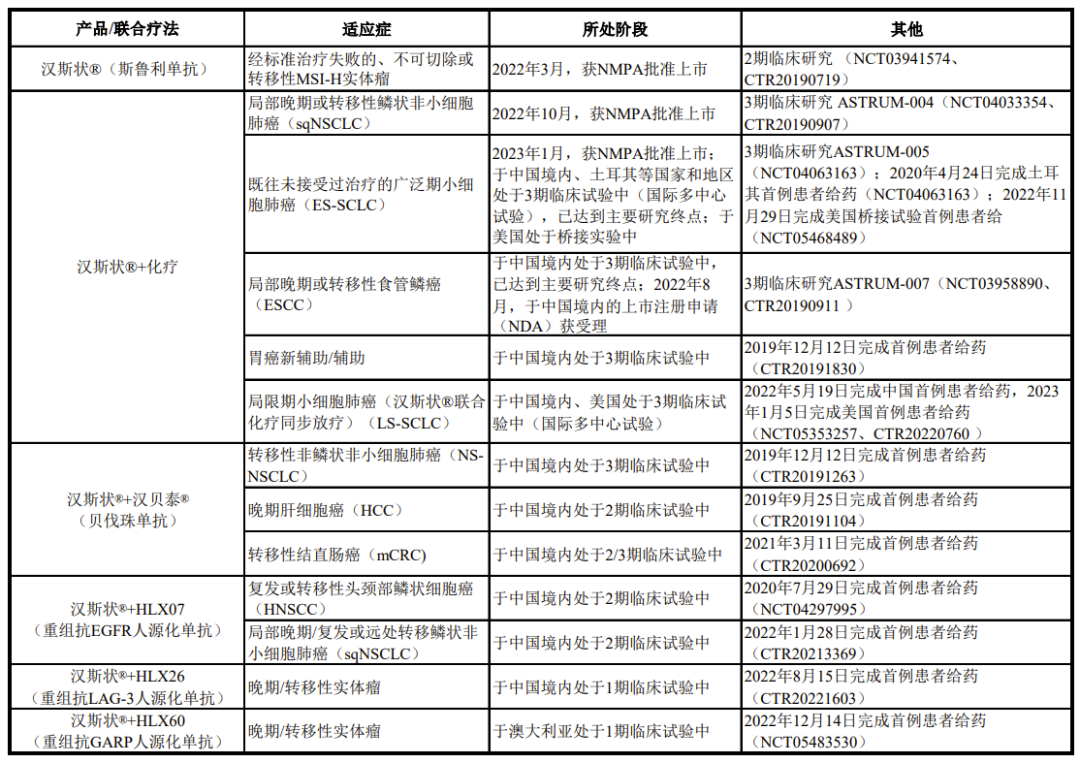
02微卫星高度不稳定(MSI-H)成人晚期实体瘤-中国上市的第一个适应症
2022年3月25日,复宏汉霖宣布NMPA已批准H药联合卡铂和依托泊苷适用于治疗经标准治疗失败的、不可切除或转移性微卫星高度不稳定(MSI-H)成人晚期实体瘤患者的一线治疗新适应症的上市注册申请(NDA)。2021年4月23日,该适应症的NDA获NMPA受理。此次获批主要基于一项单臂、多中心关键性2期临床研究(NCT03941574、CTR20190719)。研究结果表明,H药单药治疗既往标准治疗失败的、不可切除或转移性MSI-H实体瘤获益显著,达到预设的主要终点标准,且具有良好的安全性和耐受性。2021年4月28日,H药的该适应症被CDE纳入优先审评审批程序。
2022年ASCO年会上,复宏汉霖更新H药用于治疗MSI-H/dMMR实体瘤的关键性2期临床研究(NCT03941574、CTR20190719)数据。截至2021年7月10日,本试验共入组108名患者并纳入安全性分析集。结果表明,在主要疗效分析人群中及敏感性分析人群中,经评估的ORR分别为为39.7%和43.1%。中位DOR、PFS及OS尚未达到。主要疗效分析人群及敏感性分析人群的12个月生存率分别为74.5%和82.4%,在安全性分析集中,57(52.8%)名患者经历了三级及以上的治疗期间出现的不良事件(TEAEs),其中最常见的为贫血(9.3%)。13(12.0%)名患者经历了三级及以上的免疫相关不良事件(irAEs)。试验中未观察到新的安全信号。
对于泛瘤种适应症(MSI-H)的治疗,截至目前,国内共4款单抗药物获批,分别为复宏汉霖的PD-1单抗汉斯状®(斯鲁利单抗,H药)、百济神州的PD-1单抗百泽安®(替雷利珠单抗)、乐普生物的PD-1单抗普佑恒®(普特利单抗)、先声药业的PD-L1单抗恩维达®(恩沃利单抗)。其中只有只有H药和替雷利珠单抗是一线用药,且替雷利珠单抗的该适应症已进入2022年国家医保目录,但H药的12个月总生存率在同类产品中最高。考虑到该适应症依据特定的MSI-H肿瘤标志物进行筛查,不以癌种进行划分,覆盖患者群体广泛,H药在市场中尚有一战之力。
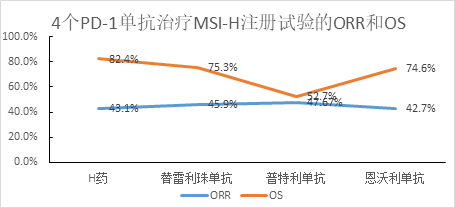
注:OS为12个月的总生存率,非头对头比较,来源:相应公司官网
03 鳞状非小细胞肺癌(sqNSCLC)-中国上市的第二个适应症
2022年11月1日,复宏汉霖宣布NMPA已批准H药联合卡铂和白蛋白紫杉醇适用于一线治疗不可手术切除的局部晚期或转移性鳞状非小细胞肺癌(sqNSCLC)新适应症的上市注册申请(NDA)。2021年9月16日,该适应症的NDA获NMPA受理。此次获批主要基于一项随机、双盲、国际多中心3期临床研究ASTRUM-004(NCT04033354、CTR20190907)。研究结果表明,H药联合卡铂和白蛋白紫杉醇治疗既往未接受治疗的局部晚期或转移性鳞状非小细胞肺癌获益显著,达到预设的主要终点,且具有良好的安全性和耐受性。
ASTRUM-004研究是一项全球多中心、随机、双盲、安慰剂对照3期临床研究,共纳入了537例未经治疗的局部晚期或转移性sqNSCLC患者,2:1随机分配至试验组和对照组,试验组接受斯鲁利单抗联合白蛋白紫杉醇+卡铂治疗,对照组接受安慰剂联合白蛋白紫杉醇+卡铂治疗。研究结果显示,总人群中,斯鲁利单抗联合化疗组中位PFS达8.28个月,较单纯化疗组延长2.56个月,疾病进展/死亡风险降低45%。中国人群亚组中,H药联合化疗组中位PFS达9.79个月,较单纯化疗组延长4.07个月,疾病进展/死亡风险降低56%,获益较全组人群更为显著。目前OS数据虽尚未成熟,但已初步观察到获益趋势,全组人群HR为0.75(95%CI 0.52~1.10),中国亚组HR为0.60(95%CI 0.39~0.92),期待未来更多生存数据披露。次要研究终点方面,斯鲁利单抗联合化疗中国人群ORR高达75.0%,中位DOR达10.64个月,比肩驱动基因突变阳性患者靶向治疗的疗效。同时,斯鲁利单抗联合化疗组与单纯化疗组的总体安全性类似,未出现新的安全性信号,常见免疫相关不良事件与其他同类药物类似。
对于鳞状非小细胞肺癌(sqNSCLC)的治疗,截至目前,国内共6款单抗药物获批,分别为复宏汉霖的PD-1单抗汉斯状®(斯鲁利单抗,H药)、默沙东的PD-1单抗可瑞达®(帕博利珠单抗,K药)、信达生物的PD-1单抗达伯 舒®(信迪利单抗)、恒瑞药业的PD-1单抗艾瑞卡®(卡瑞利珠单抗)、百济神州的PD-1单抗百泽安®(替雷利珠单抗)、基石/辉瑞的PD-L1单抗择捷美®(舒格利单抗),其中信迪利单抗、卡瑞利珠单抗、替雷利珠单抗的该适应症均已进入2022年国家医保目录。相较而言,虽然H药能显著延长鳞状非小细胞肺癌中位总生存率,但其优势不大,市场竞争力可能较弱。
04广泛期小细胞肺癌(ES-SCLC)-中国上市的第三个适应症
2023年1月17日,复宏汉霖宣布NMPA已批准H药联合卡铂和依托泊苷适用于广泛期小细胞肺癌(ES-SCLC)的一线治疗新适应症的上市注册申请(NDA),成为全球首 个一线治疗小细胞肺癌的抗PD-1单抗。2022年4月11日,该适应症的NDA获NMPA受理。该适应症为H药于中国获批上市的第三项适应症,H药亦为全球首 个获批用于一线治疗广泛期小细胞肺癌(ES-SCLC)的靶向PD-1的单抗药品。
2022年4月7日,复宏汉霖宣布H药用于治疗小细胞肺癌(SCLC)已获FDA授予孤儿药资格认定。2022年12月15日,复宏汉霖宣布H药用于治疗SCLC已获欧盟委员会(EC)授予孤儿药资格认定。目前全球尚无一线治疗SCLC的抗PD-1单抗获批,H药有望成为首 个一线治疗SCLC的抗PD-1单抗,填补未来五年PD-1抑制剂一线治疗SCLC的临床空白。
ASTRUM-005研究分析显示,H药(斯鲁利单抗)联合化疗组的中位OS达15.8个月,较对照组显著延长4.7个月,OS得到了明显改善,H药(斯鲁利单抗)联合化疗组患者死亡风险降低38%(HR=0.62,95%CI: 0.50~0.76)。亚裔人群中位OS达15.9个月,较对照组延长4.8个月(HR=0.63,95%CI: 0.49~0.81)。其独立影像评估委员会根据RECIST v1.1评估的中位PFS也获得了延长(5.8 vs. 4.3个月;HR 0.47,95% CI: 0.38~0.58)。研究结果表明,H药联合卡铂-依托泊苷一线治疗既往未接受过治疗的广泛期小细胞肺癌(ES-SCLC)患者获益显著,达到预设的主要终点,且具有良好的安全性和耐受性,并有望为亚裔人群带来更显著的潜在获益。
对于ES-SCLC的治疗,截至目前,全球范围内仅有靶向PD-1的单抗药物H药获批上市。于全球范围内获批用于ES-SCLC治疗的靶向PD-L1的单抗药品有阿斯利康的英飞凡®(度伐利尤单抗)和罗氏的泰圣奇®(阿替利珠单抗)。这3款药物均未进入国家医保目录。此前,两款PD-1单抗—百时美施贵宝的O药、默沙东的K药,都因为确证性试验的阴性OS结果,而陆续撤销了该适应症的上市申请。目前H药具有全球ES-SCLC一线免疫治疗最长中位总生存率,且小细胞肺癌免疫治疗注册研究中最低HR值,亚裔人群疗效更优。基于此,H药被《2022 CSCO小细胞肺癌诊疗指南》纳为ES-SCLC的一线治疗推荐,国内外市场前景广阔。

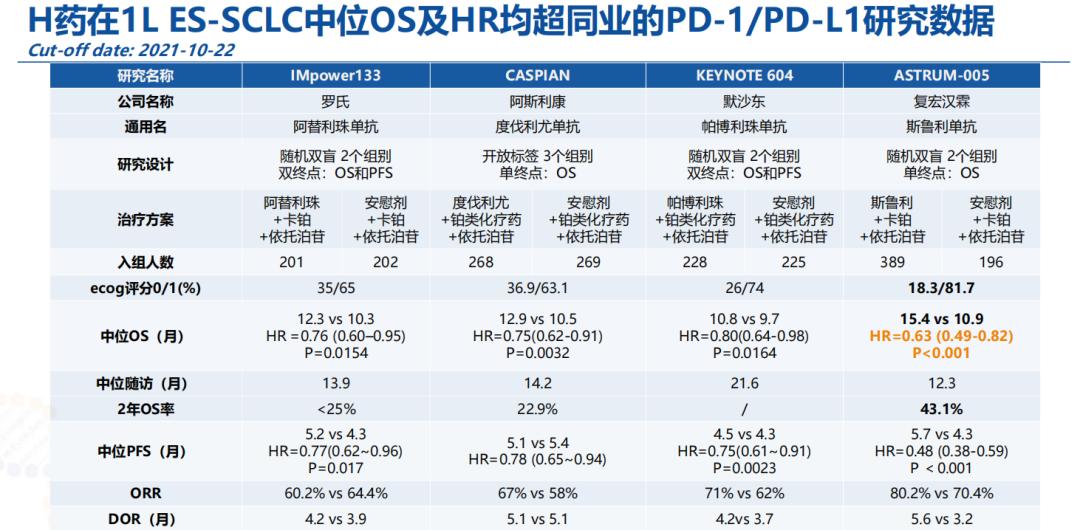
图片来源:复宏汉霖2022年中期业绩推介材料
05食管鳞状细胞癌(ESCC)-上市申请获NMPA受理
2022年8月26日,复宏汉霖宣H药联合顺铂和氟尿嘧啶(5-FU)一线治疗局部晚期/复发或转移性食管鳞状细胞癌(ESCC)新适应症的NDA获NMPA受理,该适应症为H药在中国第四项申报上市的适应症。2022年5月18日,复宏汉霖宣布该临床3期ASTRUM-007(NCT03958890)达到了PFS和总生存期OS的双主要研究终点。结果显示,与单纯化疗相比,H药(每2周一次)作为一线治疗方案显著改善了PD-L1阳性晚期ESCC患者的PFS和OS,此治疗方案可能成为该患者群体的新标准治疗选择。
ASTRUM-007(NCT03958890)是一项随机、双盲、多中心的3期临床试验,旨在研究斯鲁利单抗对比安慰剂分别联合化疗在既往未接受治疗、PD-L1阳性(综合阳性评分≥1)的晚期ESCC患者中的疗效和安全性。551例患者以2∶1的比例随机分组,两组患者分别接受斯鲁利单抗或安慰剂联合5-氟尿嘧啶(5-FU)和顺铂治疗(每2周1次)。斯鲁利单抗联合化疗组的中位无进展生存期(PFS)显著长于安慰剂联合化疗组(5.8 vs. 5.3个月;风险比[HR] 0.60,95% CI 0.48–0.75;p<0.0001)。斯鲁利单抗联合化疗组对比安慰剂联合化疗组的中位总生存期(OS)也获得了显著改善(15.3 vs. 11.8个月;HR 0.68,95% CI 0.53–0.87;p=0.0020)。安全性方面,斯鲁利单抗联合化疗的安全性良好。与单纯化疗相比,斯鲁利单抗联合化疗(每2周一次)作为一线治疗方案显著改善了PD-L1阳性晚期ESCC患者的PFS和OS,此治疗方案为该患者群体的治疗提供新选择。
对于食管鳞癌(ESCC)的治疗,截至目前,国内共7款单抗药物获批,分别为复宏汉霖的PD-1单抗汉斯状®(斯鲁利单抗,H药)、默沙东的可瑞达®(帕博利珠单抗,K药)、BMS的PD-1单抗欧狄沃®(纳武利尤单抗,O药)、乐普生物的PD-1单抗拓益®(特瑞普利单抗)、信达生物的PD-1单抗达伯 舒®(信迪利单抗)、恒瑞药业的PD-1单抗艾瑞卡®(卡瑞利珠单抗)、百济神州的PD-1单抗百泽安®(替雷利珠单抗)。其中信迪利单抗、卡瑞利珠单抗、替雷利珠单抗的该适应症均已进入2022年国家医保目录。虽然H药已于近日获得《中国食管癌放射治疗指南(2022年版)》推荐与化疗联用一线治疗PD-L1 CPS≥1的晚期食管鳞癌(II级推荐,1A类证据),但其他6款药物均是该指南中相同适应症的I级推荐,H药在该适应症下的市场竞争可能较为堪忧。
权益合作
2019年9月30日,复宏汉霖宣布与PT Kalbe Genexine Biologics(KG Bio)就H药签订独家许可协议,授予其H药用于相关疗法和适应症的独家开发和商业化权利,具体包括其首 个用于治疗高度微卫星不稳定型实体瘤(MSI-H)的单药疗法、两项联合疗法及KG Bio可根据《条约》选择引进的两项新适应症。其授权地包括东南亚的10个国家。基于《条约》,KG Bio将向复宏汉霖支付的主要款项包括:1)不可抵扣付款1000万美元;2)销售里程碑付款,将依照累计净销售额而定,共计不超过6.5亿美元;3)监管里程碑付款,共计不超过2200万美元;4)1000万美元联合疗法临床试验资金。预计总计金额最高可达6.92亿美元。
2022年12月27日,复宏汉霖宣布与复星医药达成合作,授予其在美国对H药包括广泛期小细胞肺癌(ES-SCLC)在内的适应症进行独家商业化的权益。根据协议条款,复星医药将负责H药在美国市场的商业化活动,复宏汉霖将负责H药在美国上市的产品开发、生产和供应,并将从此次交易中获得10亿人民币的首付款、潜在监管和销售里程碑付款及特许权使用费。
前景展望
据药渡数据不完全统计,截至2023年1月全球上市的PD-1共15款药物,在中国上市的有11款分别为:可瑞达®(帕博利珠单抗,K药)、欧狄沃®(纳武利尤单抗,O药)、拓益®(特瑞普利单抗)、安尼可®(派安普利单抗)、百泽安®(替雷利珠单抗)、达伯 舒®(信迪利单抗)、汉斯状®(斯鲁利单抗,H药)、开坦尼®(卡度尼利单抗)、誉妥®(赛帕利单抗)、艾瑞卡®(卡瑞利珠单抗)、普佑恒®(普特利单抗),剩余4种国外上市的药品为:Jemperli®(dostarlimab)、Libtayo®(cemiplimab)、Forteca®(prolgolimab)、BMS-986213(Relatlimab+Nivolumab),其上市药品的治疗领域主要为肿瘤,其次为感染和血液系统,适应症覆盖较为全面。
作为复宏汉霖首 个自主研发的生物创新药,H药面临不小的竞争。自2022年3月开始国内市场商业化,复宏汉霖2022年中期报告显示H药上市3个月内(4约2日开具首张处方)出厂合计1.6万支,已实现销售收入约为7700万人民币(约为1137万美元)。根据IQVIA MIDAS的资料,2021年度及2022上半年度,靶向PD-1的单克隆抗体药品于全球范围内的销售金额分别约为280.8亿美元及159.9亿美元。H药以临床迫切需求为出发点,加上潜在更强的生物学活性,且H药细分市场(主要指ES-SCLC)蓝海竞争优势较大,国际布局较为全面,临床在研适应症也较多,未来发展势头看好,H药大有可为。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57