2023年2月8日-10日,根据国家药品监督管理局药品审评中心(CDE)最新数据显示,CDE官网新增了10条的临床默示许可信息。经过梳理,其中有3款1类新药在国内获批临床,适应症涉及肿瘤和肝硬化。
图片来源:CDE官网
BCMA/CD19双靶点CAR-T
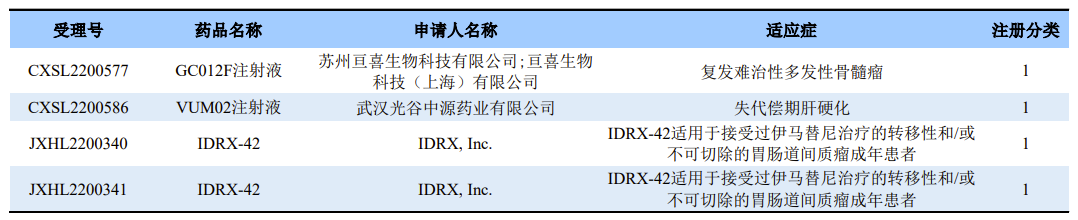
GC012F注射液

GC012F注射液是亘喜生物自主开发的一款BCMA/CD19双靶点CAR-T细胞疗法,本次临床默示许可适应症为复发难治性多发性骨髓瘤。资料显示,GC012F是一款双靶点自体CAR-T候选产品,能同时靶向B细胞成熟抗原(BCMA)和CD19两个治疗靶点,具有“次日完成生产”的独特优势。GC012F能带来快速、深入且持久的治疗效果,帮助多发性骨髓瘤及B细胞非霍奇金淋巴瘤患者提高治疗响应率,降低复发率。
根据中国临床试验注册中心的最新数据显示,GC012F在国内已经开展两项探索性研究。在2022年EHA年会期间亘喜生物公布了GC012F治疗复发/难治性多发性骨髓瘤(RRMM)积极的临床结果,数据显示,29例患者100%达到MRD阴性,进一步明确了其深度应答的疗效。GC012F在治疗RRMM的临床研究中不断展现出可靠的安全性和持久缓解的卓越疗效,即使针对伴有髓外病变和接受过蛋白酶抑制剂、免疫调节抑制剂以及抗CD38单抗等多重既往治疗的高危患者,仍然取得了令人鼓舞的15.7个月的中位缓解持续时间(mDoR)。在2023年2月3日,亘喜生物宣布GC012F获得美国FDA批准该药针对复发/难治性多发性骨髓瘤(RRMM)的新药临床试验(IND)申请,公司将在美国开展1b/2期临床试验。期待GC012F后续临床进展顺利,为国内患者带来新的治疗选择。

图片来源:中国临床试验中心
干细胞疗法
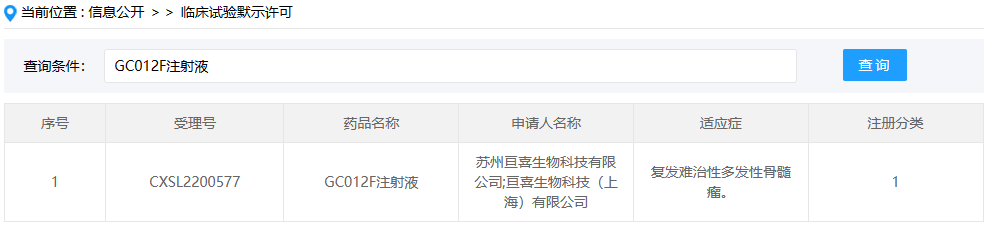
VUM02注射液

VUM02注射液(人脐带源间充质干细胞注射液)是光谷中源(中源协和的子公司)开发的一款冷冻保存型干细胞制剂,这是该药在国内首次获批临床,拟开展用于失代偿期肝硬化的临床研究。干细胞疗法是一个饱受争议的赛道,我们时刻关注着该领域的进展,期待能够有真正安全有效的干细胞疗法上市。
截至目前,全球尚未有用于治疗失代偿期肝硬化的同类细胞药物上市,研发进展最快的同类药物处于临床试验阶段,中源协和对该项目的累计研发投入为人民币已经超过千万元。
新型口服酪氨酸激酶抑制剂(TKI)
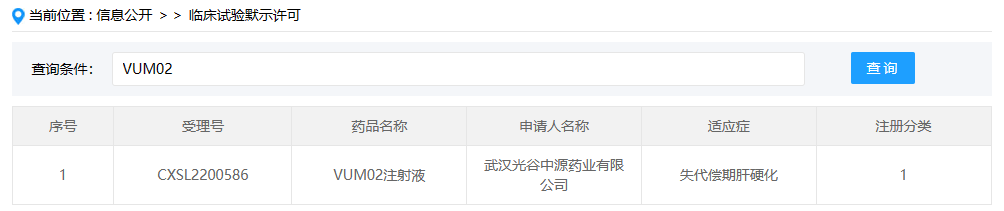
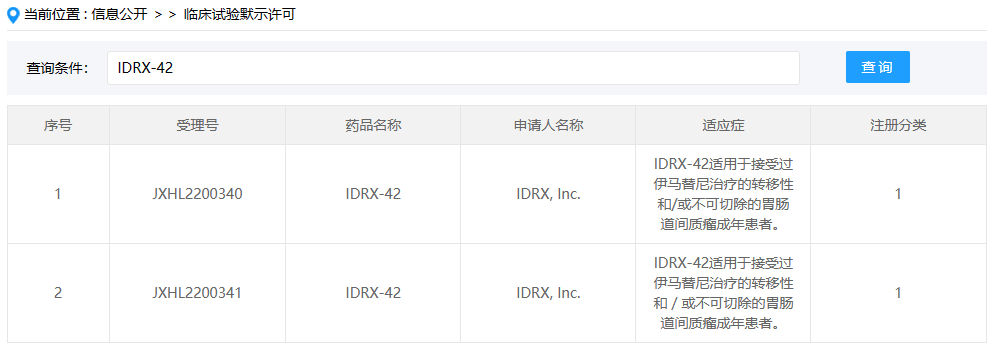
IDRX-42

IDRX-42是IDRX, Inc.开发的一款1类小分子新药,这是该药在国内首次获批临床,拟开展用于接受过伊马替尼治疗的转移性和/或不可切除的胃肠道间质瘤(GIST)成年患者。IDRX-42是一款新型口服酪氨酸激酶抑制剂(TKI),该药由德国默克(Merck KGaA)授权得来,在治疗胃肠道间质瘤中具有非常不错的潜力,在2022年已被美国食品药品监督管理局(FDA)授予孤儿药称号。
胃肠道间质瘤是一种罕见肿瘤,约占胃肠道恶性肿瘤的0.1%-3%。年发病率约为1-2.2/10万,平均发病年龄约60-65岁,男女发病率基本相同。在中国,由于人口基数大,每年约有1.4万-2.1万人新确诊胃肠道间质瘤。胃肠道间质瘤可发生于消化道任何部位,最常发生于胃(60%)及小肠(20%-30%),也可发生于结直肠和食管。近10年来,外科手术被公认为胃肠道间质瘤的唯一治愈方法,IDRX-42有望让患者们拥有更多的选择。
IDRx由Alexis Borisy创立,致力于在开发智能设计的药物组合,希望在癌症突变开始之前阻止癌症突变。在2022年8月,IDRx宣布获得1.22亿美元A轮融资,a16z和专注于生命科学投资的Casdin Capital共同领投,Forge Life Science Partners与Nextech Invest跟投。目前IDRx的研究进展包括名为IDRX-42(德国默克授权)和IDRX-73(Blueprint授权)的两种小分子酪氨酸激酶抑制剂。IDRX-42的1期人体临床试验(IDRX-42-001研究)已经启动,IDRX-73目前正在向临床推进。

图片来源:美国临床试验注册中心
IDRX-42-001研究是一项1/1B期、首次人体、开放标签、多中心研究,旨在评估单药IDRX-42在转移性和/或手术不可切除的GIST患者中的疗效,注册临床研究正在进行中(NCT05489237)。期待该药在GIST的后续表现,为这一比较缺少有效治疗手段的患者群体带来新的希望。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57