2022年全国药品申报依旧呈上升趋势,截止2022年12月31日,2022年度CDE受理的受理号个数高达12244个,较2021年增加了5.8%;本报告针对江苏省2022年药品申报与审评完结情况进行分析:
一、2022年江苏省药品申请受理与审评情况
1、2022年江苏省药品申报整体情况
1.1全年受理情况
根据药智注册与受理数据库最新统计,2022年CDE共承办江苏省新的药品注册申请1491个(以受理号计,下同,统计申报企业中包含注册地址在江苏省的企业),剔除补充申请(一致性评价受理号除外,下同)和进口数据后受理号884个,其中化药720个,中药16个,生物制品148个,较2021年减少了107个,占全国的受理总量比重的21.5%;2018-2022年江苏省药品注册申请受理情况(剔除补充、进口)详见图1。
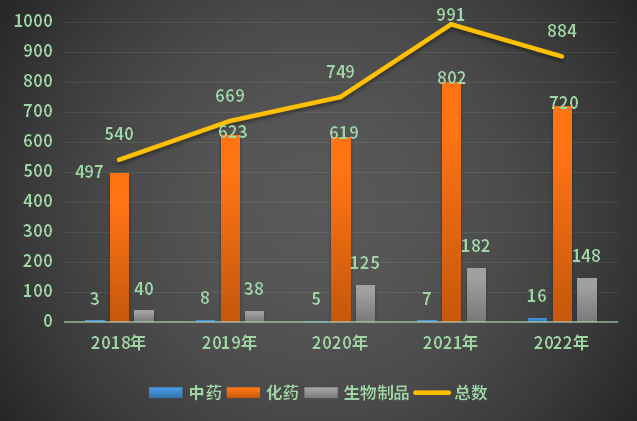
图1 2018-2022年江苏省药品受理情况(剔除补充、进口)
1.2全年各注册申请类型申报情况
2022年CDE受理江苏省药品注册申请以注册申请类别统计(剔除进口数据),受理新药临床试验申请(以下简称IND)受理号390个,新药上市许可申请(以下简称NDA)受理号49个,同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)受理号337个,仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称一致性评价申请)受理号76个。2018-2022年各申请类别注册申请受理量详见图2。
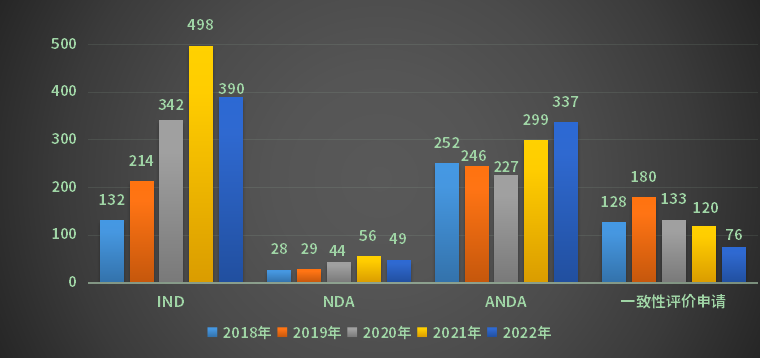
图2 2018-2022年各申请类别注册申请受理量
1.3新药注册申请受理情况
2022年江苏省新药申请(剔除进口)受理号415个,其中化药申请受理号272个,包含IND申请249个,NDA申请23个;中药申请受理号15个,包含IND申请11个,NDA申请4个;生物制品申请受理号128个,包含IND申请118个,NDA申请10个;2021、2022年江苏省新药申请受理情况详见图3。
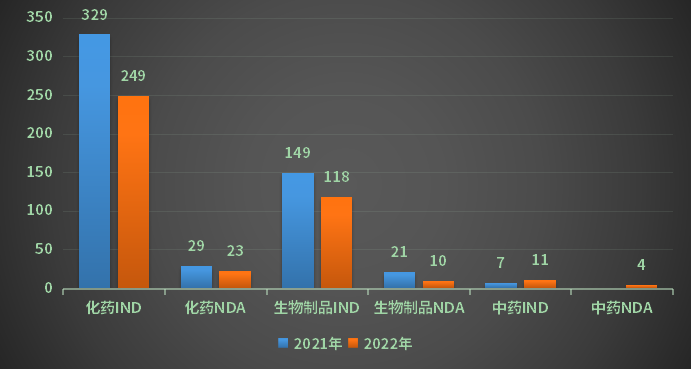
图3 2021、2022年江苏省新药申请受理情况
1.4申报地区情况
在国内各省市的药品申报方面(根据申报企业注册所在地统计,剔除补充、进口数据),2022全年申报江苏以884个受理号位居第一;2022年国内各省市申报情况见图4。
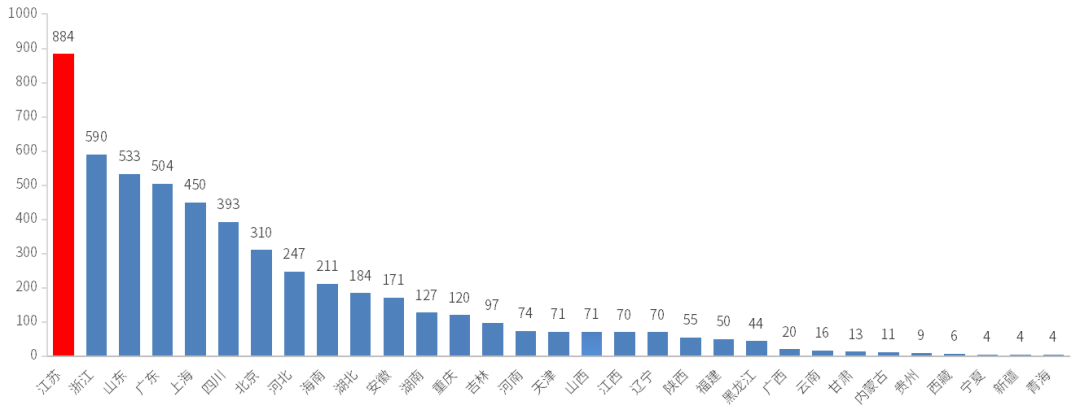
图4 2022年国内各省市申报情况
2、2022年江苏省药品完成审评情况
2.1全年完成审评整体情况
根据药智注册与受理数据库最新统计,2022年(注:状态开始时间(药智)从2022年1月1日至2022年12月31日)完成审评受理号1379个;药智收录到结论的数量为1329个受理号,对有结论的受理号进行分析统计,其中化药受理号1061个,中药受理号41个,生物制品受理号226个。2022年注册申请审评完结结论详情统计见图5。
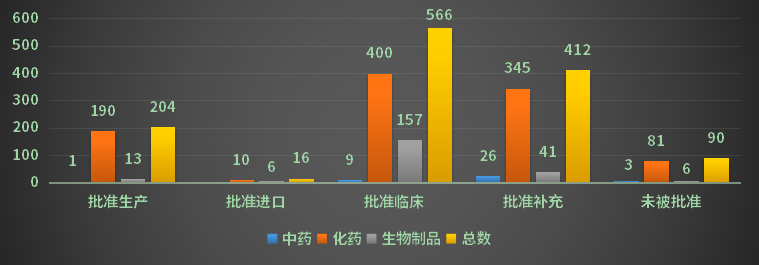
图5 2022年注册申请审评完结结论详情统计
以药品类型统计(剔除补充、进口),2022年全年化药完成审评受理号613个;中药完成审评受理号15个;生物制品完成审评受理号157个;2018-2022年各药品类型注册申请完成审评情况(剔除补充、进口)见图6。
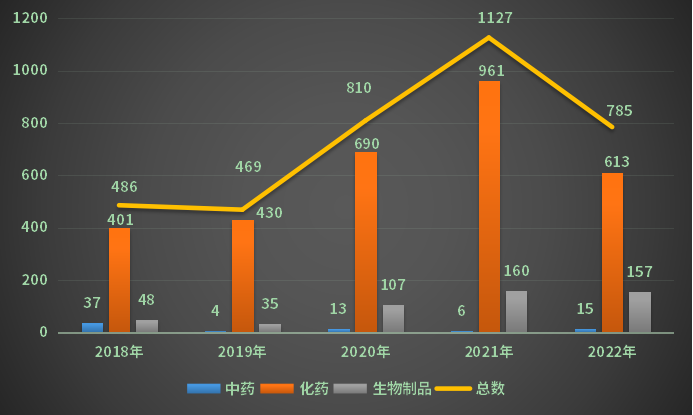
图6 2018-2022年各药品类型注册申请完成审评情况(剔除补充、进口)
2.2全年各注册申请类别完成审评情况
以注册申请类别统计(剔除进口),2022年审评完成审评的受理号中,IND受理号394个,NDA受理号33个,ANDA受理号218个,一致性评价受理号110个;2018-2022年各审评任务类别审评完成情况详见图7。
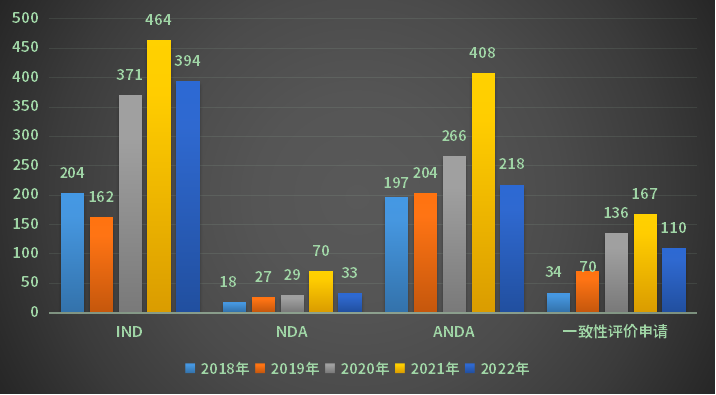
图7 2018-2022年各审评任务类别审评完成情况
二、2022年江苏省化药申报与审评情况
1、2022年江苏省化药申报情况
1.1化药整体受理情况
2022年CDE共受理江苏省化学药注册申请受理号1079个(剔除进口),以审评任务类别统计,IND申请受理号252个,ANDA申请受理号337个,NDA申请受理号23个,一致性评价申请受理号76个;2022年化学药各审评任务类别申请受理情况详见图8。

图8 2022年化学药各审评任务类别申请受理情况
1.2化药国产1类创新药申报情况
2022年受理江苏省化学药1类创新药受理号233个(93个品种);以审评任务类别统计,IND申请受理号221个,NDA申请受理号12个;2018-2022年江苏省国产化药1类创新药注册申请受理情况详见图9。
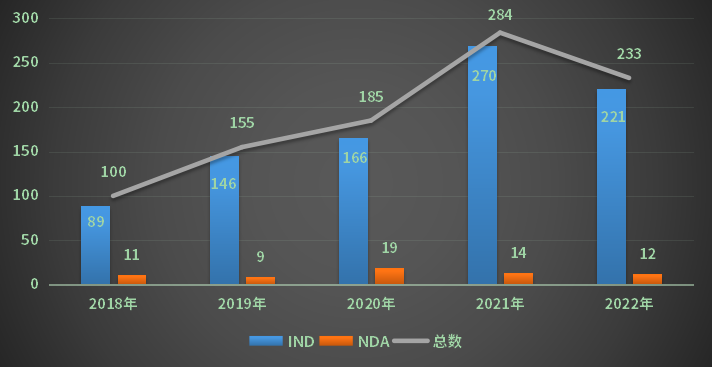
图9 2018-2022年江苏省国产化药1类创新药注册申请受理情况
1.3化药改良型新药申报情况
2022年CDE新受理江苏省国产化药2类改良型新药受理号39个,其中IND申请28个,NDA申请11个;对比创新药药的申请情况,改良型新药还有巨大的提升空间;2018-2022年江苏省化药2类改良型新药注册申请受理情况详见图10。
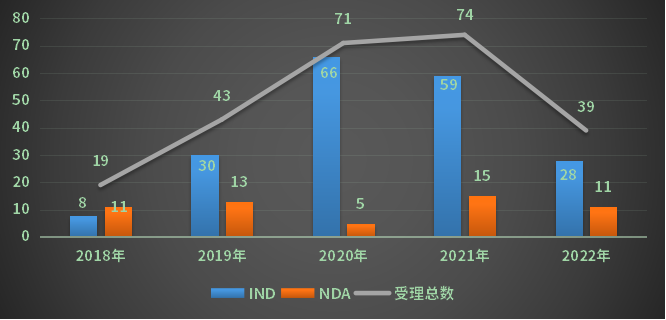
图10 2018-2022年江苏省化药2类改良型新药注册申请受理情况
1.4一致性评价申报情况
2022年江苏省一致性评价受理号申报76个(57个品种),占2022年全国一致性评价受理总量的9.1%(如想了解具体情况,请关注药智注册受理数据库)。2022年江苏省各企业一致性评价受理数量TOP4详见图11:
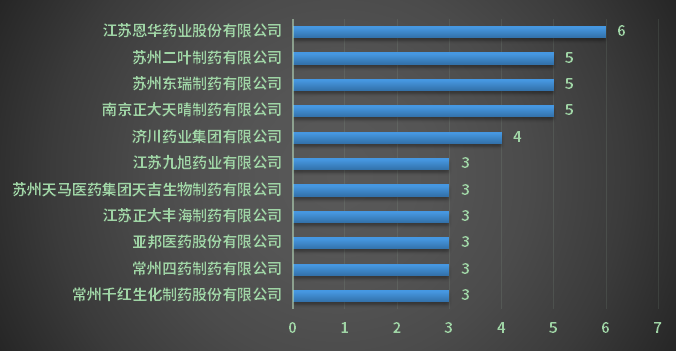
图11 2022年江苏省各企业一致性评价受理数量TOP4
2、2022年江苏省化药审评完结情况
2.1化药完成审评总体情况
2022年CDE共完成审评的化学药受理号1088个(包含无需技术审评的受理号);以审评任务类别统计,IND申请受理号290个,ANDA申请受理号218个,NDA申请受理号28个,一致性评价申请受理号110个;2022年江苏省化学药各审评任务类别完成审评情况详见图12。
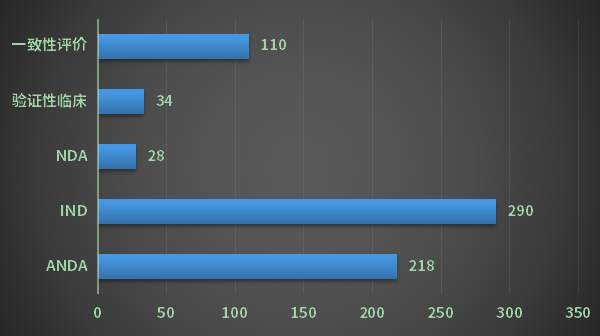
图12 2022年江苏省化学药各审评任务类别完成审评情况
2.2化药新药完成审评情况
2022年江苏省国产新药完成审评受理号251个,1类创新药210个,2类改良型新药41个;2022年江苏省国产化药新药获批品种信息见表一。
表1 2022年江苏省国产化药新药获批品种信息

三、2022年江苏省中药申报与审评情况
1、2022年江苏省中药申报情况
在2022年CDE共承办江苏省新的中药注册申请受理号47个(包含无需技术审评受理号,不含进口),新药申请受理号16个,补充申请31受理号个;2018-2022年江苏省中药各申请类型受理情况(剔除补充、进口)详见图13。
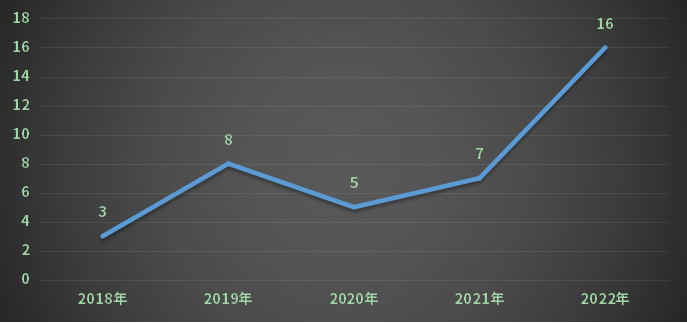
图13 2018-2022年江苏省中药各申请类型受理情况(剔除补充、进口)
以审评任务类别统计,IND申请受理号11个,包含1类创新药受理号7个,改良型新药受理号4个;NDA申请受理号2个(剔除退审数据);2022年江苏省中药新药申报信息见表二
表2 2022年江苏省中药新药申报信息
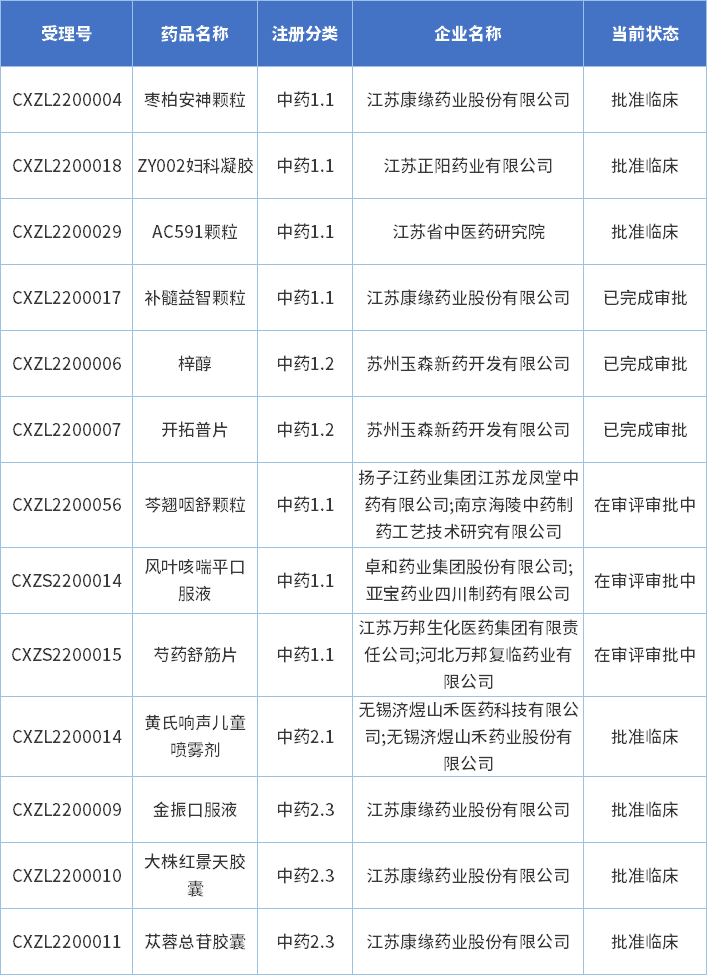
注:数据截止至2023年2月23日
2、2022年江苏省中药完成审评情况
2022年CDE完成审评的中药注册申请受理号43个(包含无需技术审评、不含进口),其中补充申请28个,新药受理号15个;在受理号审评结论方面,2022年中药有9个受理号批准临床,批准生产1个,批准补充26个,未被批准3个。
其中,获批上市的是江苏康缘药业股份有限公司的苓桂术甘颗粒,是NMPA首 个批准按古代经典名方目录管理的中药复方制剂。该药品处方来源于汉·张仲景《金匮要略》苓桂术甘汤为温化水湿的代表方,具有温阳化饮,健脾利湿功效。其成药制剂的上市将有利于促进古代经典名方在临床更广泛的使用。
四、2022年江苏省生物制品申报与审评情况
1、2022年江苏省生物制品申报情况
2022年CDE受理江苏省生物制品注册申请受理号共232个,剔除补充申请和进口数据后受理号148个,其中临床试验申请受理号127个,生物制品上市申请受理号21个;2018-2022年江苏省生物制品各申请类型受理情况(剔除补充、进口)详见图14。
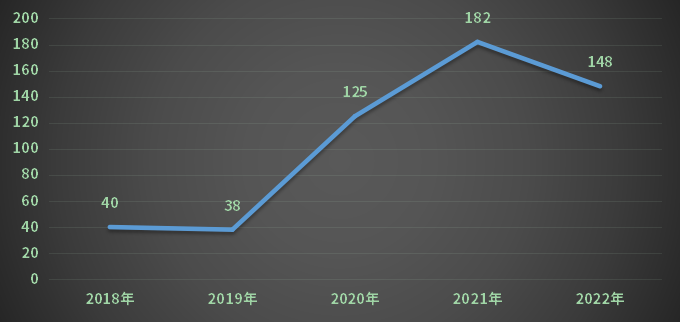
图14 2018-2022年江苏省生物制品各申请类型受理情况(剔除补充、进口)
2022年受理江苏省生物制品新药(1类创新药和2类改良型新药)申请受理号128个(其中1类创新药116个,2类改良型新药12个);2021、2022年江苏省生物制品新药申请受理情况详见图15。

图15 2021、2022年江苏省生物制品新药申请受理情况
2、2022年江苏省生物制品完成审评情况
2022年CDE完成江苏省生物制品审评受理号225个(不含进口);以审评任务类别统计,其中IND申请受理号142个,包含预防用生物制品5个,治疗用生物制品137个;NDA申请受理号15个,均为治疗用生物制品受理号;2022年江苏省生物制品各审评任务类别审结情况详见图16。
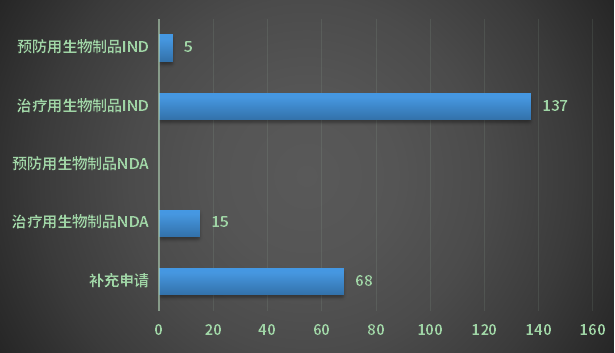
图16 2022年江苏省生物制品各审评任务类别审结情况
在受理号审评结论方面,批准补充41个,批准临床151个,批准生产13个,未被批准4个。
其中,获批的1类创新药为基石药业(苏州)有限公司申报的舒格利单抗注射液。舒格利单抗注射液为重组抗PD-L1全人源单克隆抗体,可阻断PD-L1与T细胞上PD-1和免疫细胞上CD80间的相互作用,通过消除PD-L1对细胞毒 性T细胞的免疫抑制作用,发挥抗肿瘤作用。该药品适用于联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌患者的一线治疗,以及联合紫杉醇和卡铂用于转移性鳞状非小细胞肺癌患者的一线治疗。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57