前言
抗体偶联药物(Antibody-Drug Conjugate,ADC)是一种通过连接子(Linker)将抗体(Antibody)与具有生物活性的小分子细胞毒 性载荷(Payload)连接起来的新型高效生物药。
ADC药物旨在通过更有选择性地将细胞毒 性药物传递到肿瘤细胞中,从而提高化疗药物的治疗指数(TI),并降低在正常细胞中的暴露。尽管使用大量针对抗原和/或只在癌细胞(即靶细胞)上表达的抗体,但即使在次优治疗剂量下,正常细胞/组织中的剂量限制毒 性(DLT)也经常被报道。ADC在正常细胞/组织中的毒 性机制尚不清楚,但大多数DLT被认为是与靶标无关的。
除了ADC的不稳定性导致循环中细胞毒 性药物(有效载荷)的过早释放外,通过依赖的受体(FcγRs、FcRn和C型凝集素受体)和非特异性内吞机制对完整ADC的摄取/运输可能导致对正常细胞的脱靶毒 性。
在这篇文章中,总结了正常细胞中非靶向性的ADC摄取和潜在的毒 性机制,并讨论了ADC的哪些部分影响这些机制的发生。这一信息将有助于更深入地了解ADC脱靶毒 性的潜在机制,并助力改善下一代ADC的整体治疗指数(TI)。
简介
到目前为止,全球共批准16款ADC药物,还有一款(Trastuzumab duocarmazine)处于申请上市阶段。近年来,随着向FDA提交的IND申请的显著增加,ADC领域仍在扩大。目前,超过900种不同的ADC正处于不同的研发阶段,主要的适应症为血液系统恶性肿瘤和实体瘤。
在ADC药物的研发中,尽管使用了针对肿瘤特异性和/或肿瘤过表达抗原的抗体,但次优治疗剂量的剂量限制毒 性(DLT)仍然是ADC临床应用的主要挑战。DLT导致相对狭窄的治疗指数(TIs),也是限制ADC剂量增加以达到最大疗效的主要原因。
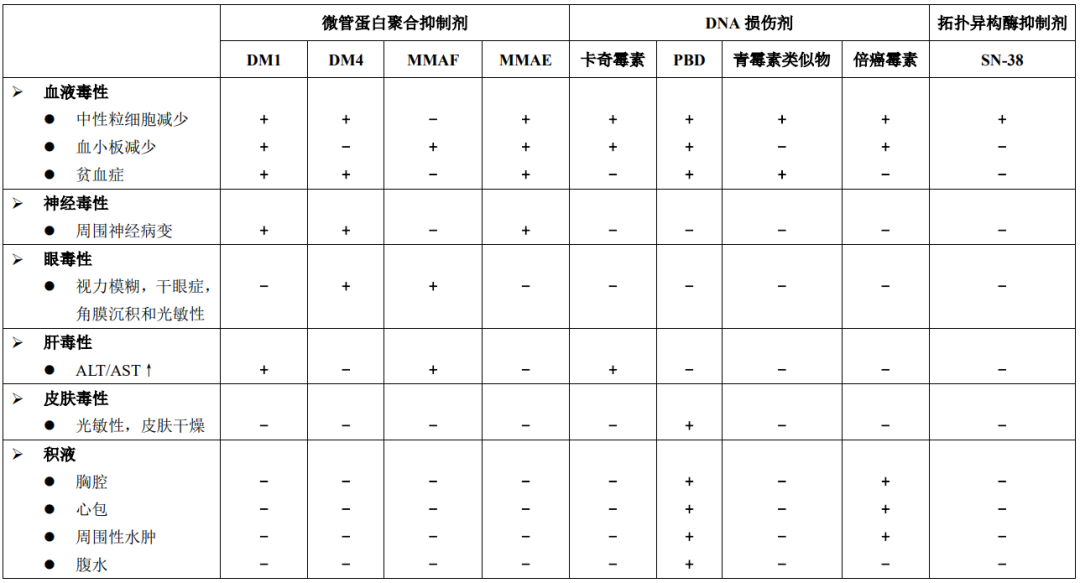
FDA批准上市的部分(4种)ADC的临床前毒 性和临床DLT见表1。根据表1中描述的数据和其他已发表的文献,所报道的正常细胞/组织中的ADC毒 性主要是由有效载荷驱动的。表2总结了ADC中使用的不同类型的有效载荷和临床研究中报道的主要毒 性。
表1 FDA批准上市的4种ADC的临床前毒 性和临床DLT或SAEs汇总
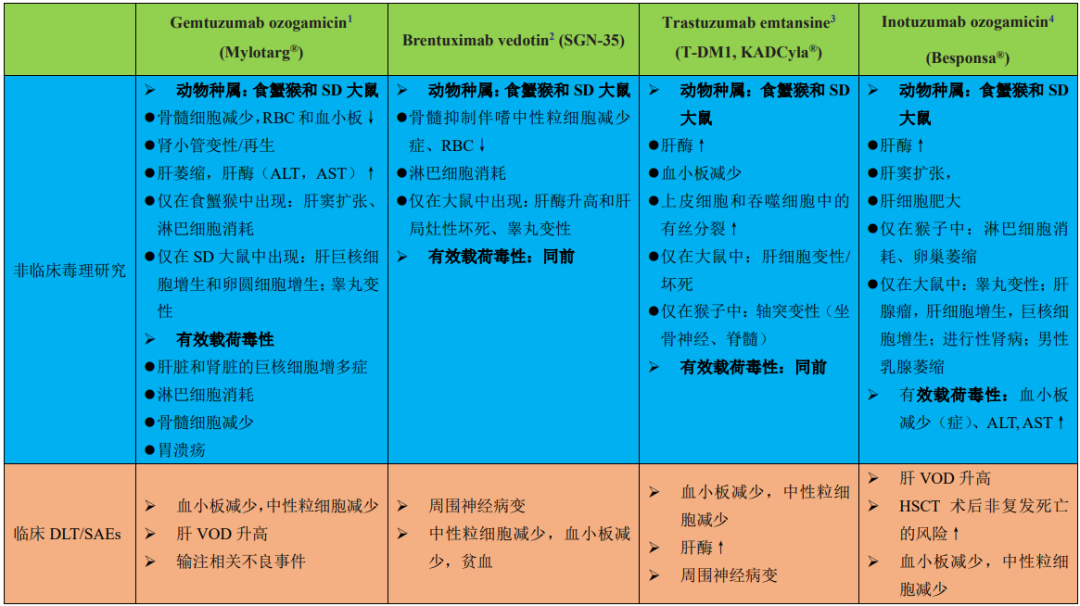
1:抗CD33抗体通过可裂解肼连接剂偶联(2000年获批,辉瑞/ Wyeth-Ayerst实验室)
2:抗cd30抗体与一个蛋白酶可裂解的缬氨酸-瓜氨酸连接子偶联到MMAE上(2011年获批,Seattle Genetics)
3:抗her2抗体通过一个不可切割的SMCC连接子偶联到DM1上(2013年获批,Genentech)
4. 抗cd22抗体通过一种酸不稳定的丁酸连接物偶联到钙霉素上(2017年获批,辉瑞)
表2 ADC有效载荷相关的临床毒 性或不良事件
尽管ADC毒 性被认为主要来自于有效载荷,但在非靶向的正常细胞中摄取ADC,传递细胞毒 性有效载荷的机制尚不清楚。只有少量的ADC积累发生在人类的靶(肿瘤)部位(~为每克肿瘤给药剂量的0.1%)。大部分ADC仍在体循环中或分布在正常组织被吸收和分解代谢,导致对正常细胞的毒 性。
ADC靶向的抗原在正常组织中的表达(虽然表达量较低)可能导致ADC靶点依赖性摄取和继发毒 性。例如,BMS-182248-01的剂量限制胃肠道毒 性(出血性胃炎)与正常胃粘膜细胞上Lewis-Y靶抗原的表达有关。
同样需要注意的是,在正常细胞中靶抗原的表达通常不能预测ADC的毒 性。例如,Trastuzumab emtansine(TDM1,KADCyla?,靶向HER2的ADC)的临床毒 性,尽管心脏和肾 脏等重要器官表达HER2水平较高,没有证据表明T-DM1与这些器官毒 性相关的报道。血小板严重减少是T-DM1常见的DLT。由于在体循环中的血小板或产生血小板的巨核细胞上没有HER2的表达,这种毒 性在很大程度上被认为是一种与靶标无关的效应。
除了靶抗原表达外,靶抗原的内化率、循环/转运动力学、对有效载荷的内在敏感性以及ADC对正常细胞/组织的体内分布等因素可能决定ADC毒 性。一般来说,高灌注和血管渗漏的组织(基底膜不完整和/或缺失),如肝、骨髓和脾,与其他正常组织相比,预计具有更高的IgG/ADC分布和暴露。
一些ADC具有相同的有效载荷和连接子,但针对不同的抗原,具有相似的最大耐受剂量(MTDs),并且在正常细胞/组织中也表现出相似的毒 性。最常见的ADC毒 性,与靶抗原表达无关。例如,中性粒细胞减少症通常被认为是具有大多数基于MMAE的DLT(具有可分裂的连接子)。同样,眼部(角膜)毒 性为多个含DM4的ADC的DLT。
此外,在多个基于MMAF的ADC中观察到不同的靶点的眼部毒 性。由此得出,ADC毒 性在很大程度上是脱靶效应,也进一步表明了药物连接子组合(ADC平台)对特异性脱靶毒 性的潜在效应。因此,有充分的理由认为:ADC的三种组成部分(即单抗、有效载荷和连接子)都会导致正常细胞/组织的毒 性。
正常细胞中ADC或游离有效载荷摄取的潜在机制,如图1所示。不同的受体依赖和非受体依赖(非特异性内吞作用)机制可能有助于正常细胞摄取完整的ADC和/或释放自由有效载荷。此外,循环中由于连接子-有效载荷的不稳定,导致有效载荷的过早释放,也可能导致与靶点无关的毒 性。了解靶点非依赖性ADC摄取和对健康正常细胞的毒 性机制对于改进ADC技术至关重要。
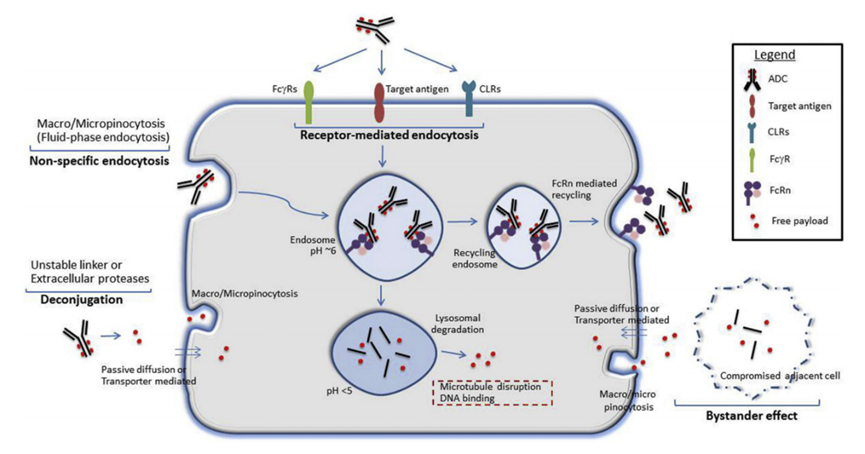
图1 正常细胞中ADC或游离有效载荷摄取的潜在机制
靶标抗原可能在正常细胞上表达,这有助于ADC的靶标依赖性摄取。此外,其他结合IgG抗体保守Fc区域的受体,如FcγRs、新生儿Fc受体(FcRn)和C型凝集素受体(CLRs)也可能有助于正常细胞中ADC的靶标内化。非特异性的内吞机制,如大胞吞作用或微胞吞作用,也可能有助于完整的ADC或游离有效载荷的内化(由于连接子-有效载荷不稳定或细胞外蛋白酶活性而在细胞外释放)。
自由有效载荷也可以通过其他机制进入正常细胞,如被动扩散(如果是膜通透性的)、非特异性内吞作用或特异性转运体(如果是膜转运体的底物)介导的摄取。此外,抗原阳性靶细胞也能够通过释放有效载荷到局部环境来介导毒 性,这些有效载荷随后被抗原阴性的正常细胞通过被动扩散、旁体介导的吸收或其他非特异性内吞机制吸收(旁观者效应)。
非靶向依赖性ADC
的摄取和潜在毒 性机制
1连接子——有效载荷连接不稳定
连接子-有效载荷不稳定可导致有效载荷过早释放到血液中,并导致ADC的脱靶毒 性。连接子的选择是ADC稳定性背后的主要驱动因素之一。第一代ADC具有酸裂解键(例如肼),在血浆中性pH中稳定,ADC内化后在较低pH的溶酶体中释放。这些早期的ADC经常受到血浆稳定性差的困扰,在体循环中可监测到自由有效载荷(图1)。
不可裂解连接子的引入在某些情况下缓解了连接子的裂解问题,提高了临床前的安全性。不可裂解连接子类型的毒 性降低认为是由于游离细胞毒 性有效载荷的释放减少。
然而,并不是所有的靶点都适合用不可裂解的ADC,因为需要完全的单抗分解代谢来释放连接子-有效载荷。具有可裂解连接子的ADC也可能通过旁观者效应提高疗效,是拷贝数低、异质肿瘤表达或内化率低抗原的首选。同样需要注意的是,除了连接物的可裂解性外,释放的有效载荷的膜通透性也可能影响正常细胞中潜在的脱靶细胞毒 性,从而可以用来影响TI。
偶联位点可能影响ADC的稳定性和药代动力学特征。传统的非特异性偶联方法使用表面暴露的氨基酸,如赖氨酸或半胱氨酸,产生高度异质的ADC(药物与抗体比[DAR],0到8),聚集增加,血浆稳定性降低。因此,非特异性偶联的ADC也可能有助于在正常细胞中增加靶点非依赖性摄取和毒 性。
中性粒细胞减少是ADC一个重要的与靶标无关的DLT,由于血浆中可分裂连接子的不稳定,这与膜通透性游离有效载荷的全身释放有关。中性粒细胞减少症是许多腺激酶的常见毒 性,通过蛋白酶可切割的缬氨酸-瓜氨酸连接子,如Brentuximab vedotin (ADCetris, Seattle Genetics), ASG-5ME (Agensys), Glembatumumab vedotin (Celldex Therapeutics), Indusatumab vedotin (Millennium Pharmaceuticals), Polatuzumab vedotin (Genentech) 和 PSMA ADC (Progenics Pharmaceuticals)。
根据连接子的化学性质,缬氨酸-瓜氨酸连接子会在溶酶体中经细胞内半胱氨酸蛋白酶介导的裂解。骨髓微环境中局部中性粒细胞分化分泌的丝氨酸蛋白酶有助于细胞外VC连接子的分裂,并释放膜透性MMAE,导致骨髓中中性粒细胞分化的细胞毒 性。
同样,周围神经病变(PN)是另一种重要的与靶点无关的毒 性,与微管抑制剂ADC(无论靶抗原如何)相关。PN被认为是由连接子-有效载荷不稳定驱动的,在体循环中,与膜透性游离有效载荷(微管抑制剂)的过早释放有关。微管抑制剂破坏间期微管功能,间期微管功能对关键必需蛋白从神经元细胞体到远端突触的主动运输至关重要,最终导致周围神经病变。PN对于几乎所有膜透性膜(DM-1和DM-4)与可裂解连接物结合的ADC都是常见的不良事件。
值得注意的是,在临床中观察到的PN并不总是在临床前动物模型中被预测到。例如,对基于VC-MMAE的ADC进行的临床前毒理学研究并没有监测到PN。对于其他含有微管抑制剂的非MMAE ADC,如DM1或DM4,PN在临床前物种中被观察到,具有良好的临床预测性。
旁观者效应:除了靶抗原阳性细胞摄取ADC后的直接细胞毒 性外,ADC的游离有效载荷也可能通过一种被称为旁观者效应的现象对邻近的靶抗原阴性细胞产生细胞毒 性。在抗原表达的靶细胞中,溶酶体中ADC的摄取和分解代谢释放出细胞质中的游离有效载荷。然后,自由有效载荷可以被动地进入细胞外空间(膜透性、高亲脂性有效载荷),也可以由于膜完整性的丧失(靶细胞死亡后)而被释放。释放的游离有效载荷可能通过被动扩散、转运体介导的摄取或其他非特异性内吞机制进入靶抗原阴性细胞,从而引起细胞毒 性(图1)。
ADC中的旁观者效应通常与增加的肿瘤杀伤有关,特别是对于具有异质性抗原表达的肿瘤。通过体外菌落球状体分析和共培养系统以及体内异种移植模型,已经证明了其对具有膜透性有效载荷的ADC的效力和有效性的影响。然而,实现旁观者效应所需的细胞通透性增加也可能导致脱靶毒 性。
与不可切割、渗透性较差的有效载荷相比,释放的有效载荷可以渗透到正常组织中,并导致毒 性增加。ADC技术的最新进展使细胞毒 性有效载荷能够在肿瘤细胞中代谢为膜不透性代谢物(例如,Dolaflexin)。这种方法可以控制旁观者效应,保留有益的化学特性来杀死肿瘤细胞,同时也可以显著减少对正常细胞的全身毒 性。
2非特异性内吞作用
内吞作用是细胞摄取营养物质、调节跨膜动力学、突触囊泡再循环等方面的重要过程。内吞作用也可以在正常细胞中包括IgG/ADC在内的大分子的摄取和分布中发挥重要作用。内吞作用大致分为吞噬作用(颗粒内化)和胞饮作用(可溶性分子内化,也称为液相内吞作用)。此外,根据内吞囊泡形成的大小,内吞作用被分为宏观的和微观的内吞过程。表3列出了可能导致IgG/ADC非特异性摄取的主要内吞机制的关键特征。
表3 主要内吞机制的关键特征
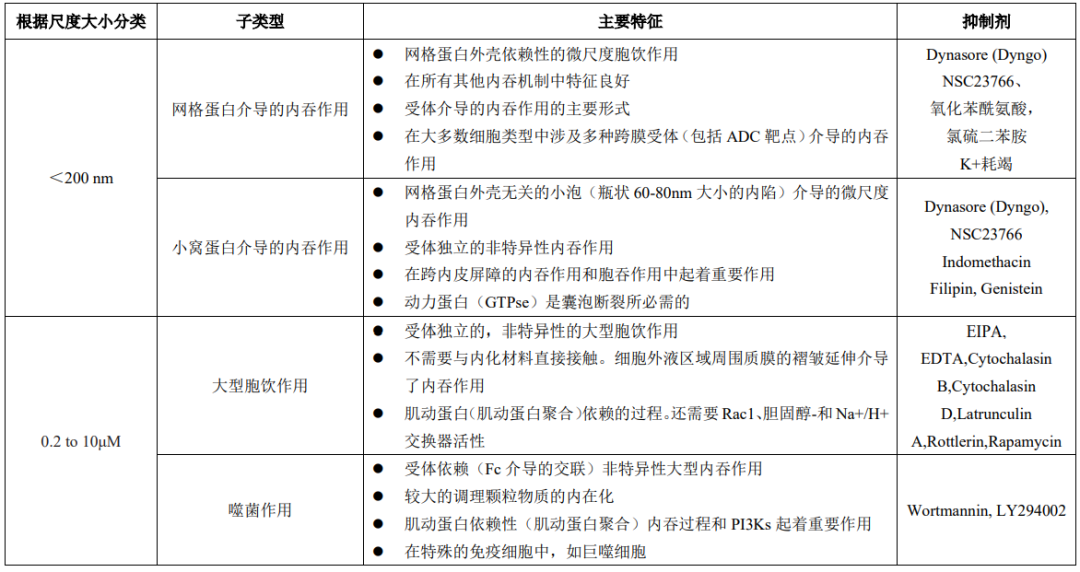
“大尺度”的内吞作用包括吞噬和大胞吞作用,它们分别涉及大颗粒和大体积粒子的内化。吞噬作用包括吸收体积较大的颗粒,从而引起细胞膜的变形(局部的肌动蛋白的重新排列)。含有ADC或ADC聚集物的免疫复合物也有可能被这一过程吸收。
与吞噬作用类似,巨胞吞作用也是一个肌动蛋白依赖的过程,它涉及在相对大量的细胞外液(而不是颗粒)区域周围形成质膜的褶皱延伸,以介导内吞作用。微尺度内吞过程包括小于200 nm的小粒体吞噬。
这些过程通常需要特殊的外壳蛋白,如网格蛋白或小泡蛋白(图2)。配体与特定的膜受体的结合启动了一系列的信号事件,导致特定的适配器蛋白的募集,以实现网格蛋白包被的囊泡的形成。这些新形成的囊泡被动力蛋白(GTPase酶)切断,并被释放用于进一步的细胞内运输。
小泡蛋白介导的内吞作用涉及由膜涂层蛋白小泡蛋白形成的瓶状结构(小泡),它也依赖于动力蛋白来切断囊泡。小泡蛋白介导的摄取在许多类型的细胞中起着主要的运输作用,尤其在内皮细胞中占主导地位。
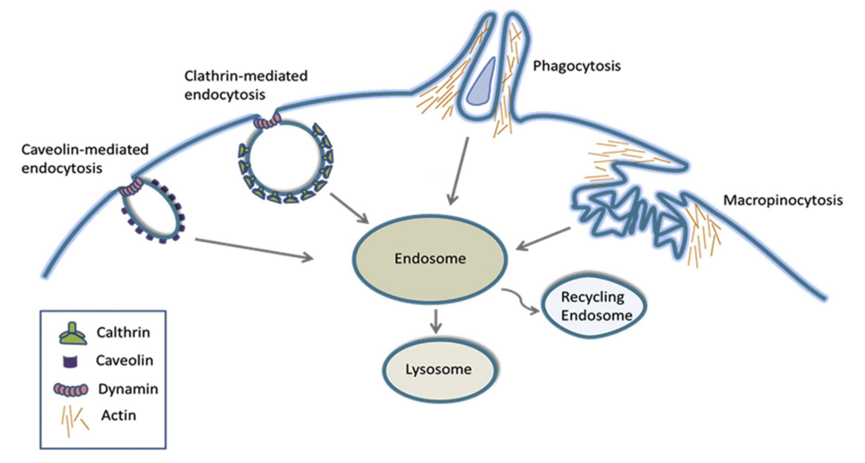
图2 宏观尺度和微观尺度内吞过程的关键结构特征示意图
总的来说,上述宏观和微观的内吞过程可能有助于ADC进入正常细胞。关于ADC对正常细胞的毒 性,非特异性内吞机制如小泡依赖性内吞、巨胞吞和吞噬作用是潜在的重要机制。也很明显,内吞机制和总的内吞率在正常组织和细胞类型中是不同的。
许多特化的免疫细胞(包括巨噬细胞和树突状细胞)具有更高的内吞率。例如,Kupffer细胞(肝 脏中的常驻巨噬细胞)在包括ADC在内的免疫偶联物的非特异性摄取和清除中发挥主要作用。由于内皮细胞位于血管和间质腔室之间的界面,因此它们也具有较高的大分子内吞率。了解不同正常细胞/组织的内吞速率对于理解非特异性内吞作用作为ADC摄取和毒 性的潜在机制的作用是有价值的。
影响IgG/ADC非特异性内吞作用的因素:大分子的理化性质可能会影响在正常细胞/组织中内吞。IgG/ADC表面的分子电荷是共同影响抗体组织分布和PK的众多参数中的一个重要参数。带正电荷的分子被吸引到哺乳动物细胞膜以及细胞外基质(硫酸肝素蛋白聚糖)中带负电荷的基团上。增加了ADC局部浓度,导致正常组织/细胞中更多的非特异性内吞摄取。
总的来说,IgG抗体净正电荷的增加导致组织分布的增加,血浆清除率的增加,而净正电荷的减少则导致组织分布的减少。重要的是,至少一个或多个单位的等电点(pI)的变化足以产生组织分布和PK的可测量的变化。这些结论也可能适用于ADC,支持了ADC电荷可能影响正常细胞的非特异性内吞作用的假说。因此,电荷修饰:通过减少正电荷或平衡整体表面电荷分布,是设计ADC时考虑的一种方法。
但值得注意的是,与正常组织类似,电荷修饰也可能影响肿瘤细胞疗效所需的靶抗原依赖的ADC摄取。优化ADC表面电荷,减少正常细胞摄取,同时在肿瘤细胞中保留靶介导的摄取,可以有利于改善TI。
ADC的疏水性也可能在正常细胞对其非特异性摄取中发挥作用。许多用于ADC的药物连接子组合都是疏水的;使抗体具有显著的疏水性,特别是对于高DAR的ADC。高DAR的疏水性增加可促进ADC的聚集并加速非特异性清除。与肝细胞类似,具有高DAR的ADC可能被其他具有高非特异性内吞能力的正常细胞迅速清除,从而导致脱靶毒 性。
非特异性内吞作用(特别是巨胞吞作用)被认为是正常角膜上皮细胞和巨核细胞摄取ADC的途径,分别导致眼部毒 性和血小板减少。同样,大胞饮作用介导的内化可以降低ADC(AGS-16C3F)对巨核细胞的毒 性(血小板减少症)。
3受体介导的摄取机制
ADC的靶点依赖性摄取和毒 性也可以由不同的受体介导,这些受体识别ADC中IgG部分的Fc(片段结晶)区域(图3)。IgG恒定结构域在结构上高度保守,允许通过Fc受体与免疫系统的其他组分相互作用,从而启动效应免疫功能。虽然Fc介导的效应功能通常不需要实现ADC的疗效,但Fc受体与ADC抗体(IgG)成分的识别和结合可以介导正常细胞的非靶点内化。
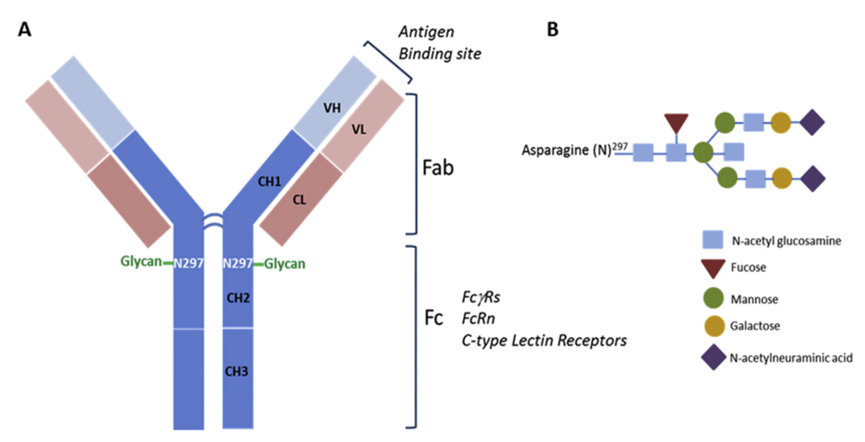
图3 ADC IgG部分结构示意图
Fcγ受体(FcγRs):FcγRs通过抗体介导的效应功能(如抗体依赖性细胞毒 性(ADCC)、补体依赖性细胞毒 性(CDC)、吞噬细胞因子(IFN-γ和TNF-α)和其他IgG免疫复合物和释放细胞因子),在连接细胞和体液免疫反应中发挥着关键作用。这些效应功能在调节几种治疗性IgG抗体的疗效中发挥着重要作用。FcγR介导的效应功能对靶相关疗效至关重要,但可能有助于正常细胞中脱靶的摄取和毒 性。
因此,了解FcγR生物学、正常细胞/组织中的表达方式以及有助于FcγR结合的ADC的理化因子,对于理解潜在脱靶毒 性机制具有重要意义。根据受体交联后启动的信号通路类型,FcγRs主要分为激活型(FcγRI、FcγRIIa、FcγRIIc、FcγRIIIa和FcγIIIb)和抑制型(FcγRIIb1/b2)受体。
激活型FcγRs与免疫受体酪氨酸激活基序(ITAM)的相互作用正向调节效应功能,而抑制型受体与免疫受体酪氨酸基抑制基序(ITIM)的相互作用,负调控IgG介导的效应功能,包括内吞/吞噬作用。除了免疫细胞,不同FcγRs的表达显示在多个其他正常细胞类型包括表皮角质形成细胞,感觉神经元、系膜细胞、破骨细胞、内皮细胞、成纤维细胞、唾液腺上皮细胞、各种细胞类型在肾 脏和眼睛,巨核细胞、血小板,以及分化骨髓来源的未成熟细胞,包括造血干细胞/祖细胞。
FcγR介导的IgG/ADC内化:FcγRs不仅是介导IgG抗体效应功能的重要分子,而且是最 具特征的内吞细胞表面受体之一,在体循环中内化/清除IgG调理抗原中发挥作用。FcγRs与Fc区域的结合诱导了细胞上IgGs的聚集/交联,并启动下游信号事件,导致PI3K、p70S6K和Akt等激酶的磷酸化和激活。这些直接参与了肌动蛋白细胞骨架的重组和假足和吞噬体形成的膜重塑。类似的机制也可能适用于FcγR介导的ADC内化,有助于正常细胞的非靶点依赖性毒 性。
正常细胞中ADC毒 性与FcγRs介导的ADC摄取相关。尽管FcγRs在正常健康细胞/组织中的表达模式与几种报道的ADC靶无关毒 性相对应,FcγRs在介导ADC脱靶毒 性中的作用主要被认为是血液毒 性(血细胞毒 性)的潜在机制。血液毒 性是含有奥司汀(MAME,MMAF)、钙霉素和类玉米霉素(DM-1)的ADC最常见的脱靶毒 性。在临床研究中,T-DM1诱导的血小板减少症为一种DLT。
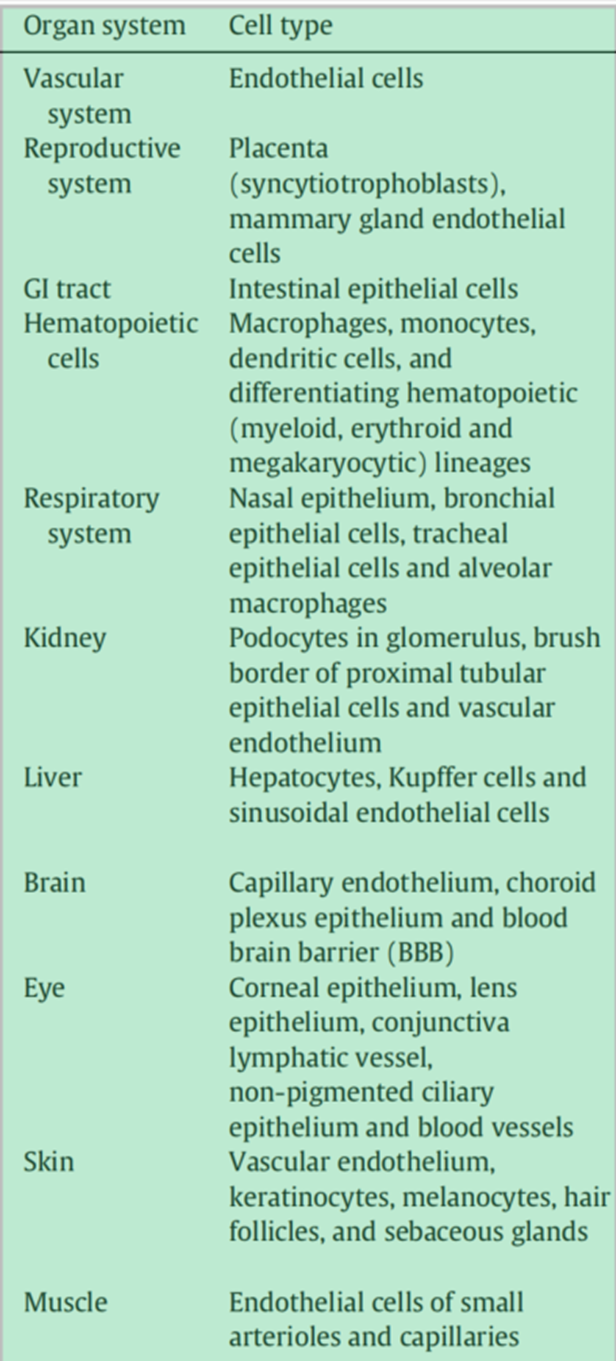
新生儿Fc受体(FcRn):FcRn是MHCI类糖蛋白的成员,专门绑定到Fc域和发挥关键作用,其特点是半衰期(~21天)较长。与其他Fc受体不同,FcRn依赖pH的方式与配体相互作用,在微酸性pH(~6.5)下具有高亲和力结合。这种pH依赖性被认为是FcRn延长IgG/ADC半衰期机制的关键。FcRn广泛表达于许多正常的成人组织/细胞类型中(表4)。
特别是血管内皮细胞和髓系来源的造血细胞(抗原提呈递细胞)在FcRn介导的免疫反应中发挥主导作用,由此也影响IgG/ADC的分解代谢和PK。在极化的上皮细胞(如肠上皮细胞、肾近端肾小管上皮细胞)中表达的FcRn也有助于IgG或免疫复合物的双向胞吞作用。
FcRn的表达模式在不同物种中可能不同,导致人类和其他临床前物种之间的IgG结合亲和力存在差异。虽然人类FcRn只与人类IgG结合,但小鼠FcRn高度混杂,并与来自多个物种(包括人类)的IgG结合,具有比小鼠IgG更高的亲和力(~10倍)。人IgG与食蟹猴FcRn的结合亲和力也比与人FcRn的值高2倍。
表4 FcRn在不同正常细胞/组织中的表达
FcRn结合及其在ADC毒 性中的潜在作用:ADC主要通过非特异性流体相内吞作用,在酸性早期核内体结合FcRn,然后,在中性pH细胞外空间或体循环,FcRn-ADC复合物分为循环核内体转移远离溶酶体降解和回收回细胞表面释放ADC。在每个内吞作用周期中,只有未与FcRn结合的ADC被转运到溶酶体中进行分解代谢和释放有效载荷(图4)。
从安全性的角度来看,FcRn结合对于减少正常细胞中ADC的积累和分解代谢以释放细胞毒 性有效载荷也很重要。因此,在FcRn显著表达的正常细胞中,对FcRn结合的修饰可能是克服不良毒 性/不良事件的有用方法。
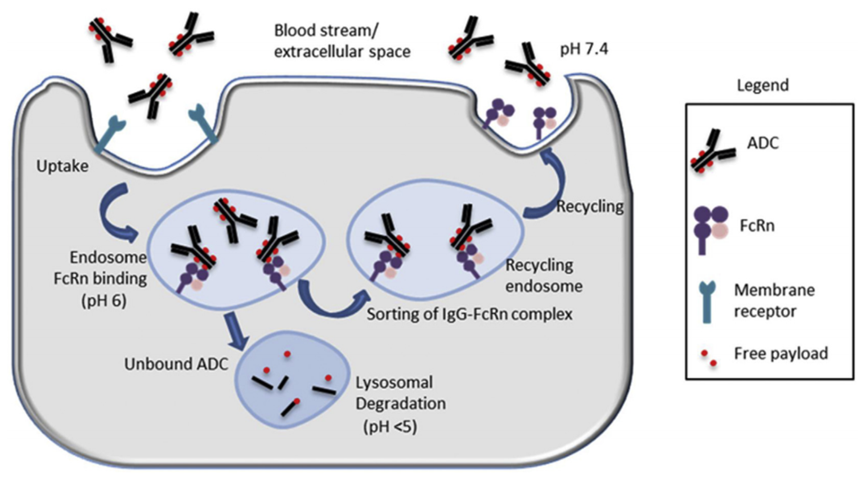
图4 FcRn在ADC循环中的作用
C型凝集素受体(CLRs):CLR是一个庞大、高度保守且特征良好的内吞受体家族。I型CLR是钙依赖的,有多个(6到8)碳水化合物识别域(CRDs),也包含富含半胱氨酸和纤维连接蛋白结构域。其成员包括巨噬细胞甘露糖受体(MR、MRC1、CD206)、Endo180(CD280、MRC2、uPAR相关蛋白、uPARAP)、DEC-205、PLA2R和DCL-1。II型CLRs包含一个CRD,可以钙依赖Dectin 2、Mincle、CLECSF8、DCIR、DCAR、BDCA-2、DC-SIGN、MGL,钙不依赖Dectin 1、CLEC5A、DNGR-1(CLEC9A)。
CLR既可以是膜结合的(主要),也可以是可溶性/分泌的,主要存在于髓系细胞上。越来越多的证据也表明,CLR在多种正常上皮细胞和内皮细胞中具有功能性表达,包括真皮微血管内皮细胞(DMECs)、肝窦内皮细胞(LSECs)、血管周围小胶质细胞、肾小球系膜细胞和角膜上皮细胞。
值得注意的是,尽管CLR在各种正常组织中表达,但某些病理生理事件,如炎症和感染(真菌、微生物)已被证明可以显著调节这些受体的表达。CLR在一些正常组织中重要的内吞功能和结构性表达,包括常见的ADC靶器官(肝 脏、皮肤和角膜),表明这些受体可能在这些组织中介导非靶向的ADC内化和毒 性中发挥作用。
ADC毒 性与CLRs结合相关。尽管没有明确的证据证明CLR在ADC的脱靶毒 性中起直接作用,但甘露糖受体(MR)介导的摄取认为是ADC肝毒 性的潜在机制。LSECs是一种高度特化的内皮细胞。与其他肝细胞相比,LSECs中的溶酶体酶活性水平显著升高,也可能进一步导致其内吞配体(包括ADC)的高度降解,并将降解的物质/细胞毒 性有效载荷释放到周围的腔室。
LSECs依赖于MR介导的对溶酶体酶(糖蛋白)的摄取来维持其高降解能力。在早期核内体中释放配体后,MR-配体复合物的快速内化和MRs的快速循环回到细胞表面可能进一步有助于MR表达细胞的高连续内吞能力。MR介导的摄取也是清除LSECs中内源性和治疗性糖蛋白和免疫球蛋白的重要机制。
此外,由于存在被微管(肌动蛋白)丝包围的大孔(~50-150nm),没有膈膜和基底膜,LSECs是体内通透性最 好的内皮细胞类型。因此,大分子(包括ADC)通过膜孔进入LSECs的清除剂受体扩散也可能导致肝毒 性。
值得注意的是,Kupffer细胞也表达MR,并在ADC的非特异性摄取和加工中发挥重要作用。因此,不能排除MR介导的Kupffer细胞中ADC的摄取和细胞毒 性有效载荷释放到周围细胞中,从而导致肝毒 性。
总结
ADC毒 性主要为骨髓/血液学、肝 脏、眼睛、周围神经、肾 脏和浆膜积液(血管渗漏综合征)。受体依赖和不依赖的机制可能有助于了解ADC脱靶毒 性。这些机制可能因不同的细胞/组织类型而不同,这取决于关键候选受体的表达和功能。常见的DLT包括血小板减少症(FcγRIIa介导或大胞吞介导)、眼毒 性(大胞吞介导)、中性粒细胞减少(细胞外蛋白酶介导)、肝损伤(甘露糖受体介导)和周围神经病变(循环)与ADC/有效载荷摄取的潜在机制有关。
总而言之,选择性地用ADC靶向表达的肿瘤细胞比最初预期的要复杂得多。简单地选择在正常组织中很少/不表达、肿瘤中高表达的抗体靶点,不足以在体内将ADC有效载荷传递给肿瘤细胞,同时最大限度地减少对正常细胞的毒 性。非特异性ADC进入正常细胞的途径,可能因细胞类型而异,且取决于ADC本身特征。迄今为止,并不是所有影响非特异性ADC吸收的参数都得到了确定,我们了解的越多,复杂性似乎就会继续扩大。
参考文献
1Mahalingaiah PK, Ciurlionis R, Durbin KR, Yeager RL, Philip BK, Bawa B, Mantena SR, Enright BP, Liguori MJ, Van Vleet TR. Potential mechanisms of target-independent uptake and toxicity of antibody-drug conjugates. Pharmacol Ther. 2019 Aug;200:110-125.
2Pretto F, FitzGerald RE. In vivo safety testing of Antibody Drug Conjugates. Regul Toxicol Pharmacol. 2021 Jun;122:104890. doi: 10.1016/j.yrtph.2021.104890. Epub 2021 Feb 13. PMID: 33587934.
3Johns AC, Campbell MT. Toxicities From Antibody-Drug Conjugates. Cancer J. 2022 Nov-Dec 01;28(6):469-478. doi: 10.1097/PPO.0000000000000626. PMID: 36383910.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57