Covid-19不仅打乱了世界秩序,也对FDA审批新药的速度造成了影响。无论两者之间的关联度有多高,不争的事实是,FDA在过去一年给出了相对以往超级缓慢的审批速度。
2015年至2021年期间,FDA的审批速度完全是另一副场面,超快审批(指那些在提交后六个月内,或至少比优先审查目标日期提前两个月)的NME(新分子实体)和新生物制剂批准占据总数的14%。这个数据在2019年达到顶峰,当时有11种新药在六个月或更短时间内获得批准,占CDER批准总数的23%。
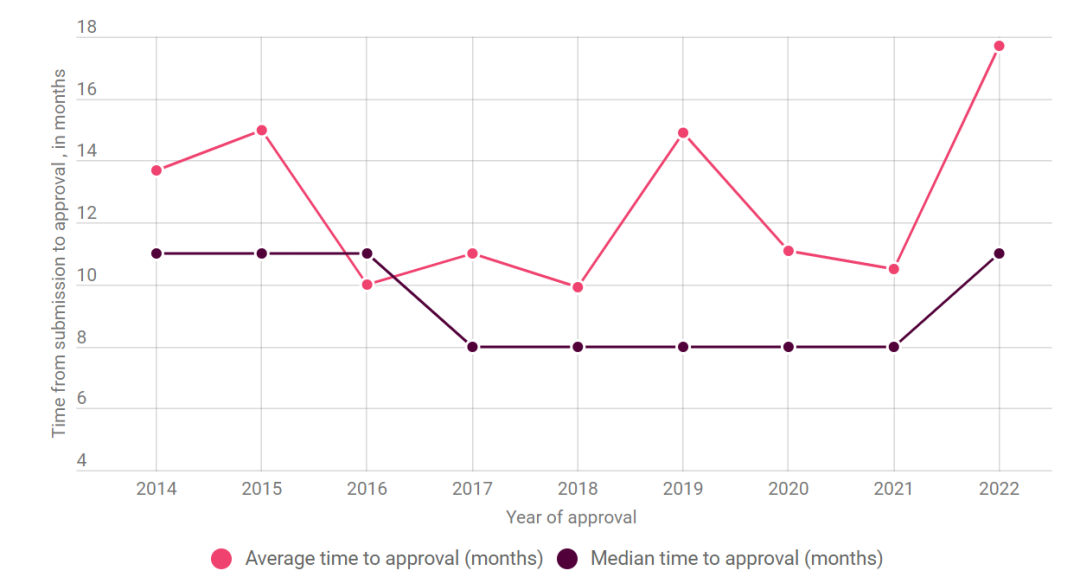
图1 CDER2 2014至2022年审批时间平均值(粉色折线)和中位值(紫色折线)走势图
图片来源:Pink Sheet
而2022年,没有一款药物的批准比设定的PDUFA(处方药用户费用修正案)时间提前两个月;Immunocore,Ltd.的Kimmtrak(tebentafusp-tebn)享受了2022年最短的CDER审查,但也耗时7.1个月。
过去十年,FDA批准新药表现为数量增加、审查时间减少、快速审查计划(Expedited review programs)和试点加快更多审查等诸多积极向上的景象。相比之下,在2022年,随着FDA应对COVID-19大流行制造的困难、关于加速批准的争议、对JAK抑制剂类的安全问题等诸多因素的不断涌现,2022年FDA在审批的速度上采用了“执两用中”的适度原则,甚至更偏保守。
2022年CDER批准新药的平均时长达17.7个月,创造了十多年来的最高值,其中Mallinckrodt的Terlivaz(Terlipressin)的时长为160.3月,没有任何一个快速审批的项目可以平衡Terlivaz的这一高数值。除了平均值外,中位值(median)也是统计学的关键数据。2022年FDA的中位审批速度为11个月,这个表现也明显偏离了自2017年以来CDER批准的中位时间为8个月的传统(上图1)。
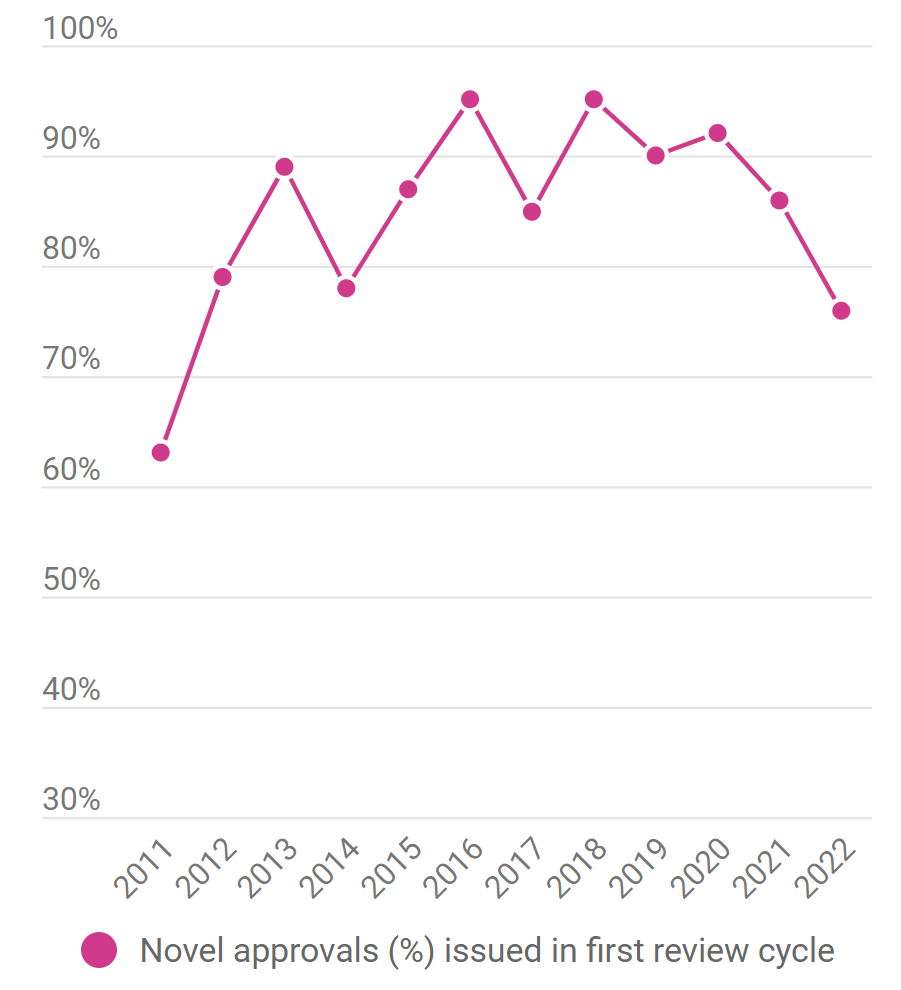
图2 CDER 2011至2022年审批一次通过率走势图
图片来源:Pink Sheet
除了慢之外,“严”也是2022年FDA表现的关键词之一。
2022年获得CDER批准的新药中,近四分之一在最终撞线之前收到了完整的回复函(CRL,complete response letter),造就了近十年来最低的第一轮通过率(上图2)。
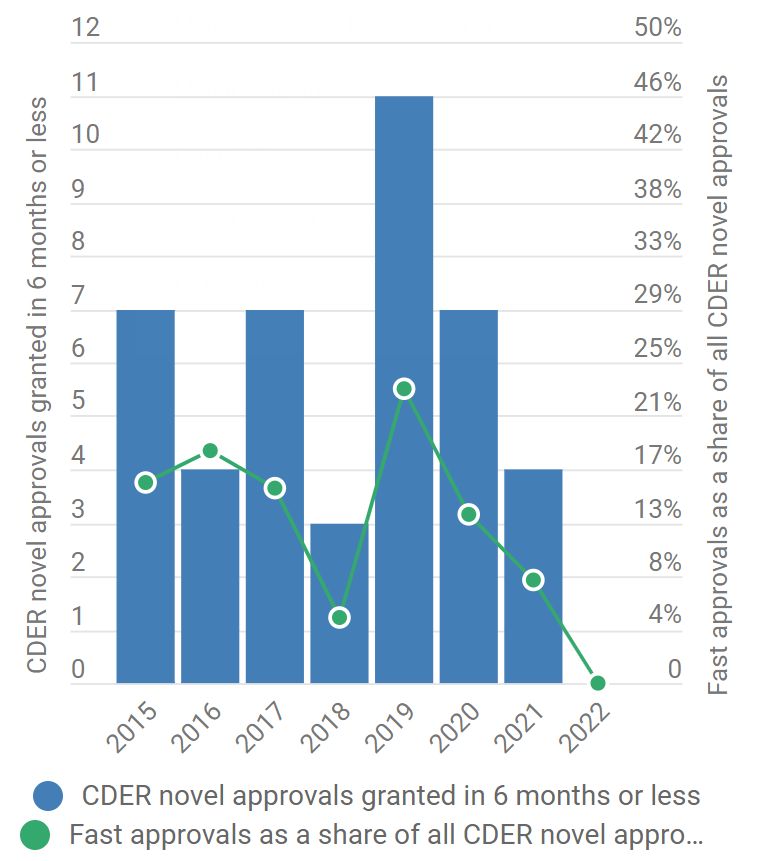
图3 CDER 2015至2022年超快审批(审批时间短于6个月)直方图
图片来源:Pink Sheet
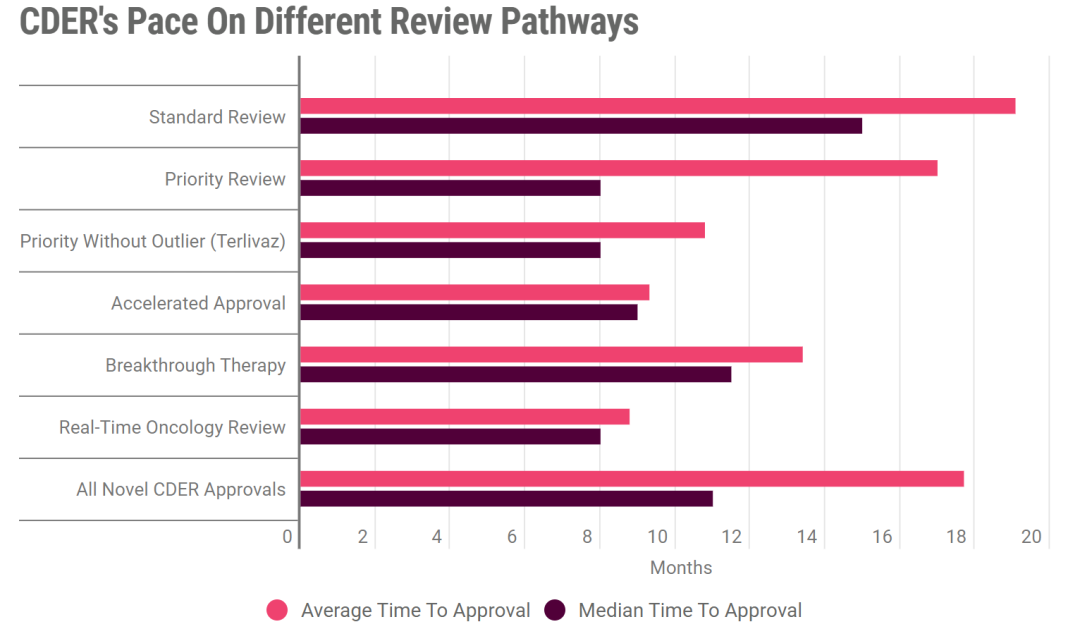
图4 CDER不同审批通道的平均和中位审批时间直方图
图片来源:Pink Sheet
2022 FDA审批时间数据
最快审批:
1、Kimmtrak:7.1月
2、Elahere:7.5月
最慢审批:
1、Terlivaz:160.3月
2、Rolvedon:34.5月
24%的用户费用目标日期已延长
9项批准是在FDA将用户费用目标日期延长三个月后获得的,平均批准时间为12.1个月
新型肿瘤药物:2022年平均审批时间为8.5个月,范围为7.1-11.9个月
神经科学药物:获批的平均时间为12个月
新型传染病疗法:获批的平均时间为12.3个月
血液疾病(非恶性血液学)新疗法:获批的平均时间为19个月
皮肤病新疗法:获批的平均时间为19.2个月
越紧急,越快速
CDER的超快审批,在很大程度上是取决于药物的作用领域。
例如2021年Jazz Pharmaceuticals plc的Rylaze?[用于治疗1个月或以上对大肠杆菌过敏的成人和儿童患者的急性淋巴细胞白血病(ALL)和淋巴细胞淋巴瘤(LBL)],在递交申请后两个月便获得审批(因为该适应症的另一种全球唯一药物面临短缺);2020年获批的Gilead Sciences,Inc.的Veklury?(瑞德西韦)也只用了2.5个月(应对COVID-19大流行);2019年Vertex Pharmaceuticals Incorporated的Trikafta用了3.1个月;2018年Johnson&Johnson的Erleada 4.1个月获批。
图片来源:ClinicalTrialsArena,Vekluryhcip.com,Trikafta.com,MIMS
2022年最长的审查由Mallinckrodt plc的Terlivaz(terlipressin)造成,它也是FDA最长的审查之一:在批准前耗时13.4年(160.3个月),经历了四个审查周期。
尽管如此,FDA最长的审批记录却并非Terlivaz创造。Aventis SA的破伤风和白喉疫 苗在2003年最终获得CBER批准,但这条审批之路花费了它们20年时间;2009年获批的Lundbeck的抗惊厥药Sabril(氨己烯酸)用了15年。
排在Terlivaz之后的超长审查案例包括:Kyowa Kirin Co.,Ltd.的Nourianz(伊曲茶碱,2019年获批,12.3年);范斯坦医学研究所的帕金森病影像学药物氟多巴F18(2019年获批,9.9年);Discovery的Surfaxin(lucinactant,2012年获批,7.3年);Sprout的Addyi(氟班色林,2015年获批,5.8年)。
CBER vs CDER
FDA的CBER(生物制品评估和研究中心)在2022年批准了8种新生物制品,其中四分之三的CBER批准获得优先审查;75%还获得了突破性疗法资格。Moderna,Inc.的Spikevax(COVID-19疫 苗,mRNA)的获批时间为5.2个月,创造了CDER和CBER在2022年的最快速度,其原因不言自明。
CBER在2022年的两个标准审查的平均时间为12个月,但优先审查的批准平均时间却更长,为14.2个月。CBER对新兴再生医学(Regenerative Medicine)领域的谨慎态度,解释了优先审查速度较慢的原因。CBER批准的项目中,五项是针对基因疗法和嵌合抗原受体T细胞(CAR-T)疗法,均有优先审查和突破性审查;三项获得了用户费用目标延期,Ferring Pharmaceuticals的Adstiladrin(nadofaragene firadenovec-vncg)花费了39.4个月的两个审查周期,使其成为唯一的多周期CBER新批准和最长的审查。
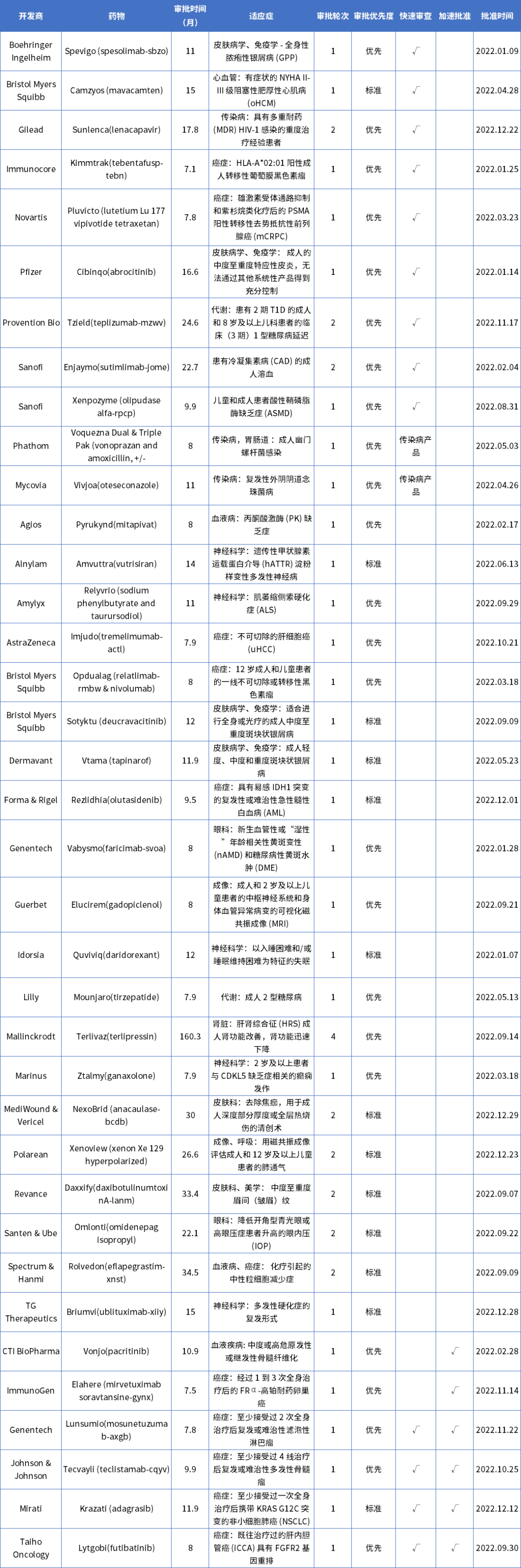
附表:CDER 2022年审批药物一览表
参考来源:
Silverman,B.End Of US FDA’s Very Fast Reviews?2022 Novel Approvals Stayed Close To PDUFA Timeframes.Pink Sheet.30,01,2023.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57