自2019年沙坦亚硝胺污染事件后,FDA 和 EMA 明显加大了对药品潜在诱变杂质的监管力度。不仅屡次发文至其监管的制药公司与 CDMO,而且为很多药物基质亚硝胺杂质设定了非常严格的 ADI (每日允许摄入量),例如18 ng/天。
亚硝胺风波尚未平息,苯污染又成为了监管机构鸣响的另一次警笛。
药品生产过程中使用或产生的很多物质都有可能是潜在诱变杂质(PMI),例如很多烷基化试剂,包括氯代烷烃,它们的使用,或者作为杂质产生于反应的过程中,都可能给药物带来PMI污染的风险。面对产品安全与PMI管理的可操作性,从业者需要一种合理的手段实现两者之间的平衡。
本文将着重介绍 PMI 的 purge factor与purge ratio 概念,它们的计算方法,以及随之而来的 PMI 控制方法。
什么是 Purge Factor
Purge Factor (PF) 反映工艺降低杂质水平的能力。根据 ICH M7(R1),它被定义为工艺上游点的杂质水平除以工艺下游点的杂质水平。PF既可以通过测量也可以通过预测的手段实现(PS:需要提前强调的是,Purge Factor 和 Purge Ratio 是两个不同的概念,下文将具体介绍两者的差别和联系)。
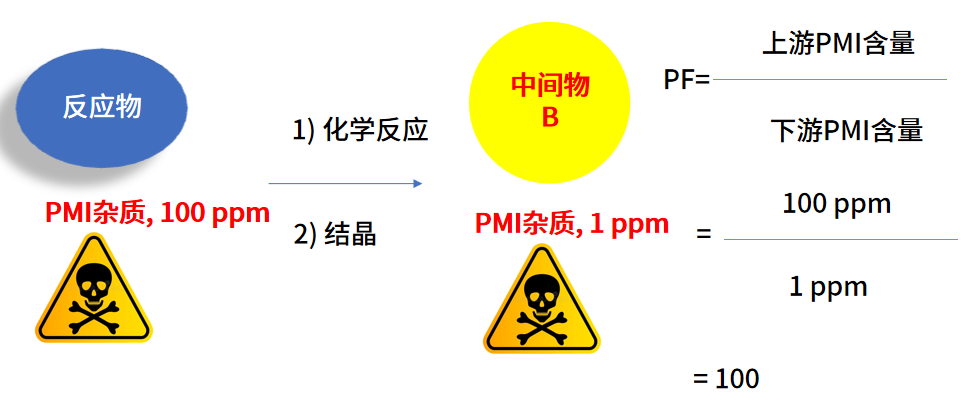
Purge Factor (PF) 计算:基本原则
PF的计算值是根据目标的潜在基因毒 性杂质,或潜在诱变杂质(PMI, potential mutagenic impurity; 或PGI, potential genotoxic impurity)的自身物理化学性质,以及所处工艺的特征共同决定的(步骤如下图所示)。
第一步是评价可以决定PF的清除程度的关键要素,例如它的反应活性、溶解度、挥发度,以及能够将其排除出体系的工艺操作,例如色谱纯化;
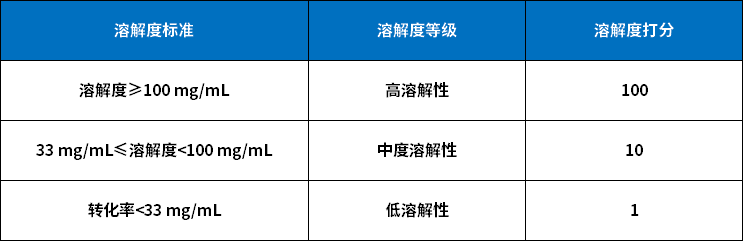
第二步是根据这些特性,对他们进行评分;
第三步是PF的计算,即将上述评分乘积;
第四步对比所得的预测PF和所需PF阈值,以决定PMI最终污染产品的可能性。
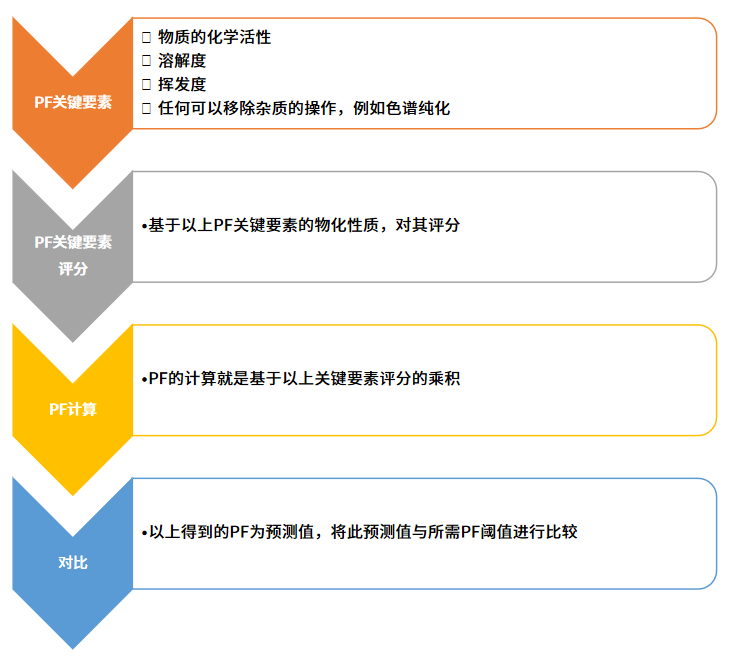
注:
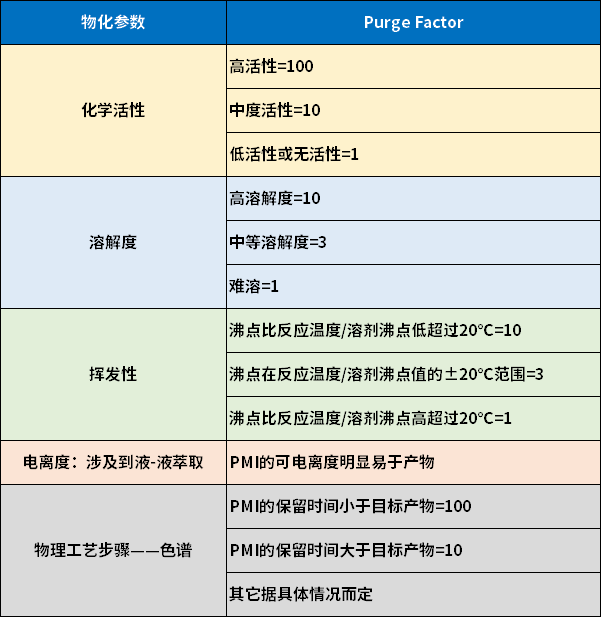
表1. PF评分系统ICH指南
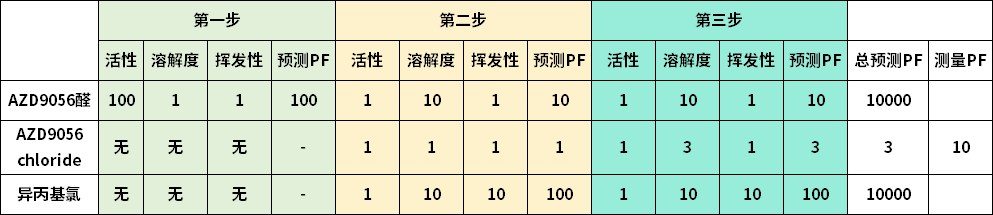
案例分析:AZ9056醛
制备AZD9056 HCl的工艺,使用了AZD9056醛作为反应物。考虑到这个反应物含有醛基,因此它可能成为最终产物中的PMI。该工艺过程如下图所示。
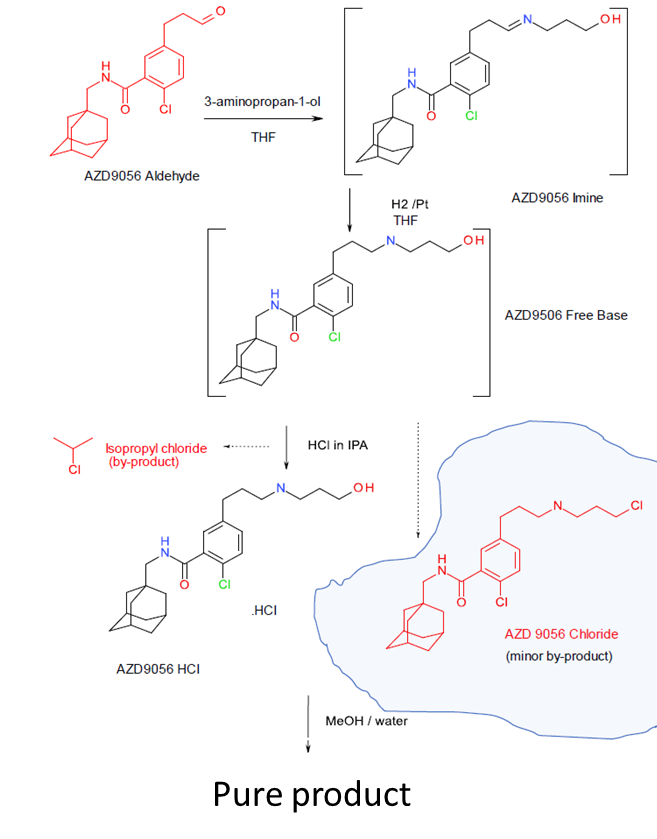
AZD9056 HCl合成路线
图片来源:Lhasa Limited
需要注意的是,除了反应物醛AZD9056之外,这个工艺中还产生了两个潜在的遗传毒 性杂质:异丙基氯(isopropyl chloride)和AZD9056 chloride。他们都是烷基氯代化合物,因此从结构上看也属于PMI的行列,因此不能忽略,需要一并分析。
对于这三个筛选出来的 PMI 的 PF 评分详情见表2。可以看出,AZD90956醛和异丙基氯都具有很高的PF预测值。前者得益于多重步骤可以去除,这也解释了越下游的PMI产生,其危险性就越高的原因,例如沙坦事件中的亚硝胺杂质,就是产生在化学反应的最后一步。
异丙基氯尽管形成在第二步,但得益于其较低的沸点(因而挥发度得分较高),也取得了10000的预测PF。与此相反的是,AZD9056 chloride的预测PF只有3。基于此潜在的高风险,研发人员通过测量的方式获取了其更为准确的PF,其值为10。至于这个数值是否可以保证AZD9056 chloride的含量控制在相应的阈值之下,就需要结合具体的工艺,以及该药物的给药方式和剂量来进行评估和判断。
表2. AZD9056醛、AZD9056 chloride和异丙基氯的PF预测

注:以上打分不仅要考虑反应过程,也需要将work-up步骤考虑进去。如果没有实验数据,也可以参考类似化合物或反应、参考文献,或者依靠专家经验。
如何使用PF
上文已经提示过,Purge Factor和Purge Ratio是两个既不相同又高度关联的内容。Purge factor的计算,可以说是为了引出Purge Ratio做铺垫,而后者将是决定应该采用何种策略管理生产工艺中引入或产生的PMI的决定因素。
Purge Ratio 的定义是“预测或测量的PMI的PF与所需要的Purge Factor之间的商”。

这个定义中又引入了一项新的内容,即:需要的PF。那么什么是需要的PF?
简单地说,需要的PF就是保证最终药物中PMI含量达标的PF值。它的定义为:反应中PMI的最大浓度(ppm,比如PMI反应物完全没有转化,或者一个反应物完全转化为了一个PMI杂质的情况下的浓度)与API中该PMI所允许的质量标准(ppm)之间的商。

在ICH M7: Control Strategy Option for Mutagenic Impurities一章中,对于如何控制PMI提出了四个选择,具体内容见下图。

ICH M7四种PMI的控制策略
从上图可以看出,四种选择是按照宽松度增加的顺序排列的。选择1需要在API中测量实际的PMI含量;选择2可以测量中间品,或者原料的PMI浓度,而且需要按照最终API的质量标准;选择3针对中间品,但可以放宽最高浓度限制,当然这是建立在对于工艺能力掌握的基础之上,以Purge Ratio作为依据进行的;选择4则无需做任何检测,这也是建立在对工艺了解的基础之上,而且Purge Ratio达到一个标准的前提下做出的决定。
具体来说,1000是Purge Ratio的一个分水岭:如果Purge Ratio大于1000的话,可以按照选择4的内容进行PMI控制,即无需做任何分析;当Purge Ratio小于1000的话,则要根据情况选择1-3的内容进行PMI分析。其决定树见下图。在关键的杂质是否被清除的标准上,采用的正是Purge ratio大于1000的原则。
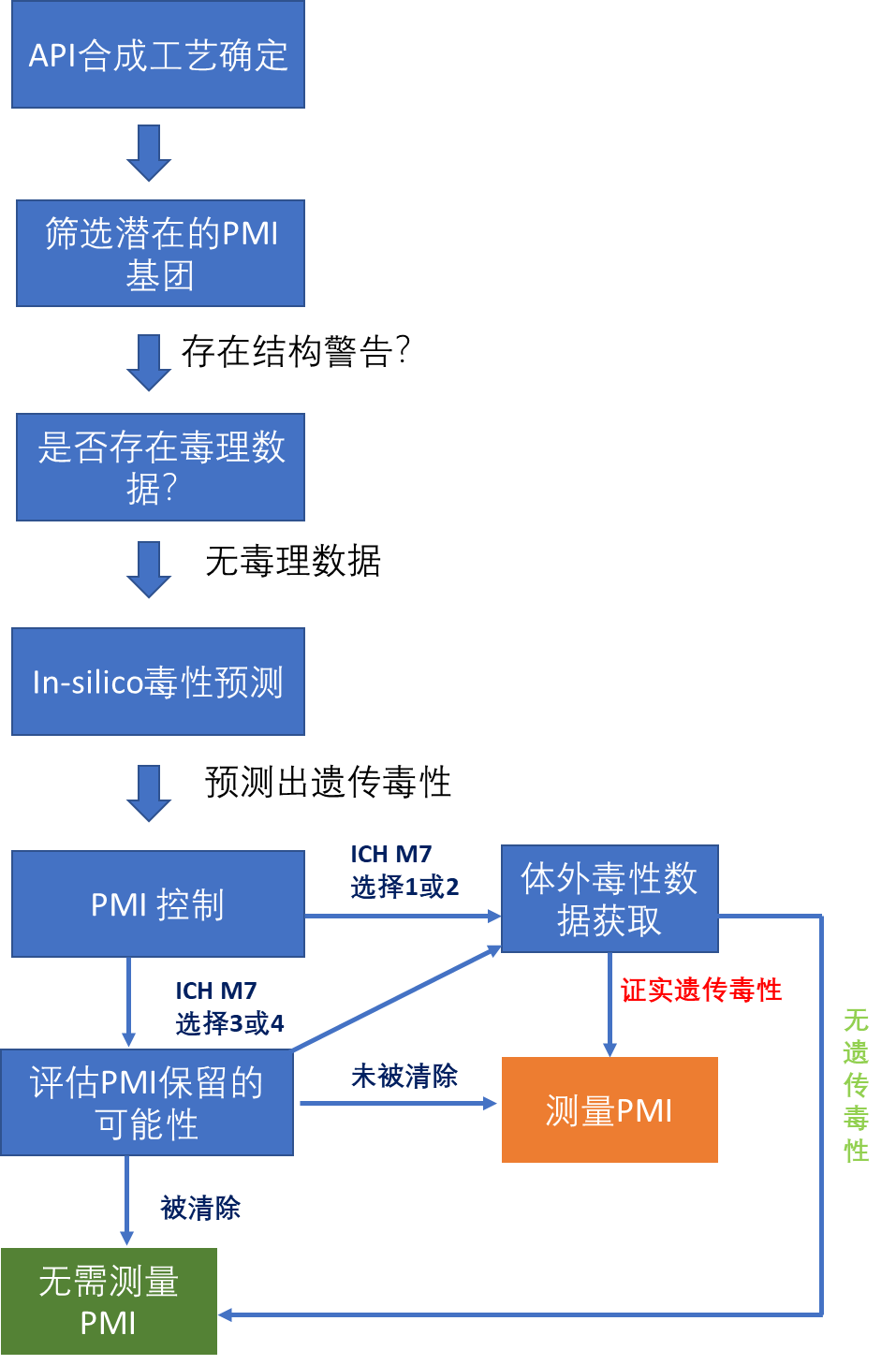
是否需要测量PMI的决定树
ICH M7关于PMI控制的示范
让我们通过一个案例来说明如何通过Purge Ratio的标准,来选择对于PMI的控制途径。
如果预测的Purge Factor(PF)值大于107,那么便可以选择ICH M7中的选项4,即不用对PMI做任何形式的测定;反之,如果PF小于107,则需要视具体情况而选择1-3的选项(也有某些Purge ratio小于1000而选择选项4的情况,见下文),测量产品、中间品或者原料中的PMI含量:
Ref.
Borths, C. J. et al. Control of Mutagenic Impurities: Survey of Pharmaceutical Company Practices and a Proposed Framework for Industry Alignment. Org. Process Res. Dev. 2021, 25, 831-837.
Elder, D. P. et al. Is Avoidance of Genotoxic Intermediates/Impurities Tenable for Complex, Multistep Syntheses? Org. Process Res. Dev. 2015, 19, 1437-1446.
Why you should consider controlling your potentially mutagenic impurities outside the lab. Lhasa Limited.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57