近日,君实生物发布2022年年报。年报显示,2022年年度实现营业收入14.53亿元,同比减少63.89%,归属母公司股东的净利润为-23.88亿元,亏损同比扩大。
2022年,是君实生物成立的十周年。十年来,君实生物4款创新药成功商业化,拥有30项临床阶段的在研产品,超过20项临床前在研产品;资本市场上,成功登陆A股、港股两个资本市场,募集资金上百亿……
然而,十年来,君实生物始终被亏损的阴影笼罩。如何从Biotech向Biopharma转变,扭亏为盈,是其下个十年必须解决的问题。
亏损扩大2.31倍
创新药研发“烧钱”是在所难免,君实生物作为创新药“四小龙”之一,近年来“烧钱”速度越来越快,亏损也越来越大。
2018年-2022年,君实生物实现营收分别为292.8万元、7.75亿元、15.95亿元、40.25亿元及14.53亿元;同期净利润分别为-7.23亿元、-7.47亿元、-16.69亿元、-7.21亿元及-23.88亿元,五年合计亏损62.48亿元。
对于Biotech公司而言,亏损其实并不可怕,可怕的是在商业化产品上市后,亏损还在持续扩大。2022年是自2019年特瑞普利单抗商业化以来,首 次出现营收下降,净利润也自2021年收窄后,再次大幅扩大。
君实生物在年报中给出的解释是,主要由于2021年基于与Eli Lilly and Company、Coherus的合作协议产生大额技术许可收入和特许权收入,而本期对应的技术许可收入及特许权收入减少。
但抛开技术许可及特许权收入,君实生物的药品销售收入也是起起伏伏。
2018年君实生物自主研发的首 个国产PD-1药物特瑞普利单抗获批,一举打破由“K药”和“O药”独占的肿瘤免疫市场。但君实生物的PD-1还未享受到先发优势,仅10天后,信达生物的信迪利单抗亦获批上市。
此后,恒瑞医药的卡瑞利珠单抗、百济神州的替雷利珠单抗也相继获批上市。截至目前,国内已获批上市14款PD-1/PD-L1单抗、1款PD-1×CTLA-4双抗,赛道内卷严重。
2019年-2021年,特瑞普利单抗销售收入分别为7.74亿、10.03亿及4.12亿,2021年销售收入下降主要是医保谈判价格降幅超60%。
2022年恢复到7.3亿元,进入“正向循环”,但同期恒瑞医药、百济神州以及信达生物的PD-1销售额分别约为41.41亿元、28.98亿元以及19.77 亿元,远超君实生物,就连康方生物的卡度尼利单抗仅上市半年销售额都达到了5.46亿元。
君实生物的PD-1可谓是“起了个大早,赶了个晚集”。
特瑞普利单抗注射液
来源:公司官网
主力产品销售后劲乏力,研发投入却连创新高。2018年-2022年,君实生物研发投入分别达到5.38亿元、9.46亿元、17.78亿元、20.69亿元及23.84亿元,增长趋势明显。
另一方面,由于产品进入商业化阶段,销售费用也大幅增加,从2018年的2049万元,增加到2021年的7.35亿元,2022年略有下降,达到7.16亿元。
研发和销售投入持续扩大,自身造血能力严重不足,只能依靠外部资本输血。
2022年12月,君实生物成功向特定对象发行7000万股A股股票,募集资金总额约37.77亿元。而在这之前,君实生物就已从A股、港股两个资本市场完成超100亿元的融资。
随着创新药投资遇冷,Biotech融资将会越来越难。截至2022年底,君实生物现金及现金等价物余额约59.97亿元,虽然不少,但也仅够其两年半的研发费用。在此之前,君实生物还需要找到足以让投资者买单的爆款产品。
超50项在研产品
一直以来,君实生物的核心竞争力就是其丰富的研发管线。
年报显示,君实生物在研产品管线覆盖五大治疗领域,包括恶性肿瘤、自身免疫系统疾病、慢性代谢类疾病、神经系统类疾病以及感染类疾病。其中,处于商业化阶段的产品4项,近30项在研产品处于临床试验阶段,超过20项在研产品处在临床前开发阶段。
君实生物研发管线
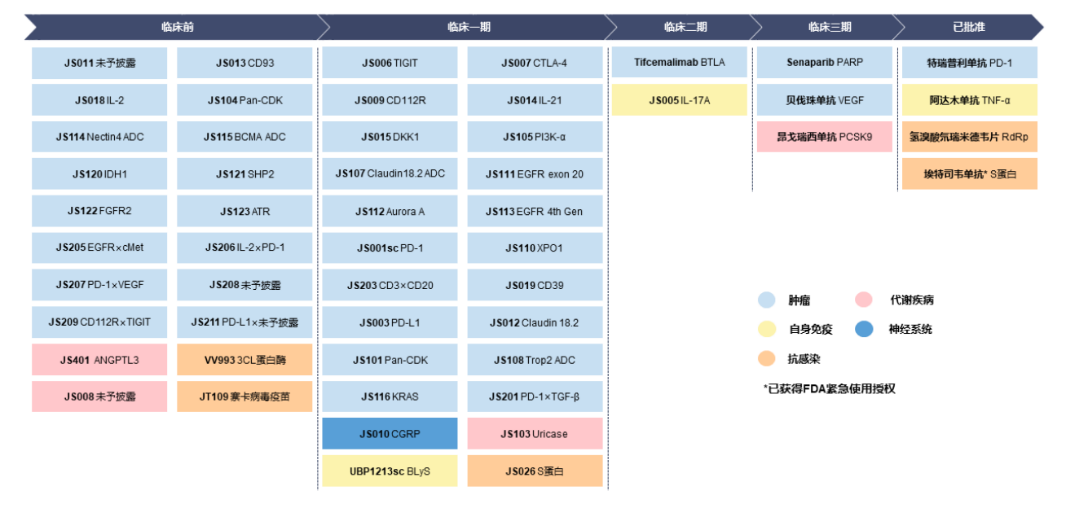
来源:年报
2022年,除了特瑞普利单抗新增2项大适应症,另有两款产品商业化上市,分别是阿达木单抗和VV116(国产新冠口服药)。
阿达木单抗用于治疗类风湿关节炎、强直性脊柱炎等8项适应症获得NMPA批准上市,2022年5月开出首张处方。但目前来看,君实生物累计投入了1.2亿元的阿达木单抗并未带来预期中的回报,2022年,阿达木单抗实际收入可能只有1000多万元。
此前备受市场期待的国产新冠口服药遗憾未能赶在2022年获批上市,2023年1月底上市后销量如何未在年报中体现。这款君实生物投入8.79亿元的新冠口服药随着新冠疫情渐入尾声,前景令人担忧。
VV116(民得维)

来源:年报
除了已获批上市的产品外,君实生物积累的多款临床阶段产品也具有成为“爆款”的潜力。
Tifcemalimab(JS004)
Tifcemalimab是全球首 个进入临床开发阶段(first-in-human)的anti-BTLA单抗,目前已进入Ib/II期剂量扩展阶段。
在2022年的ASCO年会上,君实发布了JS004在淋巴瘤及实体瘤中的初步临床数据。数据显示,JS004单药或与特瑞普利单抗联合治疗复发难治性淋巴瘤以及实体瘤患者都具有良好的耐受性,并显示出初步临床疗效。此次数据公布,成为BTLA靶点药物在肿瘤领域重要的里程碑事件。
君实生物目前正在与FDA及NMPA就Tifcemalimab启动注册临床试验沟通交流,如获监管机构同意,计划在2023年内开展III期注册临床研究。
TIGIT单抗(JS006)
JS006是一款TIGIT单抗,多项临床前的试验结果显示抗TIGIT抗体与抗PD-1/PD-L1抗体可发挥协同抗肿瘤作用。目前国内外尚无同类靶点产品获批上市,2021年JS006分别获得NMPA和FDA的临床试验许可。
2022年1月,Coherus启动行使JS006在美国和加拿大的许可选择权的程序,向君实生物一次性支付3500万美元执行费,在达到相应的里程碑事件后,将支付累计不超过2.55亿美元的里程碑款,外加18%的销售分成。
IL21/HSA融合蛋白(JS014)
JS014通过融合抗HSA的单域抗体使IL-21的半衰期得到显著延长,具有长效作用潜力和更好的成药性。此外,JS014与免疫检查点单抗联用体现出强大的协同抗肿瘤活性。
2021年8月,JS014获得IND批准,目前I期临床研究入组正在进行中,有望成为全球首 个长效IL-21融合蛋白。
第四代EGFR-TKI(JS113)
JS113是一种first-in-class的第四代EGFR抑制剂,拟用于EGFR突变非小细胞肺癌和其他实体瘤的治疗,市场空间广阔。
2022年6月,JS113的IND申请获得NMPA批准。截至目前,JS113的I期临床研究入组正在进行中。
然而,这些潜力管线都还处在临床早期阶段,距离上市还有很长的路要走,充满了不确定性。目前,君实生物最接近上市的是昂戈瑞西单抗(JS002)和PARP抑制剂Senaparib(JS109),计划在2023年提交上市申请,商业化还需要1-2年的时间。
在已有产品销量增长乏力,等待新药上市的空档期内,君实生物将目光投向海外市场。
出海步伐加快
受困于国内PD-1赛道内卷加剧以及支付体系较为单一的限制,特瑞普利单抗的销量没有达到市场预期。因此,加快“出海”步伐成为君实生物近几年工作的重点。
早在2021年2月,君实生物就开始考虑出海,与Coherus公司就特瑞普利单抗在美国和加拿大的开发和商业化达成合作,并于当年3月正式向FDA滚动提交了特瑞普利单抗用于治疗复发或转移性鼻咽癌的生物制品许可申请(BLA)并获得了FDA滚动审评。
不过由于新冠疫情影响,FDA未能在目标评审期内完成现场核查。近期,Coherus官网披露的最新消息,FDA已通知该公司,将在今年第二季度对特瑞普利单抗的中国生产基地进行现场核查,如果能在上半年获得FDA批准,计划于今年三季度直接在美国上市特瑞普利单抗。
2022年,君实生物又分别向欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)递交特瑞普利单抗的上市申请,申报适应症均为鼻咽癌一线治疗和食管鳞癌一线治疗。
海外批准临床项目
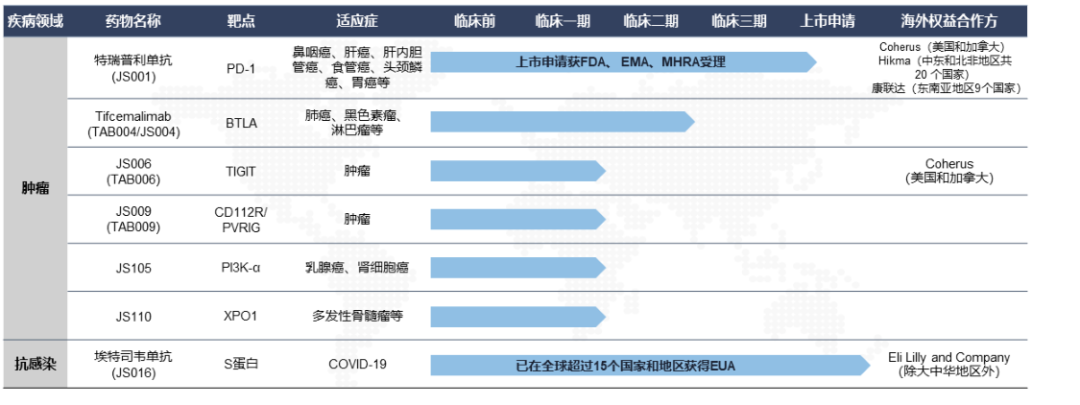
来源:年报
与大多数创新药“出海”思路不同,除了布局北美和欧洲市场外,君实生物也十分重视对新兴市场的开拓。
在北非市场,君实生物与Hikma签署了《独占许可与商业化协议》。Hikma被授予在约旦、沙特阿拉伯、阿联酋、卡塔尔、摩洛哥、埃及等中东和北非地区共20个国家开发和商业化特瑞普利单抗注射液的独占许可,公司可获得合计最高达1200万美元的付款,外加销售净额近20%的阶梯分成。
在东南亚市场,君实生物与康联达生技共同设立合资公司在东南亚地区9个国家,包括泰国、文莱、柬埔寨、印度尼西亚、老挝、马来西亚、缅甸、菲律宾、越南,对特瑞普利单抗进行合作开发和商业化。
北非、东南亚等新兴市场,人口基数大,随着未来区域经济的快速增长,当地新兴中产阶级的崛起,在医疗健康领域消费意愿和支付能力的持续快速增长,这些市场将有望成为全球发展速度最快的医药市场之一。
君实生物的“出海”战略如能顺利,不仅能成为其业绩的重要增长点,还将成为中国创新药“出海”的典范,为国内创新药打破“内卷”提供新思路。
结 语
越冷的冬天,越能筛选出扛得住寒气的企业,体现出长坡厚雪的价值。君实生物正一步一个脚印,探索成功之路,未来将走向何方,我们将持续关注。
参考资料
1. 君实生物年报、季报
2. 《出海,这家药企选定这里,凭什么?6亿人口,潜力巨大!》,第一财经,2023-03-30
3. 《君实生物的理想与现实:斥资24亿推进逾50项在研管线 PD-1却仅售出7亿元》,财联社,2023-03-31



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57