4月18日,和黄医药「呋喹替尼胶囊」在国内递交的2.4类新药注册申请获CDE受理。据悉,此次呋喹替尼申报的适应症为:联合紫杉醇二线治疗晚期胃癌和胃食管结合部腺癌。
呋喹替尼是和黄医药自主研制、具有完全知识产权的新型口服血管内皮生长 因子受体(VE GFR)酪氨酸激酶抑制剂,通过抑制血管内皮细胞表面的VE GFR磷酸化及下游信号转导,抑制血管内皮细胞的增殖、迁移和管腔形成,从而抑制肿瘤新生血管的形成,最终发挥肿瘤生长抑制效应。据公司官网,呋喹替尼被开发用于治疗结直肠癌、胃癌、子宫内膜癌等多种实体瘤(单药或联合其他药物)。
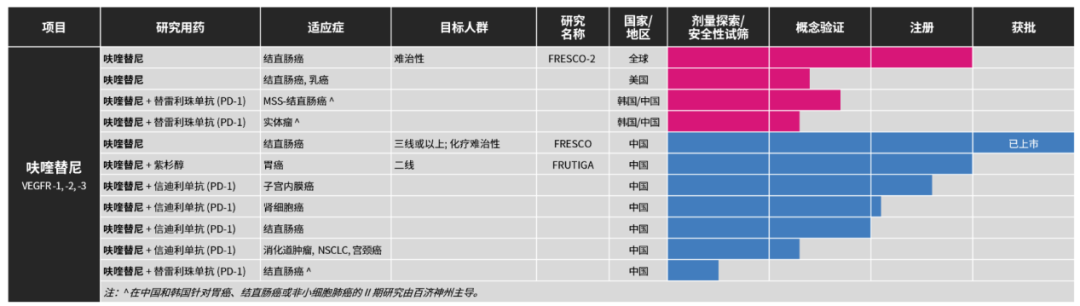
2018年9月,呋喹替尼在国内首次获批,单药治疗既往接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗血管内皮生长 因子(VE GF)治疗、抗表皮生长 因子受体(EGFR)治疗(RAS野生型)的转移性结直肠癌,商品名为爱优特。2019年11月,呋喹替尼通过价格谈判以63%的降幅进入国家医保。
2020年7月,和黄医药与礼来就此前签订的呋喹替尼许可和合作协议达成一项修正案。据修正案,礼来将继续享有对呋喹替尼在中国的独家商业化权益,双方共同推动呋喹替尼在全中国的商业化活动。
此次呋喹替尼在国内递交新适应症上市申请是基于3期研究FRUTIGA的数据。该研究是一项在中国开展的随机双盲试验,共纳入703名患者,旨在评估呋喹替尼和紫杉醇联合疗法对比紫杉醇单药疗法二线治疗晚期胃癌或胃食管结合部腺癌患者。
2022年11月,和黄医药宣布该研究取得阳性顶线结果,达到其中一个主要终点,即无进展生存期(PFS)取得具有统计学意义的显著改善,且这一结果具有临床意义。同时,另一个主要终点总生存期(OS)虽然在中位OS上观察到改善,但按照预设的统计计划未取得统计学显著性。此外,包括客观缓解率(ORR)、疾病控制率(DCR)和延长缓解持续时间(DoR)在内的次要终点亦均观察到具有统计学意义的显著改善。
此外,呋喹替尼已开始进军海外市场。2023年1月,和黄医药与武田制达成独家许可协议,将呋喹替尼在中国内地、香港和澳门以外全球范围内的开发、商业化和生产权益授权给武田,交易金额达11.3亿美元。2023年3月,和黄医药宣布已完成向FDA滚动递交呋喹替尼治疗难治性转移性结直肠癌的新药上市申请(NDA)。
据公司财报,呋喹替尼上市后销售额逐年攀升,2019年-2022年销售额分别为1760万美元、3370万美元、7100万美元和9350万美元。预计未来随着新适应症及获批范围的扩大,呋喹替尼销售额还将持续增长。
和黄医药管线分析
和黄医药是中国首家专注于全球市场的创新型医药研发企业之一,目前已有三款药物实现商业化,即爱优特(呋喹替尼胶囊)、苏泰达(索凡替尼胶囊)和沃瑞沙(赛沃替尼片)。这三款药物均是小分子化药,被批准用于治疗肿瘤,且均通过医保谈判进入国家医保。
索凡替尼
索凡替尼是一种新型口服酪氨酸激酶抑制剂,具有抗血管生成和免疫调节双重活性。该药通过抑制血管内皮生长 因子受体(VE GFR)和成纤维细胞生长 因子受体(FGFR)以阻断肿瘤血管生成,并可抑制集落刺激因子1受体(CSF-1R),通过调节肿瘤相关巨噬细胞,促进机体对肿瘤细胞的免疫应答。目前,索凡替尼已于2020年12月和2021年6月先后被NMPA批准用于治疗晚期非胰 腺神经内分泌瘤(epNETs)和晚期胰 腺神经内分泌瘤(pNETs)。
赛沃替尼
赛沃替尼(曾用名:沃利替尼)是和黄医药自主研发的高选择性口服小分子c-Met激酶抑制剂,2021年6月在国内被NMPA批准用于含铂化疗后疾病进展或不耐受标准含铂化疗的、具有间质-上皮转化因子(MET)外显子14跳变(METex14)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
他泽司他
此外,和黄医药与美国Epizyme公司合作开发的创新药他泽司他(商品名达唯珂?/Tazverik?)的临床急需进口药品申请已获批于海南博鳌乐城国际医疗旅游先行区使用。他泽司他是全球批准的首 个EZH2抑制剂,2020年1月被FDA批准用于治疗不适用于手术切除的转移性或晚期上皮样肉瘤(ES)。
据公司财报,上述4款药物2022年的销售额达1.638亿美元,其中爱优特、苏泰达和沃瑞沙是和黄医药的三大头牌,销售额分别为9350亿美元、3230亿美元和4120亿美元。
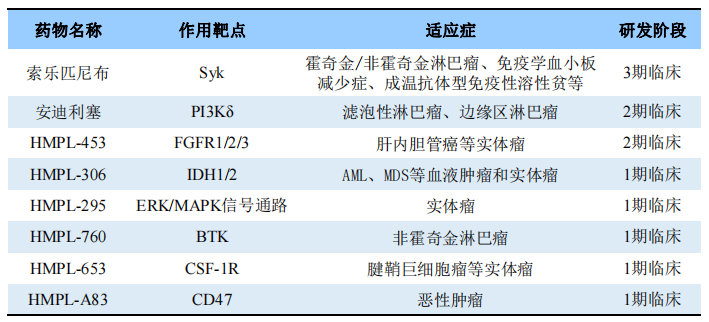
除了上述药物,和黄医药还有多款在研产品(详见下表),这些药物主要被开发用于治疗肿瘤以及自身免疫性疾病。药物类型上,除了HMPL-A83是一款CD47靶向单抗,其余均是小分子化药。作用靶点上,在研药物主要集中在PI3Kδ、BTK等热门肿瘤新药研发靶点,且这些靶点药物竞争并不激烈,获批药物数量并不多。
和黄医药部分在研药物
资料来源:和黄医药官网
研发进度上,索乐匹尼布处于3期临床,安迪利塞和HMPL-453处于2期临床,其余几款处于1期临床。
索乐匹尼布
索乐匹尼布(HMPL-523)是一种新型、选择性小分子口服脾酪氨酸激酶(Syk)抑制剂(Syk作为B细胞受体和Fc受体信号传导通路中的一个关键蛋白,是自身免疫疾病及多种亚型的B细胞淋巴瘤的成熟治疗靶点)。2022年1月,索乐匹尼布被CDE纳入纳入突破性治疗药物品种,用于治疗免疫性血小板减少症(ITP),目前其针对免疫性血小板减少症的中国3期临床试验正在进行中。
2023年4月,《The Lancet Haematology》上发表的索乐匹尼布治疗成人ITP的1b/2期临床研究结果显示:在索乐匹尼布的4个剂量组中,300mg qd治疗组(包括剂量递增阶段和剂量扩展阶段)的疗效尤为突出,其总体应答率(ORR)为80%,持续应答率(DRR)为40%。而且,索乐匹尼布起效迅速,起始使用索乐匹尼布300mg剂量的患者,有75%的比例在治疗第8天血小板计数≥30×109/L。
此外,索乐匹尼布治疗成温抗体型免疫性溶性贫(「wAIHA」)的2/3期临床试验已于2022年10月在国内启动。
安迪利塞
安迪利塞(HMPL-689)是一种新型、选择性强效口服PI3Kδ异构体抑制剂,旨在解决目前已获批及处于临床研究阶段的PI3Kδ抑制剂相关的胃肠道疾病和肝毒 性。临床前药代动力学研究表明安迪利塞具有良好的口服吸收、适度的组织分布和低清除率,这表明安迪利塞的药物蓄积以及药物间相互作用的风险较低。2023年2月,安迪利塞用于治疗复发或难治性滤泡性淋巴瘤的2期临床试验完成患者招募。
HMPL-453
HMPL-453是一种新型、高选择性且强效的成纤维细胞生长 因子受体 (FGFR)1、2和3抑制剂。2023年4月,HMPL-453用于治疗伴有FGFR 2 融合的晚期肝内胆管癌的2期临床试验启动。
总 结
肿瘤免疫业务是和黄医药希望打造的收入支柱,呋喹替尼、索凡替尼和赛沃替尼作为该业务板块的主要收入来源,市场表现并不算好,三款药物的销售额总和(约为1.67亿美元)还不如旗下上海和黄药业的一款中药产品麝香保心丸(2022年其销售额为3.07亿美元)。而且,2022年和黄医药研发投入同比增长29%,达3.87亿美元。新上市产品差强人意的商业化表现,以及高研发投入导致和黄医药亏损进一步增加,2022年其净亏损达3.6亿美元。
此外,2022年5月,索凡替尼治疗胰 腺和非胰 腺神经内分泌瘤的新药上市申请惨遭FDA拒批。再加上国内资本寒冬,2022年11月和黄医药宣布进行战略转变,将专注于其内部开发管线中最前沿的、最有可能推动近期价值的药物,优先考虑其后期注册研究及通过监管机构批准的这些药物上市。
根据在研产品进度,索乐匹尼布、安迪利塞和HMPL-453有望凭借较快的研究进展,成为和黄医药续命的新血液。此外,已上市产品适应症的增加也将有利于和黄医药扭转当前尴尬局面。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57