5月4日,华东医药(000963.SZ)发布公告,公司美国合作方ImmunoGen对外宣布用于治疗卵巢癌的全球首 创(first-in-class)ADC药物ELAHERE®在Ⅲ期临床MIRASOL试验中获得了积极的关键数据(top-line data),于FRα阳性铂类药卵巢癌患者中证明了总体生存获益。ImmunoGen计划于2023年下半年在美国提交补充生物制品许可申请 (sBLA),以将ELAHERE®的加速批准转为完全批准,并在欧洲提交上市许可申请 (MAA)。受此消息影响,ImmunoGen股价当天大涨136%,市值达到27.7亿美元。
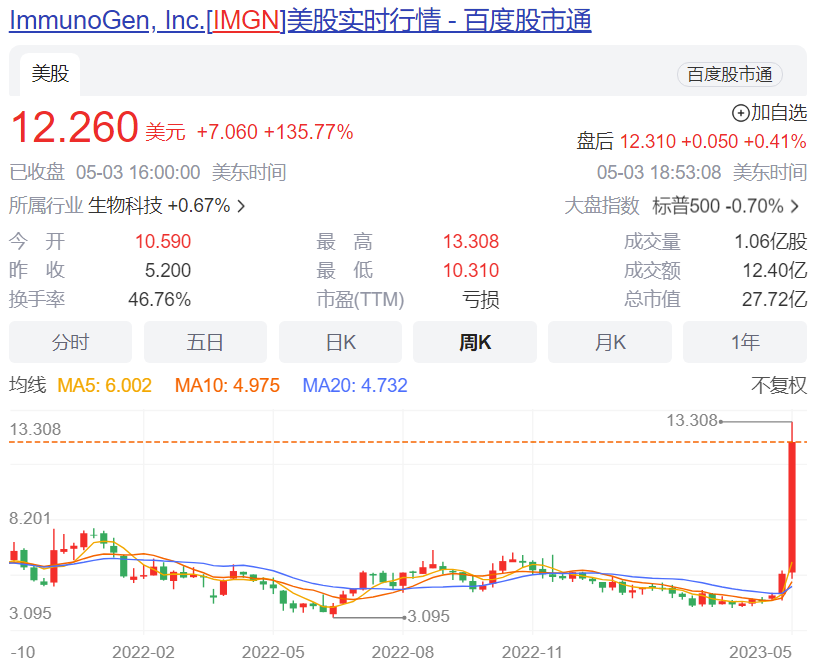
ImmunoGen 股价走势图
图片来源:百度股市通
全球首 个卵巢癌ADC
预计今年国内申报上市
ELAHERE®为华东医药与ImmunoGen合作开发的全球首 个针对叶酸受体α(FRα)阳性卵巢癌的ADC药物。此次公布的MIRASOL 试验一共招募了 453 名患者,最终数据结果显示:ELAHERE®治疗组相比于IC化疗组,中位OS从12.75个月延长到16.46个月,死亡风险降低33%;中位PFS从3.98个月延长到5.62个月,疾病进展或死亡风险降低35%。ELAHERE®组中研究者评估的ORR为 42.3%,包括12个完全缓解(CR),而 IC化疗组为15.9%,无CR。安全性方面,与IC化疗相比,ELAHERE®不良事件发生率更低,没有发现新的不良安全信号。
ImmunoGen 表示随着MIRASOL获得成功,ELAHERE®有潜力成为治疗FRα阳性的卵巢癌新标准。
卵巢癌被认为妇科恶性肿瘤中最为凶险的癌种,据统计,全球卵巢癌的年新发病例数约31万,每年死亡病例数约21万。由于卵巢癌早期症状隐匿且非特异,约80%的患者确诊时已为晚期,5年生存率仅有40%。根据《Global Cancer Burden in 2020》,2022年国内卵巢癌发病人数达5.76万人,浙商证券研究所预计到2025年,国内卵巢癌发病人数将达6.11万人。
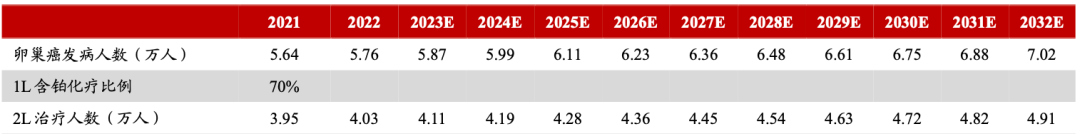
国内卵巢癌发病及治疗人数《Global Cancer Burden in 2020》
图片来源:浙商证券研究所
全球铂耐药复发性卵巢癌(PROC)的治疗选择十分有限,传统非铂类化疗、抗血管生成药物和 PARP 抑制剂均无法满足铂耐药患者的治疗需求。当下各类非铂单药有效率仅4%-13%左右;非铂化疗联合贝伐珠单抗的中位OS不足1年半,治疗需求仍未满足;由于存在增加铂耐药患者死亡风险的可能,2022年多家PARP抑制剂接连撤回PROC后线治疗适应症。
ELAHERE®是目前唯一获得III期临床数据的FRα ADC药物,通过特异性识别肿瘤细胞表面的靶标蛋白,释放药物分子,进而实现对肿瘤细胞的精确打击,开创了卵巢癌治疗新途径。
ELAHERE®在去年11月获FDA加速批准上市后,销售额迅速放量,2023年一季度销售额达2950万美元,进一步填补了临床治疗的空白。随后被2023年最新版NCCN指南首选推荐用于单药或联合治疗FRα阳性PROC。
华东医药拥有ELAHERE®在大中华区(含中国大陆,香港、澳门和台湾地区)的独家临床开发及商业化权益,并计划于2023下半年向NMPA提交ELAHERE®上市申请。
ELAHERE®在国内的其他临床试验也在积极开展。2022年7月,ELAHERE®在中国的I期临床试验PK药代研究已完成全部受试者入组。2022年12月,该产品完成中国Ⅲ期单臂临床试验全部受试者入组。
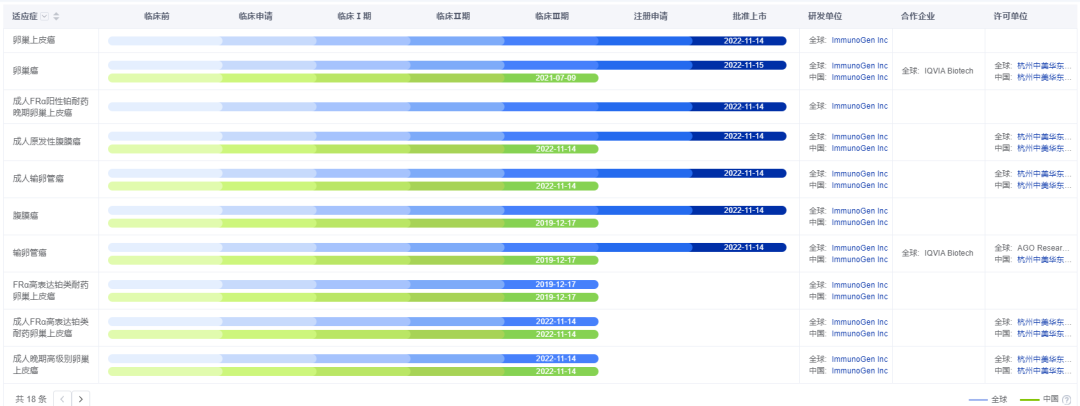
ELAHERE®部分在研适应症
图片来源:药智数据——全球药物分析系统
华东医药于2020年10月从ImmunoGen引入ELAHERE®,交易总金额超过3亿美元,其中包括4000万美元的首付款和2.65亿美元的潜在里程碑付款。ELAHERE®也成为国内首 个靶向FRα的在研ADC药物,临床竞争格局良好,研发进度也远超同类产品。此次ELAHERE®3期临床试验的成功,对其在中国获批上市构成积极影响。
近年来,华东医药在ADC领域持续加大差异化纵深布局,并且与ADC领域全球新兴的科技公司Heidelberg Pharma开展股权投资及产品合作,成为其第二大股东,同时引入多款ADC创新产品,进一步提升了在ADC领域全球一流的研发技术和临床注册能力。其中HDP-101 为针对多发性骨髓瘤 BCMA 靶点的 ADC 药物,正在开展海外 I/II 期临床;HDP-103 为针对前列腺癌 PSMA 靶点的 ADC 药物,正在临床前研究阶段。
截至2023年一季报披露,华东医药自主立项 6 个临床前或探索性的全新靶点 ADC 项目。预计在 2025 年前将获得额外至少 4 个自研 PCC 的确认和 2 个自研 ADC 项目 IND 获批。目前首 个原创 ADC 项目已完成PCC 确认,正进行 IND 开发并计划于 2024 年内申报临床。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57