EGFR是一个易突变蛋白,它的异常与很多疾病相关,靶向EGFR激酶小分子药物已经发展了4代,1-3代靶向药已经在临床广泛应用,而第四代靶向药正已经在进行临床试验。
但是EGFR是一个非常容易突变的蛋白,这些小分子药物治疗很容易引起耐药性。除了靶向小分子药物以外,还采取一些其它克服耐药性的方法,如联合用药,或采用新技术蛋白降解靶向嵌合体(PROTAC)和溶酶体靶向嵌合体(LYTAC)等。
PROTAC受到国内外企业界和学术界的广发关注,据不完全统计,GSK在研的PROTAC项目有22个,阿斯利康有19个和Arvinas有18个等。
目前有很多不同类型的EGFR的PROTACs被报道,但大多数处于临床前。国内方面,在EGFR PROTAC上布局的药企并不多。海思科自主研发的口服EGFR-PROTAC HSK40118的临床试验申请于今年获得NMPA受理,成为国内首家申报EGFR PROTAC临床的国内药企。
国外企业C4 Therapeutics在EGFR PROTAC布局较为靠前,其针对EGFR L858R突变的降解剂CFT8919已经申报临床。
EGFR的LYTAC相对于PROTAC来说研究较少,有两种类型被报道,一种是基于CI-M6Pn,另一种基于tri-GalNAc。
EGFR的结构与不同治疗策略
EGFR作为一种跨膜蛋白,属于EGF家族的成员,是一种受体酪氨酸激酶(RTK)。EGFR在人上皮细胞的信号转导途径中起关键作用,并参与细胞增殖、侵袭、凋亡和血管生成。
EGFR由28个外显子和27个内含子组成,编码1186个氨基酸,其糖基化单体具有~170 kDa分子量。
EGFR的结构包括三个组成部分:细胞外结构域,跨膜结构域和细胞内结构域(酪氨酸激酶结构域和具有多个自磷酸化位点羧基末端尾部)。
靶向EGFR的治疗策略有多种,包括抑制剂,单克隆抗体(mAb),ADC,PROTAC和LYTAC等(图1)[1]。
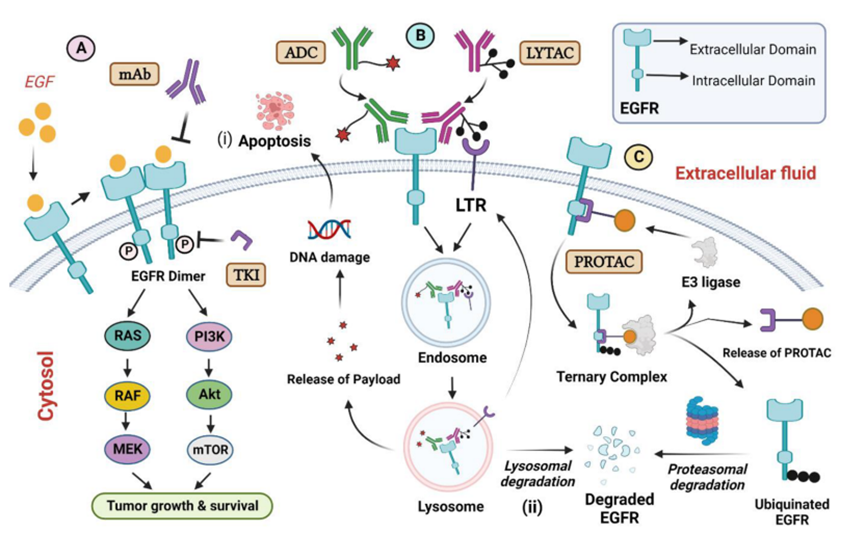
图1. 靶向EGFR的不同治疗策略
EGFR激酶抑制剂和耐药性机制
靶向EGFR激酶小分子药已经发展了4代,1-3代靶向药已经在临床广泛应用,而第四代靶向药正在进行临床试验。
第一代药物包括吉非替尼,厄洛替尼和埃克替尼;第二代药物包括阿法替尼和达可替尼;第三代药物包括奥希替尼,阿美替尼和伏美替尼。使用这些药物不可避免会产生耐药性突变,第三代药物主要的耐药突变也是C797S,这需要第四代EGFR靶向药克服,前三代抑制剂都是靶向催化位点,第四代是靶向变构位点。在研第四代药物非常多,不过多数处于早期研究阶段,目前只有两个药物发表了初步的人体试验数据,分别是BLU-945和BBT-176。
但是EGFR是一个非常容易突变的蛋白,这些小分子药物治疗很容易引起耐药性。
EGFR突变,包括外显子18-25中的点突变、缺失和插入,可将蛋白质结构的平衡从非活性状态转变为活性状态,导致EGFR和其他HER家族蛋白在没有配体刺激的情况下过度磷酸化。外显子19缺失和外显子21中的错义突变(L858R)是最常见的位点突变,占到了肺腺癌EGFR体细胞突变的85%以上[2]。
EGFR的耐药机制分为EGFR依赖性耐药机制和EGFR非依赖性耐药机制。EGFR依赖性耐药机制即是由EGFR自身的改变而造成的,包括T790M突变,C797X突变,G796R,G796S和G796D溶剂前沿突变,涉及18外显子的L718Q,G719C/S/A和G724S突变,涉及21外显子的G834L突变,野生型EGFR基因扩增等[3]。
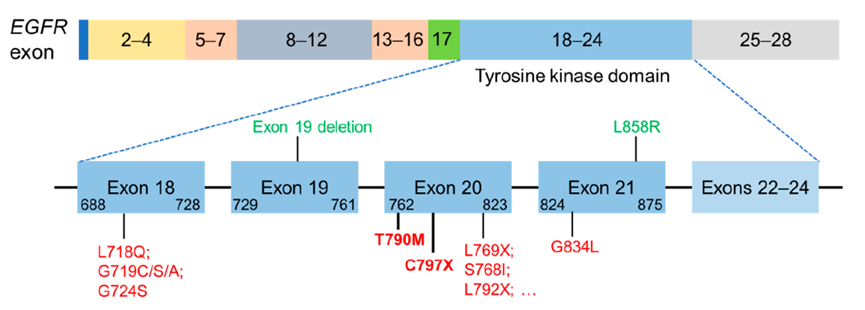
图2. EGFR依赖性耐药机制
EGFR非依赖性耐药机制即除了EGFR外其它通路蛋白或基因的改变而导致的,如MET扩增,HER2扩增,基因融合/染色体重排,KRAS突变,BRAF V600E突变,PIK3CA突变和PTEN丢失,CDK4或CDK6基因,CDKN2A基因的扩增或突变,FGFR,Src激酶等上游基因异常也可驱动EGFR抑制剂耐药。
靶向EGFR的新技术PROTAC
开发的靶向EGFR突变的小分子药物可能会暂时解决一些耐药性突变问题,但是EGFR基因是一个易突变基因,这些靶向小分子药物或早或晚都会引起耐药性突变。除了靶向小分子药物以外,还采取一些其它克服耐药性的方法,如联合用药,采用新技术蛋白降解靶向嵌合体(PROTAC)和溶酶体靶向嵌合体(LYTAC)等。
2018年第一个基于VHL配体的EGFR的PROTAC 16被报道(图3),2020年第一个EGFR的LYTAC被报道,随着技术的发展,越来越多的EGFR的PROTACs被报道,包括基于CRBN配体的PROTAC,基于IAPs的PROTAC 和靶向EGFR/PARP双靶点PROTAC降解剂等(图3)。
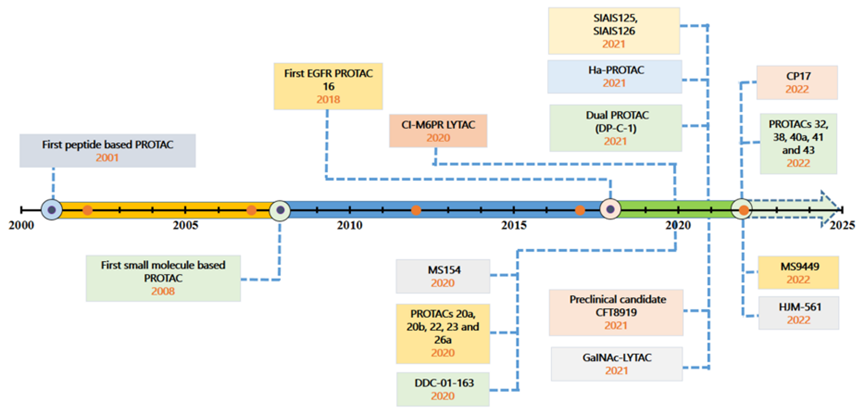
图3. EGFR-PROTACs和LYTACs开发取得重大突破的时间表
PROTAC受到国内外企业界和学术界的广发关注,据不完全统计,GSK在研的PROTAC项目有22个,阿斯利康有19个和Arvinas有18个等(图4)。
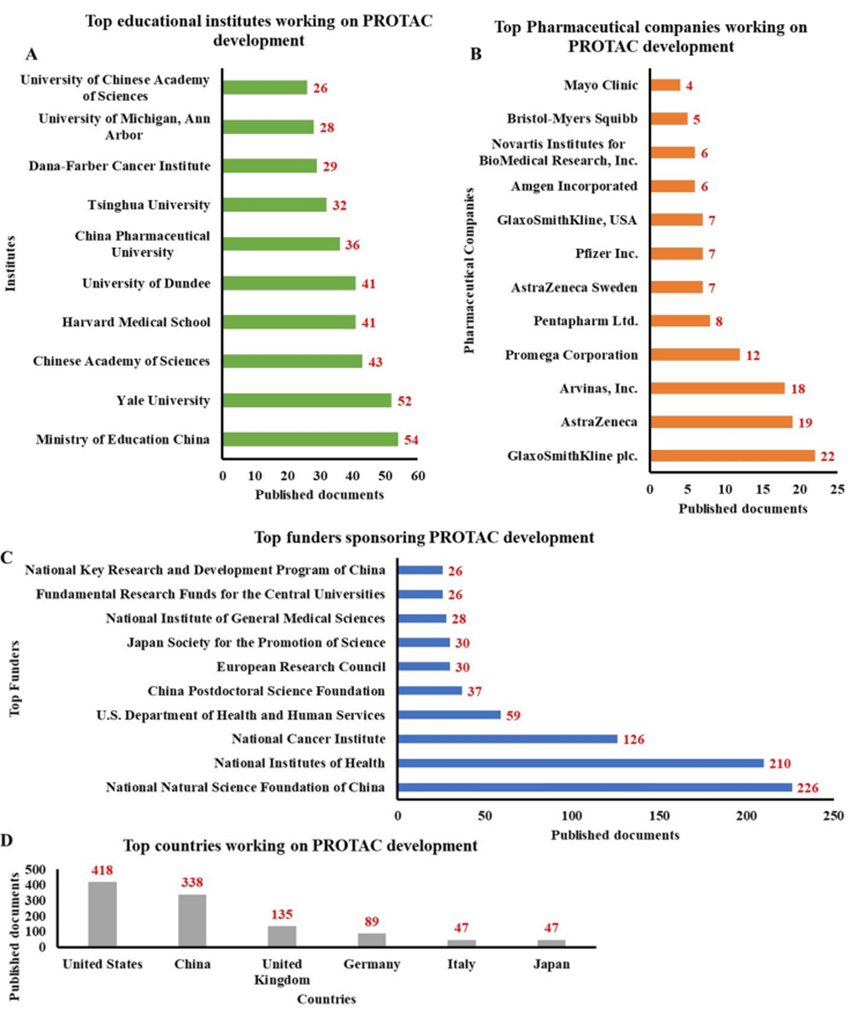
图4. PROTAC领域的关键发展的条形图
2018年,使用第一代和第二代EGFR抑制剂通过不同接头连接VHL配体开发了第一批EGFR PROTACs,如化合物16。化合物16能明显降解EGFRdel19(DC50 = 11.7 nM)和EGFRL858R(DC50 = 22.3 nM)突变蛋白(图5A)。
首 款基于CRBN的强效EGFR-PROTAC,MS154(17)和基于VHL的EGFR-PROTACs在2020年初被报道。17的结合亲和力高于在EGFR WT中最有效的基于VHL的PROTAC MS39(18)(图5B)。化合物18和17降解的 EGFRdel19的DC50为5 nM和11nM,降解EGFRL858R的DC50分别为3.3 nM和25 nM。
用不同长度和组成的接头连接含有吡啶[3,4-d]嘧啶基第四代EGFR-TKI A(19)(IC50 = 7.2 nM在EGFR L858R/T790M/C797S中)和VHL和CRBN配体开发了一组13个PROTACs。基于VHL-032的 PROTAC (20a)在HCC827细胞中降解EGFRdel19(DC50 = 34.8 nM)比基于来那度胺的PROTAC(20b)(DC50 = 45.2 nM)更有效(图5C)。
Zhang等人应用了四种不同的E3连接酶配体和不同接头设计合成 PROTACs。PROTAC 22(图5D)在H1975细胞系中以低浓度(DC50 = 5.9 nM)选择性降解EGFRL858R/T790M,在A431细胞中即使在较高的浓度下也几乎不降解EGFRWT的浓度(DC50 > 2000 nM)。
使用不同PEG接头连接奥希替尼和CRBN配体来那度胺开发的PROTACs表现出中度的EGFRdel19降解。如化合物 23(图5E)在PC9细胞系中降解EGFRdel19(DC50 = 0.161 μM),并且在0.3 μM处治疗6小时后发生最大降解。
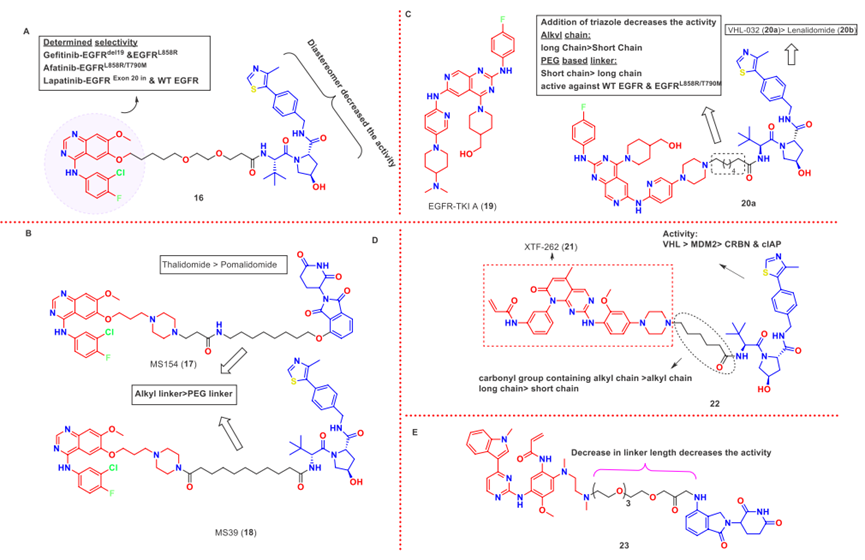
图5. EGFR的PROTACs
通过用不同长度的PEG和烷基链接头连接EAI001修饰弹头JBJ-07-149(24)和CRBN配体泊马度胺合成一系列PROTACs,如化合物25(图6)。在这些PROTACs中,DDC-01-163(25a)是Ba/F3和H1975细胞中对EGFRL858R/T790M最有效的降解剂。
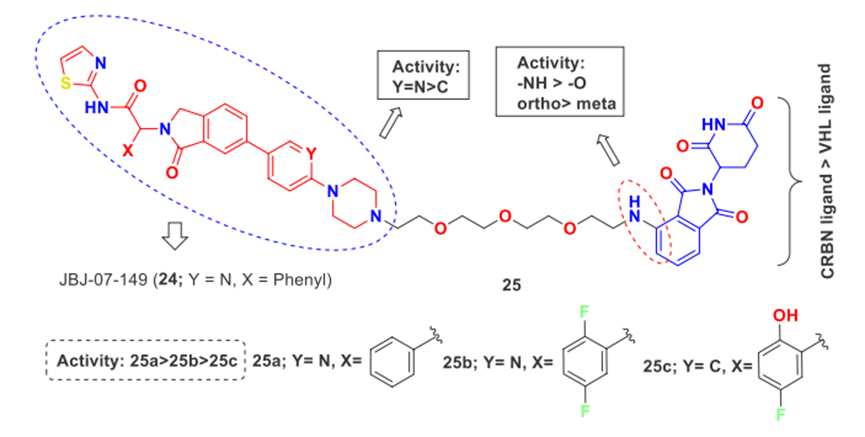
图6. 基于EAI001的改良PROTAC在Ba/F3 EGFRL858R/T790M细胞中SAR
除此之外,还有很多EGFR的PROTACs被报道,具体如图7和图8。
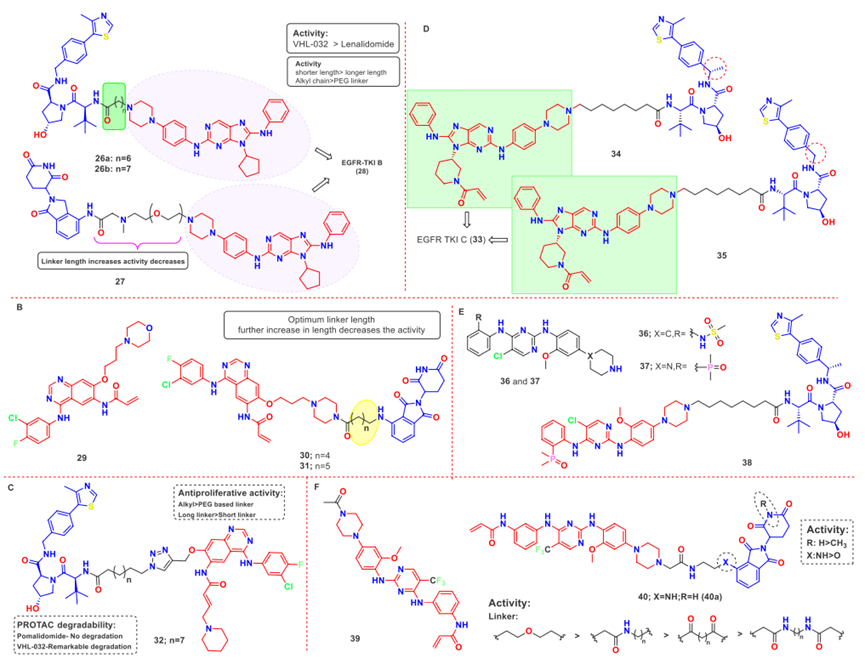
图7. EGFR的PROTACs
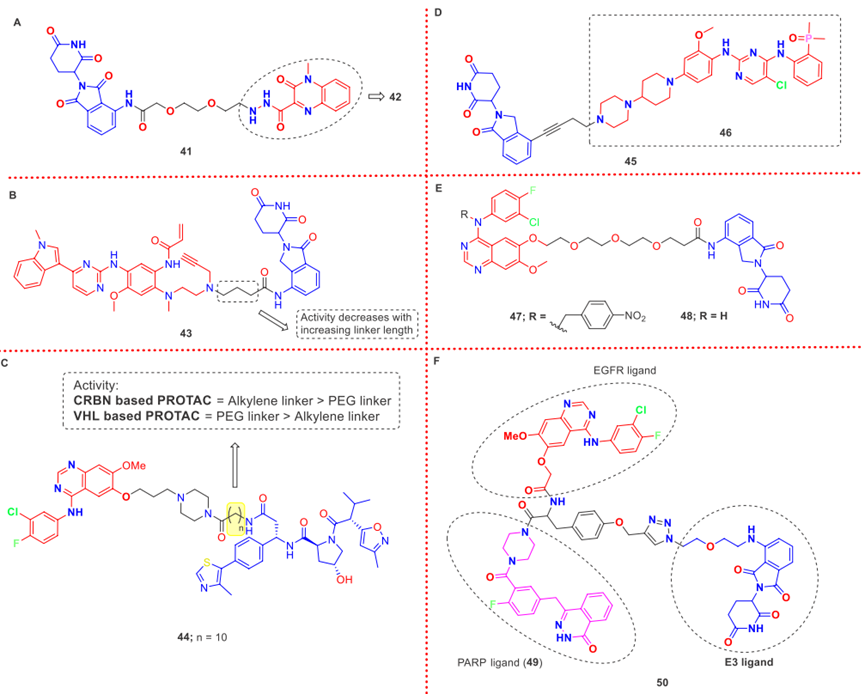
图8. EGFR的PROTACs
国内方面,在EGFR PROTAC上布局的药企并不多。2023年1月10日,海思科自主研发的口服EGFR-PROTAC小分子抗肿瘤药物HSK40118的临床试验申请获得国家药品监督管理局受理,成为国内首家申报EGFR PROTAC临床的国内药企。去年4月,百济神州曾公布了EGFR PROTAC专利。
国外企业C4 Therapeutics在EGFR PROTAC布局较为靠前,其针对EGFR L858R突变的降解剂CFT8919已经申报临床。
不过,目前EGFR PROTAC药物仍然处于早期临床阶段,最终能否成功解决EGFR耐药问题,还需要时间证明。
靶向EGFR的新技术LYTAC
2020年,Bertozzi等人开发了一种名为溶酶体靶向嵌合体(LYTACs)的新方法,以促进细胞外蛋白的降解,包括分泌蛋白、细胞表面受体和膜蛋白,通过溶酶体途径。
LYTAC系统包括2个主要部分,一部分是与待降解的底物蛋白对应的特异性抗体,可以特异性的结合需要降解的底物蛋白;另一部分是能与溶酶体靶向受体(LTRs)结合的含M6P支链的NCA聚糖肽(n=20~90),保证另一端的底物蛋白可以随着LTR一起进入溶酶体然后完成降解。
Bertozzi等人选择FDA批准的EGFR抗体药物西妥昔单抗来制造LYTAC,导致HeLa细胞中70%的EGFR降解。在第二代LYTACs中,通过基于DBCO-叠氮化物的点击反应,将与新受体去唾液酸糖蛋白受体(ASGPR)结合的三能N-乙酰半乳糖胺(tri-GalNAc)基序与西妥昔单抗融合。这种基于配体的西妥昔单抗不仅表现出与第一代相当的EGFR降解,而且还实现了细胞类型选择性。LYTACs的设计增强了对膜/细胞外蛋白的抑制,并带来了基于抗体的治疗的革新(图9)[4]。
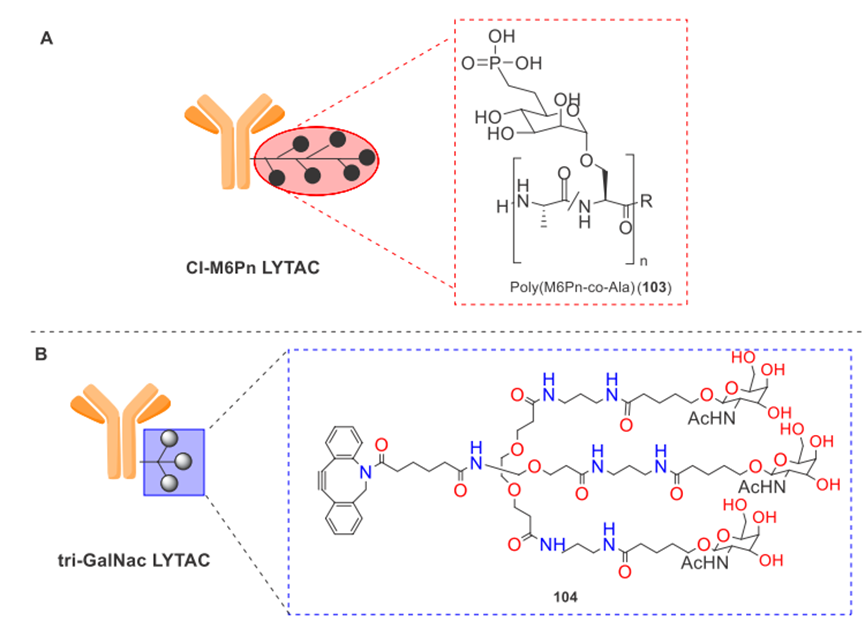
图9. A. CI-M6Pn LYTAC的一般代表;B. tri-GalNAc LYTAC的一般代表
小 结
EGFR一直是很热门的肿瘤的靶点,目前市场上已经有三代靶向小分子药物上市,而且四代药物也在研究中,但是不可避免都会出现耐药性问题,为了避免这些问题,需要开发一些新的研究技术,包括PROTAC和LYTAC等。
目前国内外药企关于EGFR的PROTACs布局的不多,可能是因为PROTACs的分子量大导致成药性差,也可能是选择性降解野生型和突变型EGFR蛋白的问题。未来在开发EGFR的PROTACs的问题上需要减少PROTACs的分子量来改善成药性以及提高对野生型EGFR蛋白选择性。希望未来可以利用EGFR的PROTACs技术解决耐药性问题。
关于EGFR的LYTACs的研究更少,LYTACs还有很多不足之处需要被完善,对于它的研究尚处于早期阶段,未来还是有很大研究前景,令人期待。
References
1.Pritam Maity, Joydeep Chatterjee, Kiran T. Patil, Sahil Arora, Madhurendra K. Katiyar, Manvendra Kumar, Amirreza Samarbakhsh, Gaurav Joshi, Priyadeep Bhutani, Manoj Chugh, Navnath S. Gavande, and Raj Kumar, Targeting the Epidermal Growth Factor Receptor with Molecular Degraders: State-of-the-Art and Future Opportunities, J. Med. Chem. 2023, 66, 3135?3172.
2.Dawei Hong, Bizhong Zhou, Bei Zhang, Hao Ren, Liquan Zhu, Guowan Zheng, Minghua Ge, Jingyan Ge, Recent advances in the development of EGFR degraders: PROTACs and LYTACs, European Journal of Medicinal Chemistry Volume 239, 5 September 2022, 114533.
3.Qingqing Pan, Yao Lu, Li Xie, Di Wu, Rong Liu, Wenxia Gao, Kui Luo, Bin He, and Yuji Pu, Recent Advances in Boosting EGFR Tyrosine Kinase Inhibitors-Based Cancer Therapy, Mol. Pharmaceutics 2023, 20, 829?852.
4.G. Ahn, S.M. Banik, C.L. Miller, N.M. Riley, J.R. Cochran, C.R. Bertozzi, LYTACs that engage the asialoglycoprotein receptor for targeted protein degradation Nat. Chem. Biol., 17 (2021), pp. 937-946.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57