进入6月,各大媒体版面纷纷被ASCO会议占据,又是一年一度“秀肌肉”时候。
ASCO全称为美国临床肿瘤学会(American Society of Clinical Oncology),成立于1964年,发展至今,已然成为世界范围内规模最大、影响力最大的临床肿瘤学会议。
之所以说“秀肌肉”,是因为很多企业会选择在此首次发布那些重要的临床研究和试验发现结果。对药企的利益相关者来说,重磅数据的发布,无疑增加了企业开发、盈利的确定性,进而推动企业估值上涨。
本届ASCO大会于6月2日-6日在美国伊利诺伊州芝加哥举办,采取线上+线下混合形式。根据大会官网,今年共有2900+摘要入选,其中有200多项新药研究入选大会口头报告(Oral Abstract)。口头报告可谓是ASCO大会交流等级最高的摘要,一般入选的都是代表性研究。
而随着本土创新药的崛起,在ASCO大会上亦可更多见到中国创新药企的身影。本届大会上,共有19项中国研究入选口头报告,涉及恒瑞医药、百济神州、君实生物、科伦药业、信达生物等知名药企。本文将节选部分企业,从新锐靶点、重点技术等方面,一览本土创新药的革新步伐。
恒瑞医药
PD-(L)1的故事仍在继续
恒瑞医药产出颇丰:本届年会上,共有8款抗肿瘤创新药的57项研究入选,研究范围覆盖妇科肿瘤、淋巴瘤、乳腺癌、肝胆胰 腺肿瘤、消化道肿瘤、肺癌等领域。
恒瑞入选口头报告、壁报讨论的产品
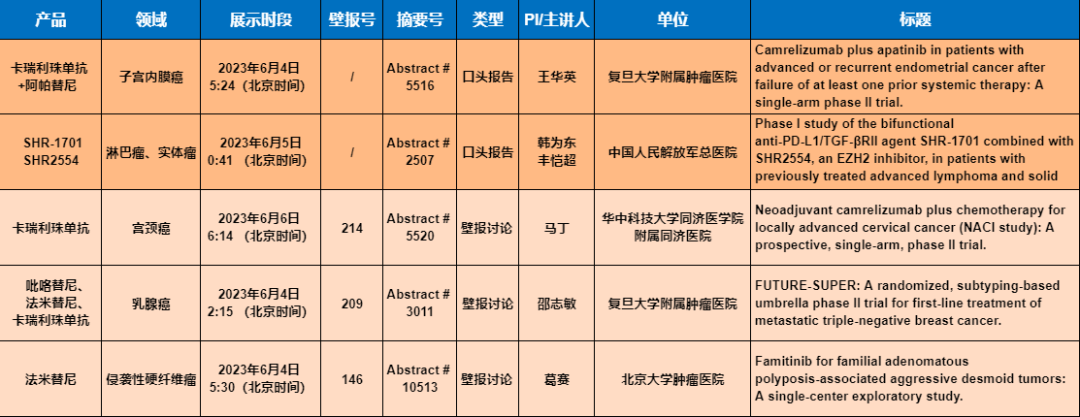
入选口头报告的有两项研究,分别是抗PD-L1/TGF-βRII双抗SHR-1701+EZH2抑制剂SHR2554组合的期研究,PD-1单抗卡瑞利珠单抗+VEGFR单抗阿帕替尼组合的II期研究。
SHR-1701+SHR2554组合
SHR-1701+SHR2554组合,主要用于2线治疗淋巴瘤和实体瘤。在纳入的既往接受过治疗的33例晚期淋巴瘤和实体瘤患者中,并未观察到剂量限制性毒 性;在疗效可评估人群 (n=26) 中,客观缓解率(ORR)为57.7%,包括转移性肾细胞癌和经典霍奇金淋巴瘤 (cHL) 患者实现的2例完全缓解(CR)。
卡瑞利珠单抗联合阿帕替尼
卡瑞利珠单抗联合阿帕替尼,就是大名鼎鼎的“双艾”组合。这一次入选是2线治疗子宫内膜癌的II期研究。根据摘要,在36例疗效可评估人群中,ORR为44.4%,2例CR,14例部分缓解(PR),16例疾病稳定(SD);疾病控制率为88.9%,中位无进展生存期为6.4个月。
信达生物
更多创新,信迪利单抗走向更远商业化
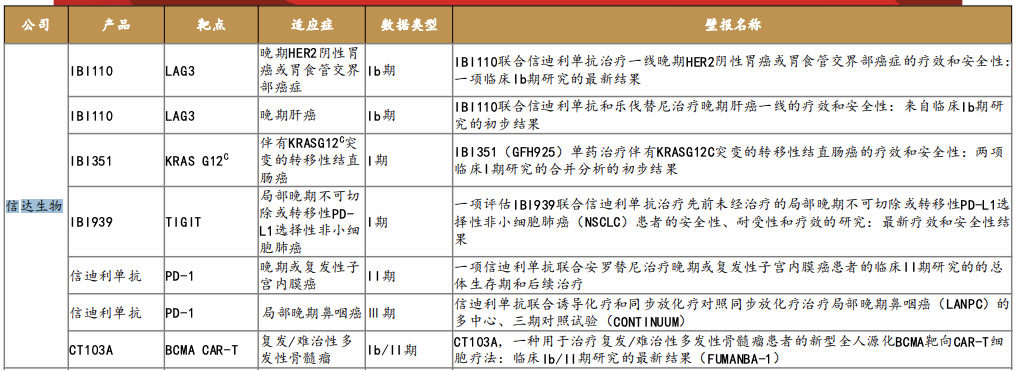
信达取得了中国口头报告中的LBA(Late Breaking Abstrac)中的一席——信迪利单抗联合诱导化疗和同步放化疗(IC-CCRT)对比IC-CCRT治疗局晚期鼻咽癌的III期临床研究(CONTINUUM)结果以LBA口头报告形式公布。
LBA为延迟公布摘要,均为新颖的,创新的具有高度科学意义的重磅研究。所以一般都是事前保密,在会议前夕才公布,堪称会议的压轴之作。
本项研究的重点在于,它是首 个将PD-1抑制剂联合IC-CCRT用于治疗局晚期鼻咽癌疗效和安全性的大型III期随机对照临床研究。与标准治疗IC-CCRT相比,信迪利单抗的加入显著降低疾病复发或死亡风险41%,3年无事件生存率增加10%,不良反应有所增加,但大部分通过暂停治疗或者对症治疗得到缓解。
信迪利单抗目前已经获批了5大高发瘤种——非鳞状非小细胞肺癌,鳞状非小细胞肺癌、肝癌、胃癌、食管癌的一线治疗,并已纳入国家医保。此次在鼻咽癌的突破,有望为其带来更进一步商业化营收。
信达生物入选ASCO产品
君实生物
特瑞普利单抗多面开花
在PD-1的激烈竞争中,特瑞普利单抗的赢面似乎变得更大。在本届ASCO大会上,共有5项关于特瑞普利单抗的研究入选口头报告,其中一项关于三阴性乳腺癌的研究为LBA。
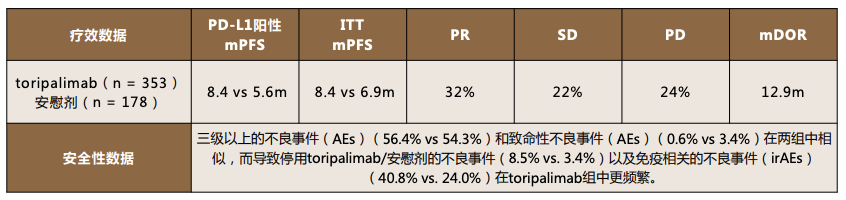
TORCHLIGHT研究是一项针对转移性或复发性三阴性乳腺癌(TNBC)患者的随机、双盲III期试验,该试验中特瑞普利单抗联合白蛋白结合型紫杉醇与安慰剂对照。这是我国首 个在晚期TNBC免疫治疗领域取得阳性结果的III期注册研究——联合组可显著延长PFS,并在次要终点OS上也表现出明显的获益趋势。
根据君实生物,目前特瑞普利单抗联合白蛋白结合型紫杉醇用于PD-L1阳性(CPS≥1)的初治转移或TNBC的治疗的新适应症的上市申请已获受理。此为特瑞普利单抗在国内提交的第8项上市申请。
III期TORCHLIGHT研究数据
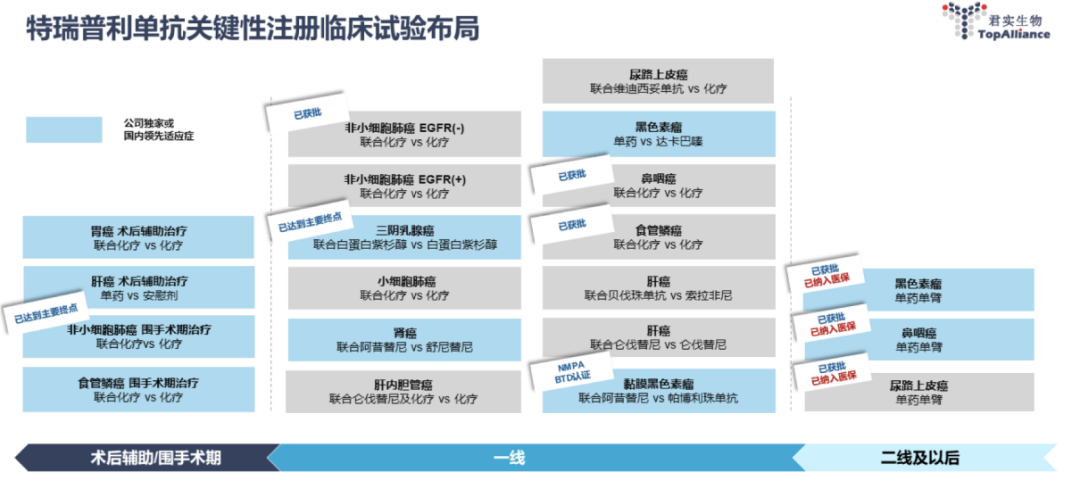
此外,可圈可点的是特瑞普利单抗在新辅助疗法中的介入。此次口头报告涉及到可切除II/III期非小细胞肺癌的围手术期治疗、辅助治疗可切除的黏膜黑色素瘤、局部晚期胃或胃食管结合部癌的围手术期治疗。
III期研究Neotorch中,特瑞普利单抗联合含铂双药化疗与化疗对照。这是全球首 个抗PD-1单抗用于NSCLC围手术期(涵盖新辅助和辅助治疗)治疗达到无事件生存期(EFS)阳性结果的III期临床研究。
ASCO会议公布出更多信息:联合组可显著延长患者的EFS,将疾病复发、进展或死亡风险降低60%;中位OS分别为未成熟vs0.4个月;1年和2年OS率分别为94.4%vs89.6%和81.2%vs74.3%。两组TEAE率相似。
特瑞普利单抗临床布局
科伦药业
下一代选择性RET抑制剂
由科伦药业控股子公司科伦博泰开发的新一代选择性RET抑制剂KL590586,用于RET基因改变的晚期实体瘤的I期研究数据,成为该公司本届ASCO入选口头报告的“一枝花”。
KL590586是一种小分子选择性靶向RET激酶抑制剂,用于RET基因融合或突变的晚期实体瘤的治疗。RET基因融合或突变是导致多种实体肿瘤生长和增殖的关键驱动因子,而KL590586具有泛瘤种治疗的可能性以外,它还具有克服第一代RET抑制剂的潜力。
本次公布的I期研究数据,包括剂量递增和剂量扩增两个阶段。在疗效方面,在69名例接受有效剂量治疗的患者中,ORR达到64%;截至数据截止日,绝大部分患者(58/69)仍在接受治疗,最长治疗时间超过11个月;既往接受过系统治疗的患者中,ORR达到63%,DCR达到91%,中位DoR未达到。
在安全性方面,没有观察到剂量限制性毒 性,且最大耐受剂量也未达到。
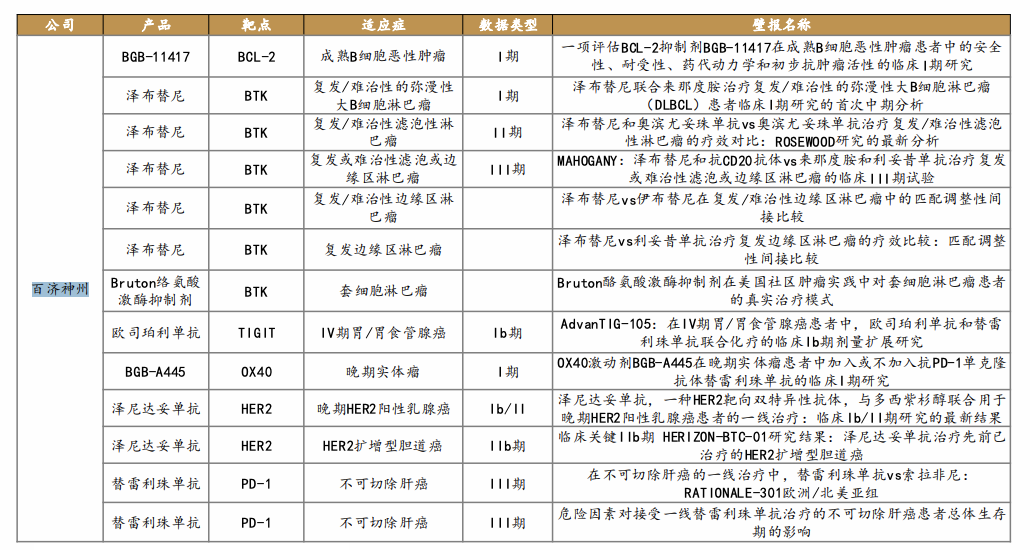
百济神州
HER2双抗ORR达41%
百济神州在这次大会上,口头报告了HER2双抗泽尼达妥单抗治疗既往已经接受治疗的HER2扩增型胆道癌的关键性IIb期HERIZON-BTC-01研究结果。
泽尼达妥单抗是一种具有新作用机制的HER2靶向在研双特异性抗体,可靶向HER2蛋白上两个不重复的抗原表位,通过与HER2结合阻碍其信号传递。目前,泽尼达妥单抗已获FDA授予快速通道资格、孤儿药资格治疗胃食管腺癌,并在中国获得突破性疗法认定。泽尼达妥单抗被施以重望,或有可能成为首 款针对胆道癌的HER2靶向疗法。
根据HERIZON-BTC-01研究的摘要信息,在HER2阳性患者中,cORR达到41%,DOR为12.9个月;截止2022年10月10日,在33名应答者中,49%有持续应答,82%的DOR≥16周。此外,安全性良好。
百济神州入选ASCO产品
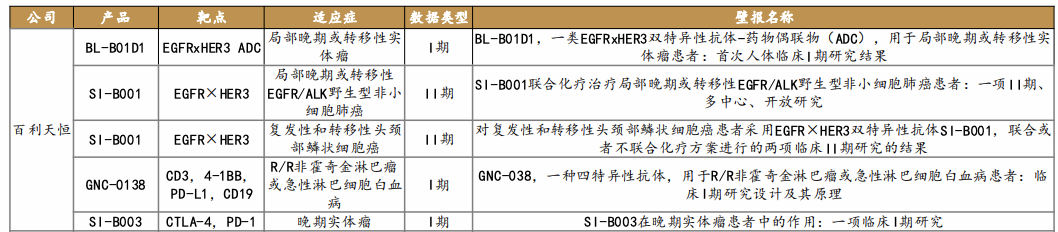
百利天恒
老牌药企转型中的双抗ADC
本届ASCO大会上,百利天恒共展示了5项重要临床研究成果,包括双抗SI-B001两项、SI-B003一项、四抗GNC-038一项和双抗ADC药物BL-B01D1一项。其中,BL-B01D1入选口头报告。
作为一家拥有26年历史的传统企业,百利天恒激进布局创新药。今年1月,百利天恒正式登陆上交所科创板,据称,所筹集资金将全部用于创新抗体药物研发。
BL-B01D1的亮点在于,它是目前唯一在临床阶段的靶向EGFR和HER3的双抗ADC,已在头颈、胸部、消化道、泌尿等多个治疗领域开展临床研究,特别在EGFR突变型非小细胞肺癌中表现出了令人惊艳的突破性疗效。
本次公布的是其在局部晚期或转移性实体瘤的I期临床研究结果。研究的各肿瘤的总ORR为45.3%,中位随访时间为4.1个月,PFS尚未达到。安全性方面,导致停药或不能耐受的不良事件(AE)发生率为3%,剂量下调发生率约为25%。目前未发现因药物治疗引起的间质性肺炎。
百利天恒入选ASCO产品
亘喜生物
CAR-T细胞疗法的推陈出新
亘喜生物入选口头报告的是关于GC012F的研究。GC012F是一款BCMA和CD19双靶点自体FasTCAR-T疗法,此次公布的是其治疗复发/难治性多发性骨髓瘤患者的多中心临床研究的长期随访数据。
截至2023年4月12日,中位随访时间为30.7个月。接受GC012F之后的患者,ORR为93.1%(27/29),其中89.6%(26/29)的患者达到非常好的部分缓解(VGPR)及以上的疗效;82.8%(24/29)的患者达到MRD-sCR;100%(29/29)的患者达到MRD阴性。值得一提的是,能维持MRD-状态12个月的患者,预计其36个月时的无进展生存率可以达到100%。
此外,在长期随访过程中,并未发现新的安全性事件,包括未出现任何神经毒 性事件。
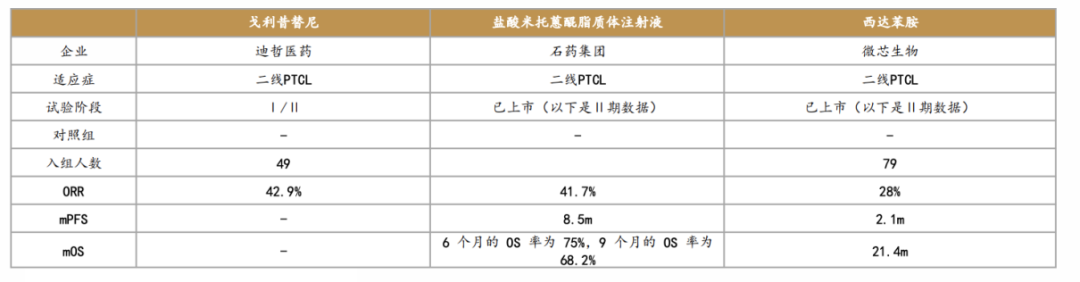
迪哲医药
TKI与JAK1抑制剂的创新之路
迪哲医药共有两项入选口头报告的研究,分别为舒沃替尼治疗EGFR 20外显子插入突变型的初治非小细胞肺癌患者的疗效和安全性、JAK1抑制剂戈利昔替尼治疗难治性或复发性外周T细胞淋巴瘤。
舒沃替尼是一款口服、不可逆、针对多种EGFR突变亚型的高选择性EGFR酪氨酸激酶抑制剂(TKI),凭借出色的疗效和安全性,分别于2020年和2022年获得中国、美国突破性疗法认定,成为迄今为止肺癌领域首 个且唯一获得中、美两国双BTD的I类新药。
根据ASCO摘要,对于EGFR 20外显子插入突变型的晚期非小细胞肺癌,经过舒沃替尼治疗的二/后线ORR为60.8%,一线ORR为77.8%;针对TKI耐药的EGFR敏感突变型晚期非小细胞肺癌,中位PFS达到5.8月,中位DoR为6.5月。
戈利昔替尼是T细胞淋巴瘤领域全球首 个且迄今为止唯一处于全球注册临床阶段的高选择性JAK1抑制剂,难治性或复发性外周T细胞淋巴瘤是这款药物的首 个适应症,戈利昔替尼也因此于2022年获得FDA的快速通道认定。
此次大会上,公布的是国际多中心关键研究(JACKPOT8)的主要结果。在112例患者中,戈利昔替尼单药强效持久的抗肿瘤活性,ORR达44.3%,且其中一半以上肿瘤缓解的受试者达到了完全缓解,最长DoR超过16个月。
二线治疗T细胞淋巴瘤同类药物对比
参考资料
1.恒瑞医药公众号
2.信达生物公众号
3.君实生物公众号
4.亘喜生物公众号
5.医药观澜公众号



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57