众所周知,印度以其强大的仿制药生产能力,被标榜为“世界药房“。但印度制造,在创造一个个神话的同时,也在滋生一个个的丑闻。
不断涌现的质量和监管法规问题,令FDA对“世界药房”万分警惕。虽然FDA有些投鼠忌器,担心对供应链造成破坏作用,但依然痛下杀手禁止问题印度药的进口。
被禁止进入市场,印度制药的代价自然是沉重的。这不仅意味着短期收入的消失,更有可能给竞争对手带来机会。不久前,齐鲁制药便抓住了这一机会,成功将化疗药物顺铂注射液临时进口美国。
不过,对于国内企业来说,印度制造问题同时还有警示作用。当前,更多的国内药企希望将创新药打入美国市场。
而印度药企的真实经历告诉我们,要想在海外实现可持续发展,不能仅仅靠价格,还包括对质量与监管法规的高度遵守。
屡屡被禁的“药房”
被印度总理自豪地成为“世界药房“的印度,屡屡因为自身问题而导致后院起火。因为,他们在质量和监管方面的巨大问题甚至在全球频频引发命案。
这让FDA对于印度制药业的种种问题越来越重视。在大部分情况下,FDA的态度选择“隐忍”。因为,“质量”问题造成的停产,意味着会让美国药物陷入紧缺状态。
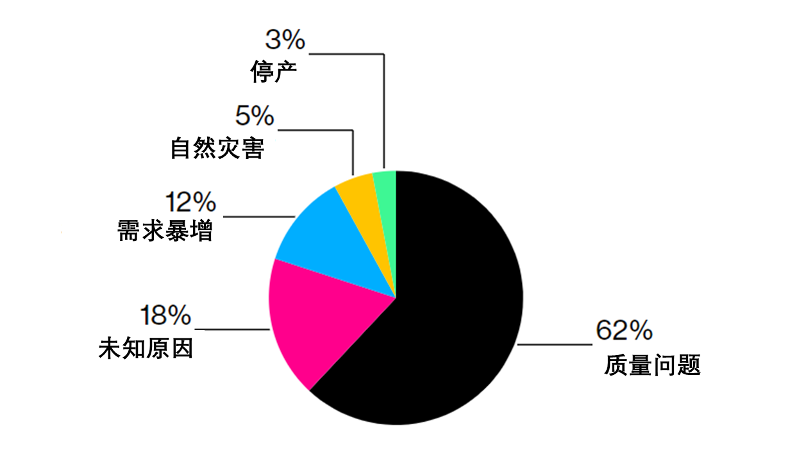
早在2019 年,FDA就表示,62% 的药品短缺是由质量问题引起的。
但在印度药厂的一再拉垮下,重拳将会持续出击,最著名的例子就是Ranbaxy。
2013年,FDA禁止印度仿制药公司Ranbaxy的产品进入美国市场。禁令的起因,是Ranbaxy胆大妄为地向FDA提供了虚假文件,帮助其产品达到质量标准,而且在另一家没有资质的生产设施中制造药品。
Ranbaxy接受了FDA的指控,并支付了5亿美元的罚款。这创造了当时仿制药公司违反《联邦食品、药品和化妆品法》的最大经济处罚。
近年来,因为质控问题被禁止进入美国市场的例子,依然屡见不鲜。
例如,去年FDA在现场检查时发现,Intas 公司的药物质控极差,实验室记录不完整、菌落统计不规范,质量部门监管不力等问题不胜枚举。
也正因此,FDA决定停止Intas的化药进口工作,直至其顺铂生产线整改完成。虽然后续FDA已和Intas制定了重启顺铂生产的计划,但具体日期尚未确定。
可以说,在质量问题下,印度药房部分产业的位置,变得很尴尬。
此消彼长的世界
胜利的机会,通常是对手为你提供的。印度药企不断惹火上身,必然会给其它竞争对手留下突围空间。
对于药企来说,一旦受到FDA出口限制,无非两个选择:转移至合规工厂或整改完成。但两个选择,均耗时费力。
因为审核等程序,若将生产转移至旗下另一家合规的工厂,大概需要6-9个月时间。而药企在原有工厂上解决FDA的警告问题,可能需要2-3年。
而对于紧张的药物供给来说,这必然给后来者超车的机会。印度药企问题所导致的药品短缺,使得美国开始将目光转向中国药企。
为了解决顺铂短缺问题,美国已向齐鲁制药进口这种救命药的仿制药,FDA直接为这批顺铂开了“后门”:齐鲁制药的顺铂不到2个月就完成了审批。
5月23日,FDA特许齐鲁制药顺铂注射液临时进口美国。紧急获批一周后,齐鲁制药一卡车的顺铂被运往美国救急。
并且,这批顺铂药品标签上的线形条形码,可能无法在美国的扫描系统上准确注册,需手动导入药品信息;
包装的纸箱没有《药品供应链安全法》要求的产品标识符等;甚至药物包装都是国内,药瓶上贴的都是中文。
在以往,这批华药并不符合FDA规范,难以获得市场准入资格;但如今,FDA选择“忽略”这些问题。
对于齐鲁制药来说,无疑迎来了新的机遇。当然,不仅仅是齐鲁制药,面对拉垮的印度药企,其它药企必然也会有类似机遇。
但话又说回来,中国公司的志向不应只是充当救火队员,还应该拥有在美国市场“扎下去”的长远目标。
制药行业并不像能富士康制造那样低门槛,为世界制药业提供原料药和成品药大任的国家,全世界寥寥无几。中国制药行业,必然是为数不多的选手之一。
长期以来,中国制药企业一直渴望打入利润丰厚的美国市场。但相对于印度的表现,国内企业迄今为止的成绩单还称不上优秀。
如今,印度药神的经常性翻车,也或许意味着中国制药机遇的悄然而至。当然了,对手犯错只是提供了一个天赐良机,但最终还是要依靠自身的实力,把握这样难得的机遇。
绝不能犯的错误
不过,对于中国药企来说,印度制药企业的拉垮表现,带来机遇的同时,还包括警示作用。
随着研发整体实力的增强,出海已经成为国内实力药企的必选项。
2019 年,百济神州创造了历史,其布鲁顿酪氨酸激酶抑制剂泽布替尼,成为第一个获准在美国使用的国产肿瘤药物,且近年来销售额表现出色,逐年增长。
在百济神州自主出海之后,传奇生物的血癌CAR-T 疗法Carvykti®也以借船的方式,成功登陆美国市场。2022年,在强生的推进下,Carvykti®正式获得FDA核准上市。
除了这些成功的先驱之外,还有诸多后备选手摩拳擦掌,准备完成出海壮举。例如,在主导了本土市场之后,国产PD-1也在尝试进军美国市场。
然而,印度药企的真实经历告诉我们,要想在海外实现可持续发展,不能仅仅靠价格,更重要的是质量与监管法规的高度遵守。
实际上,国产PD-1出海的历程中,也存在因为“制造”问题的小波澜。今年5月31日,在经历了2年的等待后, Coherus发布公告表示,FDA已完成对特瑞普利单抗中国制造基地的相关检查。
不过,在检查过后,FDA向君实生物签发了“483”表格,对三项观察结果进行了标记。所谓“483表格”,指的是FDA对生产FDA监管产品的制药公司进行检查,并将其意见记录在FDA 483表格上,通常缩写为“483”。
“483 表格”对于药企来说非常重要,一个 483表可以准确地告诉公司哪些方面需要改进或纠正,以从偏离正轨的道路上重新回归,并保持合规性。
药企在收到 483 表后,有15天的时间做出回应,列举出它们对FDA提出问题的相对应纠正措施计划,然后迅速实施这些措施,以纠正错误。
对于FDA出具的“483表格”,Coherus 认为其中提出的问题很容易解决,预计在 6 月初公司就能向 FDA 提交回应。但即便如此,依然对Coherus的股价造成了较大影响。
在人命关天的医药行业,制造问题向来都不是小烦恼。无论是在任何国家、地区销售药物,都要始终高标准、严要求。只有这样,药企才能持续巩固自身护城河,不给竞争对手可乘之机。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57