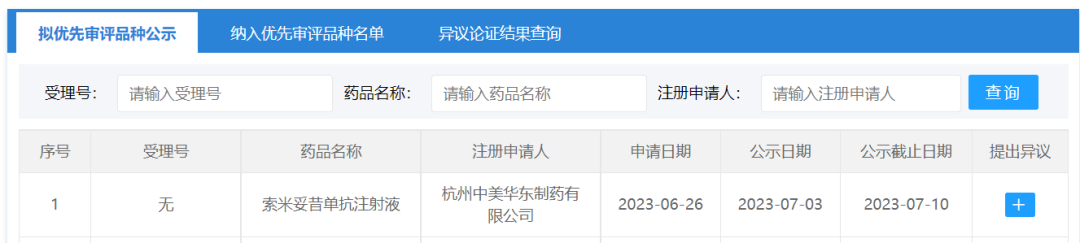
7月3日,CDE官网显示,杭州中美华东制药有限公司的索米妥昔单抗注射液拟纳入优先审评。
图片来源:CDE官网
全球首 款!
不日或将在华上市
索米妥昔单抗(ELAHERE)是一种免疫缀合物,由抗叶酸受体1(FRα)的人源化单克隆抗体M9346A组成。索米妥昔单抗的抗FRα单克隆抗体部分靶向并与细胞表面抗原FRα结合,抗体-抗原相互作用和内化后,免疫偶联物释放DM4,该DM4与微管蛋白结合并破坏微管组装/拆卸动力学,从而抑制表达FRα的肿瘤细胞的细胞分裂和细胞生长。
ELAHERE是全球首 款靶向FRα的ADC药物,也是全球首 款针对卵巢癌的ADC药物。
2022年11月15日,ELAHERE获FDA加速批准上市。据药智数据显示,除卵巢癌外,ELAHERE还被批准用于腹膜癌、输卵管癌、卵巢上皮癌等多类癌症。
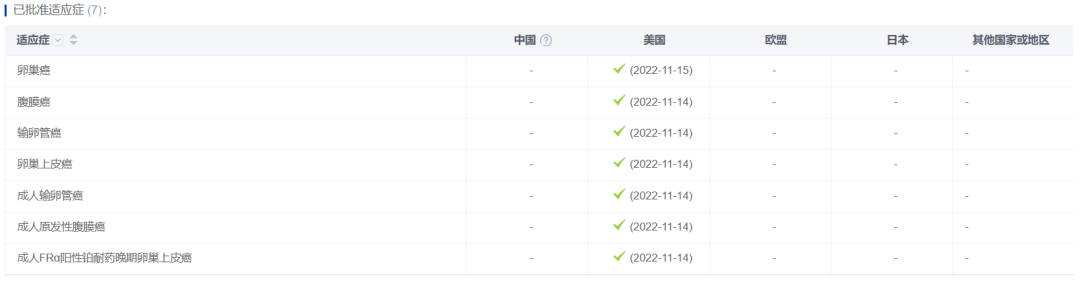
图片来源:药智数据——全球药物分析系统
ELAHERE由ImmunoGen开发,中美华东(华东医药子公司)拥有该产品在大中华区(含中国大陆、中国香港、中国澳门和中国台湾地区)的独家临床开发及商业化权益。
2021年3月,ELAHERE在中国首 个临床试验申请获得NMPA批准,包括一项国际多中心、随机、对照Ⅲ期研究和一项评价中国成人患者中的安全性、耐受性和药代动力学的Ⅰ期研究。另一项中国关键性单臂临床试验也于2021年8月获得NMPA批准。
7月3日,CDE同意按优先审评范围“(五)符合附条件批准的药品”将索米妥昔单抗注射液纳入优先审评审批程序,拟定适应症为既往接受过1-3种系统治疗的叶酸受体α(FRα)阳性的铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌成年患者。

图片来源:CDE官网
大刀落下,
斩向“妇癌之王”
被称为“妇癌之王”的卵巢癌对女性健康有着严重威胁,在我国,每年死于卵巢癌的女性约为2.5万,卵巢癌高居妇科恶性肿瘤之首,且发病率呈逐年上升的趋势。因早期症状不明显,且检查手段较匮乏,卵巢癌很难在早期被发现,大多数患者发现时已是晚期。
相关资料显示,即使经过标准的“肿瘤细胞减灭术+含铂化疗”疗法,依然有高达70%的卵巢癌患者会在3年内复发,并且再接受化疗后,大多数患者会产生铂类耐药性,最终陷入“无药可用”的境地。铂类药物耐药是晚期卵巢癌死亡的主要原因。
今年5月,ELAHERE的Ⅲ期临床试验(MIRASOL)数据公布,证实了该药对于叶酸受体FRα阳性的复发性铂类耐药卵巢癌患者疗效显著,能带来更好的总体生存期、无进展生存期以及抗肿瘤反应率,且并不会带来新的毒 性风险,安全性良好。
作为全球首 款可治疗铂耐药卵巢癌的ADC药物,索米妥昔单抗或将填补我国铂耐药卵巢癌患者治疗的空白。
小 结
目前,ELAHERE还在开展作为其他妇科癌症(如子宫内膜浆液性癌症)的药物联合使用试验,或许未来能在更广泛的领域发挥出更大的作用。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57